أمفيتامين
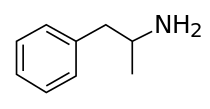
الامفيتامين[note 2] (Amphetamine، اختصار alpha-methylphenethylamine)، هو منشط للجهاز العصبي المركزي يستخدم لعلاج قصور الإنتباه وفرط الحركة، الخدار، والبدانة. أُكتشف الأمفيتامين كمادة كيميائية عام 1887 بواسطة لازار إدليانو، ثم كدواء في أواخر العشرينيات.[24] ويوجد كمتصاوغين متقابلين:[note 3] اللـِڤوامفيتامين والدكستروأمفيتامين. Amphetamine properly refers to a specific chemical, القاعدة الحرة الراسيمية، التي تشكل أجزاء متساوية من المتصاوغين في صورتهما الأمينية النقية. كثيرا ما يستخدم هذا المصطلح بشكل غير رسمي للإشارة إلى أي مجموعة من المتصاوغات المتقابلة، أو إلى أي منهما على حدة. تاريخياً، كان يستخدم لعلاج احتقان الأنف والاكتئاب. يستخدم الأمفيتامين أيضًا باعتباره محسناً للأداء الرياضي ومحسناً ذهنياً، ومن أجل الترفيه باعتباره منشطاً جنسياً ومحسناً للمزاج. وهو دواء يُصرف بوصفة طبية في العديد من البلدان، وغالبًا ما تخضع حيازة الأمفيتامين وتوزيعه بشكل غير مصرح به لرقابة مشددة بسبب المخاطر الصحية الكبيرة المرتبطة بالاستخدام الترفيهي.[sources 1]
كان البنزيدرين هو أول شكل صيدلاني للأمفيتامين، وهي علامة تجارية كانت تستخدم لعلاج مجموعة متنوعة من الحالات. حاليًا، يُوصف الأمفيتامين الصيدلاني كأمفيتامين راسيمي، الآديرال،[note 4] الدسكتروأمفيتامين، أو الدواء الأولي غير النشط الليسدكسأمفتامين. يزيد الأمفيتامين الناقل العصبي المثير وأحادي الأمين في المخ، مع استهداف تأثيراته الأكثر وضوحًا لأنظمة النقل العصبي للنورإپينفرين والدوپامين.[sources 2]
عند تناول الجرعات العلاجية، يسبب الأمفيتامين تأثيرات عاطفية ومعرفية مثل الابتهاج، وتغير في الرغبة الجنسية، وزيادة اليقظة، وتحسين التحكم المعرفي. وهو يؤدي إلى تأثيرات جسدية مثل تحسين وقت رد الفعل ومقاومة التعب وزيادة قوة العضلات. الجرعات الكبيرة من الأمفيتامين قد تضعف الوظيفة الإدراكية وتؤدي إلى انهيار العضلات السريع. يشكل الإدمان خطرًا كبيرًا مع الاستخدام المكثف للأمفيتامين الترفيهي، لكن من غير المرجح أن يحدث نتيجة للاستخدام الطبي طويل الأمد بجرعات علاجية. يمكن أن تؤدي الجرعات العالية جدًا إلى الذهان (على سبيل المثال، الوهام وجنون الارتياب) والذي نادرًا ما يحدث عند الجرعات العلاجية حتى أثناء الاستخدام طويل الأمد. عادة ما تكون الجرعات الترفيهية أكبر بكثير من الجرعات العلاجية الموصوفة وتحمل مخاطر أكبر بكثير من الآثار الجانبية الخطيرة.[sources 3]
ينتمي الأمفيتامين إلى فئة الفينيثيلامينات. وهو أيضًا المركب الأصلي لفئته الهيكلية الخاصة، الأمفيتامينات البديلة،[note 5] والتي تتضمن مواد شهيرة مثل البوپروپيون، الكاثينون، المثيلينديوكسي-مثامفيتامين، والمثامفتامين. كعضو في فئة الفينيثيلامينات، يرتبط الأمفيتامين أيضًا كيميائيًا بالمعدلات العصبية لأمينات النزرة الطبيعية، وعلى وجه التحديد الفينيثيلامين و ن-ميثيلفينيثيلامين، وكلاهما يُنتج داخل جسم الإنسان. الفينيثيلامين هو المركب الأصلي للأمفيتامين، بينما ن-ميثيلفينيثيلامين هو متزامر موضعي للأمفيتامين يختلف فقط في موضع مجموعة المثيل.[sources 4]
الاستخدامات
الطبية
يُستخدم الأمفيتامين لعلاج قصور الإنتباه وفرط الحركة (ADHD)، الخدار (اضطراب النوم)، والبدانة، ويُوصف أحيانًا من دون تصريح لدواعي استخدامه السابقة، وخاصة الاكتئاب والألم المزمن.[1][35][49]
قصور الإنتباه وفرط الحركة
في بعض الأنواع الحيوانية، من المعروف أن استخدام الأمفيتامين بجرعات عالية ولفترات طويلة يؤدي إلى تطور غير طبيعي في نظام الدوپامين أو تلف الأعصاب،[50][51] لكن لدى البشر المصابين بقصور الانتباه وفرط الحركة، يبدو أن الاستخدام طويل الأمد للأمفيتامينات الدوائية بجرعات علاجية يؤدي إلى تحسين تطور المخ ونمو الأعصاب.[52][53][54] تشير مراجعات دراسات التصوير بالرنين المغناطيسي إلى أن العلاج طويل الأمد بالأمفيتامين يقلل من التشوهات في بنية المخ ووظيفته لدى الأشخاص المصابين بفرط الحركة ونقص الانتباه، ويحسن الوظيفة في عدة أجزاء من المخ، مثل النواة المذنبة اليمنى من العقد القاعدية.[52][53][54]
أثبتت مراجعات أبحاث المنشطات السريرية سلامة وفعالية الاستخدام المستمر للأمفيتامين على المدى الطويل لعلاج فرط الحركة ونقص الانتباه.[43][55][56] أثبتت تجربة منضبطة معشاة حول العلاج المنشط المستمر للفرط الحركة ونقص الانتباه، والتي امتدت لمدة عامين، فعالية العلاج وسلامته.[43][55] أشارت مراجعتان إلى أن العلاج المنشط المستمر طويل الأمد لفرط الحركة ونقص الانتباه فعال في تقليل الأعراض الأساسية للحالة (أي فرط النشاط، وعدم الانتباه، والاندفاع)، وتعزيز جودة الحياة والتحصيل الأكاديمي، وإحداث تحسينات في عدد كبير من النتائج الوظيفية[note 6] عبر 9 فئات من النتائج المتعلقة بالتحصيل الأكاديمي، والسلوك المعادي للمجتمع، والقيادة، وتعاطي المخدرات، والبدانة، والحياة المهنية، واحترام الذات، واستخدام الخدمات (أي الخدمات الأكاديمية والمهنية والصحية والمالية والقانونية)، والأداء الاجتماعي.[43][56] سلطت إحدى المراجعات الضوء على تجربة عشوائية منضبطة مدتها تسعة أشهر لعلاج فرط الحركة ونقص الانتباه بالأمفيتامين لدى الأطفال، والتي وجدت زيادة متوسطة قدرها 4.5 نقطة ن.ذ.، واستمرار الزيادات في الانتباه، واستمرار الانخفاض في السلوكيات التخريبية وفرط النشاط.[55] أشارت مراجعة أخرى إلى أنه، استنادًا إلى أطول دراسات متابعة أجريت حتى الآن، فإن العلاج بالمنشطات مدى الحياة والذي يبدأ خلال مرحلة الطفولة يكون فعالًا بشكل مستمر للسيطرة على أعراض فرط الحركة ونقص الانتباه ويقلل من خطر الإصابة باضطراب تعاطي المخدرات في سن البلوغ.[43]
تشير النماذج الحالية لفرط الحركة ونقص الانتباه إلى أنه يرتبط بضعف وظيفي في بعض أنظمة الناقلات العصبية في المخ؛[57] تتضمن هذه الاعتلالات الوظيفية ضعف النقل العصبي للدوپامين في المسارات الدوپامينية والنقل العصبي للنورإپينفرين المسارات النورأدرينالية من الموضع الأزرق إلى قشرة الفص الجبهي.[57] تعتبر المنشطات النفسية مثل الميثيل فينيدات والأمفيتامين فعالة في علاج فرط الحركة ونقص الانتباه لأنها تزيد من نشاط الناقلات العصبية في هذه الأنظمة.[26][57][58] حوالي 80٪ ممن يستخدمون هذه المنشطات يلاحظون تحسنًا في اضطراب فرط الحركة ونقص الانتباه.[59] يتمتع الأطفال المصابون بفرط الحركة ونقص الانتباه والذين يستخدمون الأدوية المنشطة عمومًا بعلاقات أفضل مع أقرانهم وأفراد الأسرة، ويكون أداؤهم أفضل في المدرسة، ويكونون أقل تشتيتًا واندفاعًا، ويتمتعون بفترات انتباه أطول.[60][61] خلصت مراجعات كوكرين[note 7] حول علاج فرط الحركة ونقص الانتباه لدى الأطفال والمراهقين والبالغين الذين يستخدمون الأمفيتامينات الصيدلانية، أن الدراسات قصيرة المدى أثبتت أن هذه الأدوية تقلل من شدة الأعراض، لكن معدلات التوقف عن تناول الأدوية تكون أعلى عن الأدوية الغير منشطة بسبب آثارها الجانبية الخطرة.[63][64] أشارت مراجعة كوكرين حول علاج فرط الحركة ونقص الانتباه لدى الأطفال الذين يعانون من اضطراب التشنج اللاإرادي مثل متلازمة توريت إلى أن المنشطات بشكل عام لا تجعل التشنجات اللاإرادية أسوأ، لكن الجرعات العالية من الدكستروأمفيتامين يمكن أن تؤدي إلى تفاقم التشنجات اللاإرادية لدى بعض الأفراد.[65]
الخدار
الخدار هو اضطراب مزمن في النوم واليقظة يرتبط بالنعاس المفرط أثناء النهار، الجمدة، وشلل النوم.[66] تُشخص الحالات التي تعاني من الخدار على أنه مصابين بخدار النوع 1 أو النوع 2، مع ظهور أعراض الجمدة فقط في النوع الأول.[67] ينتج النوع الأول من الخدار عن فقدان ما يقرب من 70.000 من الخلايا العصبية المفرزة للأوركسين في الوطاء الجانبي، مما يؤدي إلى انخفاض كبير في مستويات الأوركسين الدماغي الشوكي؛[17][68] يعتبر هذا الانخفاض مؤشر حيوي تشخيصي لخدار النوع الأول.[67] تقوم عصبونات أوركسين المهاد الجانبي بتعصيب كل مكون من نظام التنشيط الشبكي الصاعد، والذي يتضمن النوى النورأدرينالينية، الدوپامينية، الهيستامينية، والسروتونينية التي تعزز اليقظة.[68][69]
يتضمن أسلوب عمل الأمفيتامين العلاجي في حالة الخدار في المقام الأول زيادة نشاط الناقل العصبي أحادي الأمين في نظام التنشيط الشبكي الصاعد.[17][70] يتضمن هذا الخلايا العصبية النورأدرينالية في الموضع الأزرق، والخلايا العصبية الدوپامينية في المنطقة السقيفية البطنية، والخلايا العصبية الهيستامينية في النواة الحدبية الحليمية، والخلايا العصبية السروتونينية في نواة الرفاء الخلفية.[69][71] الدكستروأمفيتامين، أكثر مضاد دوپاميني للأمفيتامين، وهو فعال بشكل خاص في تعزيز اليقظة لأن إطلاق الدوپامين له التأثير الأكبر على التنشيط القشري والإثارة المعرفية، مقارنة بأحاديات الأمين الأخرى.[17]
في المقابل، قد يكون لللـِڤوامفيتامين تأثير أكبر على الجمدة، وهو عرض أكثر حساسية لتأثيرات النورإپينفرين والسروتونين.[17] تشارك النوى النورادرينالية والسروتونينية في نظام التنشيط الشبكي الصاعد في تنظيم دورة نوم حركة العين السريعة وتعمل كخلايا "لإيقاف حركة العين السريعة"، مع تأثير الأمفيتامين على النورإپينفرين والسروتونين الذي يساهم في قمع نوم حركة العين السريعة واحتمال الحد من أعراض الجمدة عند تناول جرعات عالية.[67][17][69]
توصي إرشادات الممارسة السريرية الصادرة عن الأكاديمية الأمريكية لطب النوم لعام 2021 بشكل مشروط باستخدام الدكستروأمفيتامين لعلاج كلا النوعين 1 و2 من الخدار.[72] عادةً ما يكون العلاج بالأمفيتامينات الدوائية أقل تفضيلاً مقارنةً بالمنشطات النفسية الأخرى (على سبيل المثال، المودافينيل) ويعتبر خياراً علاجياً من الخط الثالث.[73][74][75] تشير المراجعات الطبية إلى أن الأمفيتامين آمن وفعال لعلاج الخدار.[17][72][74] يبدو أن الأمفيتامين هو الأكثر فعالية في تحسين الأعراض المرتبطة بفرط النعاس، حيث وجدت ثلاث مراجعات انخفاضًا ملحوظًا سريريًا في النعاس أثناء النهار لدى الحالات التي تعاني من الخدار.[17][72][74] بالإضافة إلى ذلك، تشير هذه المراجعات إلى أن الأمفيتامين قد يحسن أعراض الجمدة اعتمادًا على الجرعة.[17][72][74] ومع ذلك، فإن جودة الأدلة على هذه النتائج منخفضة، وبالتالي تنعكس في التوصية المشروطة الصادرة عن الأكاديمية الأمريكية لطب النوم باستخدام الدكستروأمفيتامين كخيار علاجي لمرض الخدار.[72]
تحسين الأداء
الأداء المعرفي
في عام 2015، وجدت مراجعة منهجية وتحليل تلوي تجارب سريرية عالية الجودة أنه عند استخدامه بجرعات منخفضة (علاجية)، ينتج الأمفيتامين تحسينات متواضعة لكن لا لبس فيها في الإدراك، بما في ذلك الذاكرة العاملة، الذاكرة العرضية طويلة المدى، التحكم التثبيطي، وبعض جوانب الانتباه، لدى البالغين الأصحاء الطبيعيين؛[76][77] من المعروف أن تأثيرات الامفيتامين المعززة للإدراك هذه تتحقق جزئيًا من خلال التنشيط غير المباشر لكل من مستقبل الدوپامين دي1 والمستقبل الأدريناليني ألفا2 في قشرة الفص الجبهي.[26][76] وجدت مراجعة منهجية من عام 2014 أن الجرعات المنخفضة من الأمفيتامين تعمل أيضًا على تحسين توطيد الذاكرة، مما يؤدي بدوره إلى تحسين تذكر المعلومات.[78] كما تعمل الجرعات العلاجية من الأمفيتامين على تعزيز كفاءة الشبكة القشرية، وهو التأثير الذي يحقق التحسينات في الذاكرة العاملة لدى جميع الأفراد.[26][79] كما تعمل الأمفيتامين ومنشطات اضطراب فرط الحركة ونقص الانتباه الأخرى على تحسين تحفيز المهام (الدافع لأداء مهمة) وزيادة الاستثارة (اليقظة)، مما يؤدي بدوره إلى تعزيز السلوك الموجه نحو الهدف.[26][80][81]
يمكن للمنشطات مثل الأمفيتامين أن تحسن أداء المهام الصعبة والمملة، ويستخدمها بعض الطلبة كوسيلة مساعدة للدراسة وأثناء الاختبارات.[26][81][82] استنادًا إلى دراسات حول الاستخدام غير المشروع للمنشطات المبلغ عنه ذاتيًا، يستخدم 5–35% من طلبة الجامعات منشطات علاج فرط الحركة ونقص الانتباه، والتي تستخدم في المقام الأول لتعزيز الأداء الأكاديمي بدلاً من استخدامها كأدوية ترفيهية.[83][84][85] ومع ذلك، فإن جرعات الأمفيتامين العالية التي تتجاوز النطاق العلاجي يمكن أن تتداخل مع الذاكرة العاملة والجوانب الأخرى للتحكم المعرفي.[26][81]
الأداء البدني
يستخدم بعض الرياضيين الأمفيتامين لفوائده النفسية وتأثيراته في تحسين الأداء الرياضي، مثل زيادة القدرة على التحمل واليقظة؛[27][39] ومع ذلك، يُحظر الاستخدام الغير طبي للأمفيتامين في الفعاليات الرياضية التي تنظمها وكالات مكافحة المنشطات الجماعية والوطنية والدولية.[86][87]
لدى الأشخاص الأصحاء الذين يتناولون جرعات علاجية عن طريق الفم، ثبت أن الأمفيتامين يزيد من قوة العضلات، acceleration, الأداء الرياضي في التمرينات اللا هوائية، والقدرة على التحمل (أي أنه يؤخر ظهور التعب)، مع تحسين زمن رد الفعل.[27][88][89] يعمل الأمفيتامين على تحسين القدرة على التحمل وزمن رد الفعل في المقام الأول من خلال تثبيط إعادة الامتصاص وإطلاق الدوپامين في الجهاز العصبي المركزي.[88][89][90]
يعمل الأمفيتامين والأدوية الدوپامينية الأخرى أيضًا على زيادة إنتاج الطاقة عند مستويات الجهد الملحوظ عن طريق تجاوز "مفتاح الأمان"، مما يسمح بزيادة حد درجة الحرارة الأساسية من أجل الوصول إلى القدرة الاحتياطية التي عادة ما تكون off-limits.[89][91][92] عند تناول الجرعات العلاجية، فإن الآثار الجانبية للأمفيتامين لا تعيق الأداء الرياضي؛[27][88] ومع ذلك، عند تناول جرعات أعلى بكثير، يمكن للأمفيتامين إحداث تأثيرات تضعف الأداء بشدة، مثل الانهيار السريع للعضلات وارتفاع درجة حرارة الجسم.[28][88]
الترفيهي
الأمفيتامين، على وجه التحديد أكثر مصاوغات الدكستروروتاتوري دوپامينية (دكستروامفيتامين)، يستخدم أيضًا بشكل ترفيهي كمنشط ومثير للشهوة الجنسية، ومثل الأمفيتامينات الأخرى؛ يستخدم مخدر حفلات لتأثيراته المثيرة للنشوة والنشاط. يستخدم الدكستروأمفيتامين (د-أمفيتامين) بطريقة ترفيهية بشكل كبير حيث يبلغ الأفراد عادةً عن شعورهم النشوة، وأكثر يقظة، وأكثر نشاطًا بعد تناول الدواء.[93][94][95] كان جزءًا ملحوظًا من الثقافة الحداثية في المملكة المتحدة هو استخدام الأمفيتامين الترفيهي، والذي كان يستخدمه الشباب لإكسابهم القدرة على الرقص طوال الليل الرقصات طوال الليل في نوادي نوادي مانشستر. وصفت تقارير صحفية خروج الراقصين من النوادي في الساعة الخامسة صباحًا وحدقات أعينهم متسعة.[96] كما استخدم شباب الحداثية الدواء من أجل التحفيز والتنبيه، والذي اعتبروه يعطي حالة مختلفة عن الثمالة الناجمة عن الكحول والمخدرات الأخرى.[96] يقول الدكتور أندرو ولسون أنه بالنسبة لأقلية كبيرة، "ترمز الأمفيتامينات إلى الصورة الذكية والرائعة على الكرة" وأنهم سعوا إلى "التحفيز وليس التسمم [...]، المزيد من الوعي وليس الهرب"، "الثقة والتعبير" بدلاً "الثمالة الصاخبة كما الأجيال السابقة".[96] تؤثر الخصائص الدوپامينية (المكافأة) للدكستروأمفيتامين على الدائرة الوسطية-الطرفية؛ مجموعة من البنى العصبية المسؤولة عن التميز التحفيزي (أي "الرغبة" أو الرغبة الشديدة في الحصول على مكافأة وتحفيز)، التعزيز الإيجابي ومشاعر التكافؤ الإيجابي، وخاصة تلك التي تنطوي على المتعة.[97] قد تنتج الجرعات الترفيهية الكبيرة من الدكستروأمفيتامين أعراض الجرعة الزائدة للدكستروأمفيتامين.[95] في بعض الأحيان يقوم هؤلاء الأشخاص الذين يستخدمون الدواء استخداماً ترفيهياً بفتح كبسولات الدكسيدرين وسحق محتوياتها من أجل شمها أو إذابتها في الماء وحقنها.[95] تتمتع تركيبات الإطلاق الفوري بإمكانية أعلى لاستخدامها كمخدرات عن طريق الشم أو الحقن في الوريد نظرًا لخصائصها الدوائية الأكثر ملاءمة ولسهولة سحقها (خاصة الأقراص).[98][99] يمكن أن يكون الحقن في مجرى الدم خطيرًا لأن الحشوات غير القابلة للذوبان الموجودة داخل الأقراص يمكن أن تسد الأوعية الدموية الصغيرة.[95] الإفراط المزمن في استخدام الدكستروأمفيتامين يمكن أن يؤدي إلى الإدمان بشكل حاد، مما يؤدي إلى الأعراض الانسحابية عند توقف تعاطي المخدر.[95]
موانع الاستخدام
بحسب البرنامج الدولي للسلامة الكيميائية (IPCS) وإدارة الغذاء والدواء الأمريكية (USFDA)،[note 8] يمنع استخدام الأمفيتامين على الأشخاص الذين لديهم تاريخ تعاطي المخدرات،[note 9] أمراض القلب والأوعية الدموية، التهيجية الشديدة، أو القلق الشديد.[35][28][101] كما يُمنع استخدامه من قبل الأفراد الذين يعانون من تصلب الشرايين المتقدم، الزرق (زيادة ضغط العين)، فرط الدرقية (الإنتاج المفرط لهرمون الغدة الدرقية)، أو ارتفاع ضغط الدم المعتدل إلى الشديد.[35][28][101] تشير هاتان الوكالاتان إلى أن الأشخاص الذين سبق وأن عانوا من ردود الفعل التحسسية تجاه المنشطات الأخرى أو الذين يتناولون مثبطات الأوكسيديز أحادي الأمين (MAOIs) يجب ألا يتناولوا الأمفيتامين،[35][28][101] هذا على الرغم من توثيق الاستخدام المتزامن الآمن للأمفيتامين ومثبطات الأوكسيديز أحادي الأمين.[102][103] تذكر هاتان الوكالاتان أيضًا أن أي شخص يعاني من فقدان الشهية العصبي، الاضطراب ثنائي القطب، أو الاكتئاب، أو ارتفاع ضغط الدم، أو مشاكل في الكبد أو الكلى، الهوس، الذهان، داء رينو، نوبات الصرع، مشكلات الغدة الدرقية، التشنجات اللاإرادية، أو متلازمة توريت يجب مراقبة الأعراض أثناء تناول الأمفيتامين.[28][101] تشير الأدلة المستمدة من الدراسات البشرية إلى أن استخدام الأمفيتامين العلاجي لا يسبب تشوهات في نمو الجنين أو الأطفال حديثي الولادة (أي المسخات)، لكن تعاطي الأمفيتامين يشكل مخاطر على الجنين.[101] ثبت أيضًا أن الأمفيتامين ينتقل إلى حليب الأم، لذا ينصح البرنامج الدولي للسلامة الكيميائية وإدارة الغذاء والدواء الأمريكية الأمهات بتجنب الرضاعة الطبيعية عند استخدامه.[28][101] ونظرًا لاحتمال حدوث ضعف انعكاسي في النمو،[note 10] توصي إدارة الغذاء والدواء الأمريكية بمراقبة طول ووزن الأطفال والمراهقين الذين يوصف لهم دواء الأمفيتامين.[28]
الآثار الدوائية الضارة
الآثار الجانبية الضارة للأمفيتامين كثيرة ومتنوعة، وكمية الأمفيتامين المستخدمة هي العامل الأساسي في تحديد احتمالية وشدة الآثار الضارة.[28][39] منتجات الأمفيتامين مثل أديرال ودكسدرين ومعادلاتها العامة معتمدة حاليًا من قبل إدارة الغذاء والدواء الأمريكية للاستخدام العلاجي على المدى الطويل.[36][28] الاستخدام الترفيهي للأمفيتامين بشكل عام يتضمن جرعات أكبر بكثير، والتي تنطوي على خطر أكبر للتأثيرات الدوائية الضارة الخطيرة مقارنة بالجرعات المستخدمة للأغراض العلاجية.[39]
الجسدية
قد تشمل الآثار الجانبية للأمفيتامين المتعلقة بالقلب والأوعية الدموية؛ ارتفاع ضغط الدم أو انخفاض ضغط الدم ناجم عن الاستجابة الوعائية المبهمية، داء رينو (انخفاض تدفق الدم إلى اليدين والقدمين)، والخفقان (زيادة معدل ضربات القلب).[28][39][104] قد تشمل الآثار الجانبية الجنسية لدى الذكور ضعف الانتصاب، أو الانتصاب المتكرر، أو الانتصاب الدائم.[28] قد تشمل الآثار الجانبية للجهاز الهضمي ألم البطن، الإمساك، الإسهال، والغثيان.[1][28][105] تشمل الآثار الجانبية الجسدية المحتملة الأخرى فقدان الشهية، ضبابية الرؤية، جفاف الفم، صرير الأسنان المفرط، نزيف الأنف، التعرق الغزير، التهاب الأنف الدوائي (احتقان الأنف الناجم عن المخدرات)، انخفاض عتبة النوبات، التشنجات اللاإرادية (نوع من اضطراب الحركة)، وفقدان الوزن.[sources 5] الآثار الجانبية الجسدية الخطيرة نادرة عند تناول الجرعات الصيدلانية النموذجية.[39]
يحفز الأمفيتامين المراكز التنفسية النخاعية، مما يؤدي إلى تنفس أسرع وأعمق.[39] لدى الأشخاص الطبيعيين، عند تناول الجرعات العلاجية، عادة لا يكون هذا التأثير ملحوظًا، لكن عندما يكون التنفس ضعيفًا بالفعل، فقد يكون واضحًا.[39]
يحفز الأمفيتامين أيضًا تقلص عضلة المثانة العاصرة، وهي العضلة التي تتحكم في التبول، مما قد يؤدي إلى صعوبة في التبول.[39] يمكن أن يكون هذا التأثير مفيدًا في علاج تبول الفراش وفقدان السيطرة على المثانة.[39] لا يمكن التنبؤ بآثار الأمفيتامين على الجهاز الهضمي.[39] إذا كان نشاط الأمعاء مرتفعًا، فقد يقلل الأمفيتامين من حركية الجهاز الهضمي (المعدل الذي يتحرك به المحتوى عبر الجهاز الهضمي)؛[39] ومع ذلك، قد يزيد الأمفيتامين من الحركية عند استرخاء العضلات الملساء في الجهاز الهضمي.[39] للأمفيتامين أيضًا تأثير مسكن طفيف ويمكن أن يعزز تأثيرات أشباه الأفيونيات في تخفيف الألم.[1][39]
تشير الدراسات التي أجريت بتكليف من إدارة الغذاء والدواء الأمريكية عام 2011 إلى أنه لدى الأطفال والشباب والبالغين لا يوجد ارتباط بين الأمراض القلبية الوعائية الخطيرة (الموت المفاجئ، النوبات القلبية، و السكتة الدماغية) والاستخدام الطبي للأمفيتامين أو منشطات اضطراب فرط الحركة ونقص الانتباه الأخرى.[sources 6] ومع ذلك، فإن مستحضرات الأمفيتامين الصيدلانية ممنوع استخدامها للأشخاص الذين يعانون من الأمراض القلبية الوعائية.[sources 7]
النفسية
في الجرعات العلاجية العادية، تشمل الآثار الجانبية النفسية الأكثر شيوعًا للأمفيتامين زيادة اليقظة، الخوف، التركيز، المبادرة، الثقة بالنفس والتواصل الاجتماعي، تقلب المزاج (المزاج المبتهج يتبعه مزاج مكتئب بشكل خفيف، أرق أو يقظة، وانخفاض الشعور بالتعب.[28][39] تشمل الآثار الجانبية الأقل شيوعًا القلق، والتغير في الدافع الجنسي، هوس العظمة، التهيجية، والسلوكيات المتكررة أو المُلحة، وعدم الارتياح؛[sources 8] تعتمد هذه الآثار على شخصية المستخدم وحالته العقلية الحالية.[39] قد يحدث ذهان الأمفيتامين (مثل التهيؤات وجنوب الارتياب) عند تعاطي الدواء بكميات كبيرة.[28][40][41] على الرغم من أنه نادر جدًا، إلا أن هذا الذهان يمكن أن يحدث أيضًا عند تناول جرعات علاجية طويلة الأمد.[28][41][42] وفقًا لإدارة الغذاء والدواء الأمريكية، "لا يوجد دليل منهجي" على أن المنشطات تنتج سلوكًا عدوانيًا أو عدائيًا.[28]
كما تبين أن الأمفيتامين ينتج تفضيل المكان المشروط لدى الأشخاص الذين يتناولون جرعات علاجية،[63][112] مما يعني أن الأشخاص يكتسبون تفضيلًا لقضاء الوقت في الأماكن التي سبق لهم استخدام الأمفيتامين فيها.[112][113]
اضطرابات التعزيز
الإدمان
| أظهرمسرد الإدمان والإعتياد [113][114][115][116] |
|---|
| معجم عوامل النسخ |
|---|
| • النسخ – نسخ الدنا الذي يقوم به پوليمريز الرنا إلى مرسال الرنا |
| • عامل – مادة، مثل الپروتين، تساهم في سبب تفاعل كيميائي حيوي معين أو عملية جسدية |
| • تنظيم النسخ – التحكمفي معدل نسخ الجينات على سبيل المثال من خلال مساعدة أو إعاقة ربط پوليمريز الرنا بالدنا |
| • تحسين التنظيم، التنشيط، أو التعزيز – يزيد معدل نسخ الجين |
| • تقليل التنظيم، القمع، أو التثبيط – يقلل معدل نسخ الجين |
| • المنشط المرافق – بروتين يعمل مع عوامل النسخ لزيادة معدل نسخ الجين |
| • تميم الكاظمة – بروتين يعمل مع عوامل النسخ لتخفيض معدل نسخ الجينات |
| عدِّل |
يشكل الإدمان خطرًا جديًا مع الاستخدام المكثف للأمفيتامين الترفيهي، لكن من غير المرجح أن يحدث نتيجة للاستخدام الطبي طويل الأمد بجرعات علاجية؛[44][45][74] في الواقع، العلاج بالمنشطات مدى الحياة لفرط الحركة ونقص الانتباه والذي يبدأ خلال مرحلة الطفولة يقلل من خطر الإصابة باضطراب تعاطي المخدرات عند البلوغ.[43] فرط النشاط المرضي للمسار الحوفي المتوسط، وهو مسار الدوپامين الذي يربط المنطقة السقيفية البطنية النواة المتكئة، يلعب دورًا مركزيًا في إدمان الأمفيتامين.[124][125] الأفراد الذين يتناولون ذاتياً جرعات عالية من الأمفيتامين لديهم خطر كبير للإصابة بإدمان الأمفيتامين، لأن الاستخدام المزمن بجرعات عالية يزيد تدريجياً من مستوى ΔFosB التراكمي، "المفتاح الجزيئي" و"پروتين التحكم الرئيسي" للإدمان.[114][126][127]
بمجرد أن يتم التعبير بشكل مفرط عن تراكم ΔFosB في النواة المتكئة، فإنها تبدأ في زيادة حدة السلوك الإدماني (أي البحث القهري عن المخدرات) مع زيادات أخرى في تعبيرها.[126][128] على الرغم من عدم وجود أدوية فعالة حاليًا لعلاج إدمان الأمفيتامين، يبدو أن ممارسة التمارين الرياضية بانتظام تقلل من خطر الإصابة بهذا الإدمان.[129][130] العلاج بالتمرين يحسن نتائج العلاج السريرية ويمكن استخدامه كعلاج مساعد مع العلاجات السلوكية للإدمان.[129][131][sources 9]
الآليات الجزيئة الحيوية
الاستخدام المزمن للأمفيتامين بجرعات مفرطة يسبب تغيرات في التعبير الجيني في الإسقاط الوسطي الطرفي، والتي تنشأ من خلال آليات نسخية وتخلقية.[127][132][133] من أهم عوامل النسخ[note 11] التي تنتج هذه التعديلات هي النديد ب للجين الورمي الفيروسي المسبب للساركوما العظمية الفأرية (ΔFosB)، پروتين ربط عنصر الاستجابة cAMP (CREB)، والعامل النووي كاپا-ب (NF-κB).[127] ΔFosB هي الآلية الجزيئية الحيوية الأكثر أهمية في الإدمان لأن فرط التعبير عن ΔFosB (أي مستوى عالٍ بشكل غير طبيعي من التعبير الجيني الذي ينتج النمط الظاهري) مرتبط بشكل واضح بالجينات في العصبونات الشوكية المتوسطة من النوع دي 1 الموجودة في النواة المتكئة هي شرط ضروري وكافي[note 12] للعديد من التكيفات العصبية وينظم التأثيرات السلوكية المتعددة (على سبيل المثال، الأحساس بالمكافأة وتصاعد التعاطي الذاتي للمخدرات) المرتبطة بالإدمان.[114][126][127] بمجرد أن يتم التعبير عن ΔFosB بشكل مفرد كافي، فإنه يؤدي إلى حالة إدمانية تصبح أكثر خطورة على نحو متزايد مع زيادات أخرى في تعبير ΔFosB.[114][126] وهي نفس الآلية المرتبطة بإدمان الكحول، القنبيات، الكوكايين، الميثيل فينيدات، النيكوتين، أشباه الأفيونيات، الفنسيكليدين، الپروپوفول، والأمفيتامينات البديلة، وغيرها.[sources 10]
عامل النسخ ΔJunD، وG9a (إنزيم هيستون ميثيل-ترانسفيراز)، كلاهما يعارض وظيفة ΔFosB ويمنع فرط التعبير عنه.[114][127][137] يمكن أن يؤدي الإفراط في التعبير عن ΔJunD في النواة المتكئة مع الناقلات الڤيروسية إلى منع العديد من التغيرات العصبية والسلوكية التي تظهر في تعاطي المخدرات المزمن (أي التغييرات التي تتم بوساطة ΔFosB).[127]
وبالمثل، يؤدي فرط التعبير التراكمي عن G9a إلى زيادة ملحوظة في هيستون 3 لايسين residue 9 dimethylation (H3K9me2) ويمنع الحث من خلال العصبية والمرونة السلوكية لـ ΔFosB عن طريق تعاطي المخدرات المزمن،[sources 11] الذي يحدث عن طريق التثبيط بواسطة H3K9me2 لعوامل نسخ ΔFosB والتثبيط بواسطة H3K9me2 لأهداف نسخ ΔFosB متعددة (على سبيل المثال CDK5).[127][137][138] كما يلعب ΔFosB دوراً هاماً في تنظيم الاستجابات السلوكية للمكافآت الطبيعية، مثل الطعام الشهي، والجنس، وممارسة الرياضة.[128][127][141] نظرًا لأن كلًا من المكافآت الطبيعية والعقاقير المسببة للإدمان يحفزان التعبير عن ΔFosB (أي أنهما يتسببان في إنتاج المخ للمزيد منه)، فإن الاستحواذ المزمن على هذه المكافآت يمكن أن يؤدي إلى حالة مرضية مماثلة للإدمان.[128][127] وبالتالي، فإن ΔFosB هو العامل الأكثر أهمية الذي يشارك في كل من إدمان الأمفيتامين والإدمان الجنسي الناجم عن الأمفيتامين، وهي سلوكيات جنسية قهرية تنتج عن النشاط الجنسي المفرط وتعاطي الأمفيتامين.[128][142][143] يرتبط هذا الإدمان الجنسي بمتلازمة خلل تنظيم الدوپامين التي تحدث لدى بعض المرضى الذين يتناولون أدوية دوپامينية.[128][141]
إن تأثيرات الأمفيتامين على تنظيم الجينات تعتمد على الجرعة والطريق.[133] تعتمد معظم الأبحاث المتعلقة بتنظيم الجينات والإدمان على الدراسات التي أجريت على الحيوانات والتي تم فيها إعطاء الأمفيتامين عن طريق الوريد بجرعات عالية جدًا.[133] وتشير الدراسات القليلة التي استخدمت جرعات علاجية بشرية مكافئة (معدلة حسب الوزن) والتناول عن طريق الفم إلى أن هذه التغيرات، إذا حدثت، تكون طفيفة نسبيا.[133] ويشير هذا إلى أن الاستخدام الطبي للأمفيتامين لا يؤثر بشكل كبير على تنظيم الجينات.[133]
العلاجات الدوائية
اعتباراً من ديسمبر 2019، لم يكن هناك علاج دوائي فعال لإدمان الأمفيتامين.[144][145][146] أشارت المراجعات من عامي 2015 و2016 إلى أن منبهات TAAR1 الانتقائية تتمتع بإمكانات علاجية كبيرة كعلاج لإدمان المنشطات النفسية؛[38][147] إلا أنه اعتباراً من فبراير 2016، فإن المركبات الوحيدة المعروفة بأنها تعمل كمنشطات انتقائية لـ TAAR1 هي الأدوية التجريبية.[38][147] يحدث إدمان الأمفيتامين إلى حد كبير من خلال زيادة تنشيط مستقبلات الدوپامين وco-localized مستقبلات ن-مثيل-د-أسپارتات[note 13] في النواة المتكئة؛[125] تمنع أيونات المغنيسيوم مستقبلات ن-مثيل-د-أسپارتات عن طريق منع مستقبل قناة الكالسيوم.[125][148] أشارت إحدى المراجعات، استنادًا إلى الاختبارات التي أجريت على الحيوانات، إلى أن الاستخدام المرضي للمنشطات النفسية (المسببة للإدمان) يقلل بشكل كبير من مستوى المغنيسيوم داخل الخلايا في جميع أنحاء المخ.[125] ثبت أن العلاج بمكملات المغنسيوم[note 14] يقلل من التعاطي الذاتي للأمفيتامين (أي الجرعة التي يتعاطاها الشخص) لدى البشر، لكنه لم يظهر لكنها ليست علاجًا وحيدًا فعالًا لإدمان الأمفيتامين.[125]
عام 2019 أجرى فريق من الباحثين مراجعة منهجية وتحليل تلوي لتقييم فعالية 17 علاجًا دوائيًا مختلفًا مستخدمًا في التجارب السريرية العشوائية (RCTs) لعلاج إدمان الأمفيتامين والميثامفيتامين؛[145] وقد وجدت فقط أدلة ضعيفة القوة على أن الميثامفيتامينات قد يقلل من الأمفيتامين أو التعاطي الذاتي للميثامفيتامين.[145] كانت هناك أدلة منخفضة إلى متوسطة القوة على عدم وجود فائدة لمعظم الأدوية الأخرى المستخدمة في التجارب السريرية العشوائية، والتي تضمنت مضادات الاكتئاب (البوپروپيون، الميرتازاپين، السيرترالين)، مضادات الذهان (الأريپيپرازول)، مضادات الاختلاج (التوپيراميت، الباكلوفين، الگاباپنتين)، النالتريكسون، الڤارينيكلين، السيتيكولين، الأوندانسيترون، الپروميتا، الريلوزول، الأتوموكستين، الدكستروأمفيتامين، والمودافينيل.[145]
العلاجات السلوكية
وجدت مراجعة منهجية وتحليل تلوي شبكي أجريا عام 2018 لخمسين 50 تجربة شملت 12 تدخلاً نفسيًا اجتماعيًا مختلفًا لإدمان الأمفيتامين أو الميثامفيتامين أو الكوكايين أن العلاج المركب مع كل من إدارة العوارض ونهج التعزيز المجتمعي كان له أعلى فعالية (أي معدل الامتناع) وقبول (أي أدنى معدل انسحاب).[149]
وشملت طرق العلاج الأخرى التي فُحصت في التحليل المعالجة الأحادية مع إدارة العوارض أو نهج التعزيز المجتمعي، العلاج السلوكي المعرفي، برامج 12 خطوة، والعلاجات غير المشروطة القائمة على المكافأة، العلاج النفسي الديناميكي، وغيرها من العلاجات المركبة التي تنطوي على هذه الطرق.[149]
بالإضافة إلى ذلك، تشير الأبحاث حول التأثيرات العصبية الحيوية للتمرينات البدنية إلى أن التمارين الهوائية اليومية، وخاصة تمارين التحمل (على سبيل المثال، الجري الماراثوني)، تمنع تطور إدمان المخدرات وهي علاج مساعد فعال (أي علاج تكميلي) لإدمان الأمفيتامين.[sources 9] يؤدي التمرين إلى نتائج علاجية أفضل عند استخدامه كعلاج مساعد، وخاصة لإدمان المنشطات النفسية.[129][131][150] تعمل التمارين الهوائية على وجه الخصوص على تقليل تعاطي المنشطات النفسية ذاتيًا، وتقلل من إعادة التنشيط (أي الانتكاس) في البحث عن المخدرات، وتحفز زيادة كثافة مستقبل الدوپامين د2 (DRD2) في الجسم المخطط.[128][150] وهذا هو عكس استخدام المنشطات المرضية، والذي يسبب انخفاض كثافة DRD2 المخططية.[128] أشارت إحدى المراجعات إلى أن التمارين البدنية قد يمنع أيضًا تطور إدمان المخدرات عن طريق تغيير ΔFosB أو c-Fos التفاعل المناعي في المخطط أو أجزاء أخرى من نظام المكافأة.[130]
| شكل اللدونة العصبية أو اللدونة السلوكية |
نوع المُعزز | المصادر | |||||
|---|---|---|---|---|---|---|---|
| الأفيونيات | المنبهات النفسية | الأغذية الغنية بالدهون أو السكريات | الجماع الجنسي | التمرينات الرياضية (الهوائية) |
التعزيز البيئي | ||
| تعبير ΔFosB في النويات المكتئة D1-type MSNs |
↑ | ↑ | ↑ | ↑ | ↑ | ↑ | [128] |
| اللدونة السلوكية | |||||||
| زيادة الجرعة | نعم | نعم | نعم | [128] | |||
| الوعي-المتبادل للمنبه النفسي |
نعم | غير قابل للتطبيق | نعم | نعم | ضعيفة | ضعيفة | [128] |
| المنبه النفسي الإدارة الذاتية |
↑ | ↑ | ↓ | ↓ | ↓ | [128] | |
| المنبه النفسي التفضيل المكاني المشروط |
↑ | ↑ | ↓ | ↑ | ↓ | ↑ | [128] |
| إعادة سلوك البحث عن المخدرات | ↑ | ↑ | ↓ | ↓ | [128] | ||
| اللدونة الكيميائية-العصبية | |||||||
| فسفرة CREB في النوية المتكئة |
↓ | ↓ | ↓ | ↓ | ↓ | [128] | |
| استجابة الدوپامين في النوية المتكئة |
لا | نعم | لا | نعم | [128] | ||
| تاشير الدوپامين في الجسم المخطط | ↓DRD2, ↑DRD3 | ↑DRD1, ↓DRD2, ↑DRD3 | ↑DRD1, ↓DRD2, ↑DRD3 | ↑DRD2 | ↑DRD2 | [128] | |
| التأشير الشبه أفيوني الداخلي المتغير | لا يوجد تغير أو ↑μ-مستقبلات أفيونية |
↑μ ↑κ-مستقبلات أفيونية |
↑μ-مستقبلات أفيونية | ↑μ-مستقبلات أفيونية | لا يوجد تغير | لا يوجد تغير | [128] |
| تغيرات في الپپتيدات الشبه أفيونية في الجسم المخطط | ↑دينورفين لا يوجد تغير: إنكفالين |
↑دينورفين | ↓إنكفالين | ↑دينورفين | ↑دينورفين | [128] | |
| اللدونة التشابكية للمسار الوسطي الطرفي | |||||||
| عددالزوائد الشجرية في النوية المتكئة | ↓ | ↑ | ↑ | [128] | |||
| كثافة الشوكة التغصنية في النوية المتكئة |
↓ | ↑ | ↑ | [128] | |||
الاعتياد والانسحاب
يتطور تحمل الدواء بسرعة في حالة تعاطي الأمفيتامين (أي استخدام الأمفيتامين الترفيهي)، لذا فإن فترات التعاطي الممتدة تتطلب جرعات أكبر من الدواء بشكل متزايد من أجل تحقيق نفس التأثير.[151][152] وفقًا لمراجعة كوكرين حول الانسحاب لدى الأفراد الذين يستخدمون الأمفيتامين والميثامفيتامين بشكل قهري، "عندما يتوقف المتعاطون المزمنون فجأة عن استخدام الأمفيتامين، يبلغ العديد منهم عن متلازمة انسحاب محدودة الوقت تحدث في غضون 24 ساعة من آخر جرعة لهم".[153] وأشارت هذه المراجعة إلى أن الأعراض الانسحابية لدى المستخدمين المزمنين بجرعات عالية متكررة، وتحدث في حوالي 88% من الحالات، وتستمر لمدة 3-4 أسابيع مع حدوث مرحلة "انهيار" ملحوظة خلال الأسبوع الأول.[153] يمكن أن تشمل الأعراض الانسحابية للأمفيتامين القلق، والرغبة الشديدة في المخدرات، والمزاج المكتئب، والإرهاق، وزيادة الشهية، وزيادة الحركة أو انخفاض الحركة، ونقص الدافع، والأرق أو النعاس، والأحلام الواعية.[153] وأشارت المراجعة إلى أن شدة الأعراض الانسحابية ترتبط بشكل إيجابي بعمر الفرد ومدى اعتياده.[153] يمكن تجنب الأعراض الانسحابية الخفيفة الناتجة عن التوقف عن علاج الأمفيتامين بجرعات علاجية عن طريق تقليل الجرعة.[1]
الجرعة الزائدة
يمكن أن تؤدي الجرعة الزائدة من الأمفيتامين إلى العديد من الأعراض المختلفة، لكنها نادرًا ما تكون قاتلة مع الرعاية المناسبة.[1][101][154] تزداد شدة أعراض الجرعة الزائدة مع زيادة الجرعة وتنخفض مع التحمل الدوائي للأمفيتامين.[39][101] من المعروف أن الأفراد الذي يتمتعون بتحمل دوائي مرتفع يتناولون ما يصل إلى 5 جرامات من الأمفيتامين يومياً، وهو ما يعادل 100 ضعف الجرعة العلاجية اليومية القصوى تقريبًا.[101] يظهر الجدول أدناه أعراض الجرعة الزائدة المتوسطة والمفرطة من الأمفيتامين؛ وعادةً ما ينطوي التسمم المميت بالأمفيتامين أيضًا على تشنجات وغيبوبة.[28][39] عام 2013، أدت الجرعة الزائدة من الأمفيتامين والميثامفيتامين والمركبات الأخرى المسببة "لاضطراب تعاطي الأمفيتامين" إلى ما يقدر بنحو 3788 حالة وفاة في جميع أنحاء العالم (3425-4145 حالة وفاة، ثقة 95%).[note 15][155]
| الجهاز | الجرعات الزائدة الصغرى أو المتوسطة [28][39][101] | الجرعات الزائدة المفرطة [sources 12] |
|---|---|---|
| الدوري |
| |
| الجهاز العصبي المركزي |
|
|
| العضلي الهيكلي |
| |
| التنفسي |
|
|
| البولي |
|
|
| أخرى |
|
السمية
في القوارض والقردة، تسبب الجرعات العالية من الأمفيتامين في التسمم العصبي الدوپاميني، أو تلف العصبونات الدوپامينية، والتي تتميز بتدهور الطرف المحوري الدوپاميني وانخفاض وظيفة الناقل والمستقبل.[157][158] لا يوجد دليل على أن الأمفيتامين سام للأعصاب بشكل مباشر لدى البشر.[159][160] ومع ذلك، فإن الجرعات الكبيرة من الأمفيتامين قد تسبب بشكل غير مباشر تسمم عصبي دوپاميني نتيجة لفرط الحرارة، والتكوين المفرط لمركبات الأكسجين التفاعلية، وزيادة الأكسدة الذاتية للدوپامين.[sources 13] تشير النماذج الحيوانية للسمية العصبية الناجمة عن التعرض لجرعات عالية من الأمفيتامين إلى أن حدوث فرط الحرارة (أي درجة حرارة الجسم الأساسية ≥ 40 درجة مئوية) ضروري لتطور السمية العصبية الناجمة عن الأمفيتامين.[158] من المرجح أن تؤدي ارتفاعات درجة حرارة المخ فوق 40 درجة مئوية لفترات طويلة إلى تعزيز تطور السمية العصبية الناجمة عن الأمفيتامين في الحيوانات المعملية من خلال تسهيل إنتاج أنواع الأكسجين التفاعلية، وتعطيل وظيفة الپروتين الخلوي، وزيادة نفاذية الحاجز الدموي الدماغي بشكل مؤقت.[158]
الذهان
يمكن أن تؤدي جرعة زائدة من الأمفيتامين إلى الذهان المنبه الذي قد يتضمن مجموعة متنوعة من الأعراض، مثل الوهام وجنون الريبة.[40][41] تشير مراجعة كوكرين حول علاج الذهان الناتج عن الأمفيتامين والدكستروأمفيتامين والميثامفيتامين إلى أن حوالي 5-15% من المستخدمين يفشلون في التعافي تمامًا.[40][163] وفقًا لنفس المراجعة، هناك تجربة واحدة على الأقل تُظهر أن مضادات للذهان تعمل بشكل فعال على حل أعراض الذهان الأمفيتاميني الحاد. نادرًا ما ينشأ الذهان من الاستخدام العلاجي.[40] نادرًا ما ينشأ الذهان من الاستخدام العلاجي.[28][41][42]
التداخلات الدوائية
من المعروف أن العديد من الأنواع التي تتداخل مع الأمفيتامين، مما يؤدي إلى تغيير في عمل الدواء أو استقلاب الأمفيتامين، أو المادة المتفاعلة، أو كليهما.[28] مثبطات الإنزيمات التي تستقلب الأمفيتامين (على سبيل المثال، CYP2D6 وFMO3) سوف تطيل نصف عمر التخلص من الدواء، مما يعني أن تأثيراته سوف تستمر لفترة أطول.[6][28] يتفاعل الأمفيتامين أيضًا مع مثبطات الأكسيداز أحادي الأمين، وخاصة مثبطات الأكسيداز أحادي الأمين أ، حيث تعمل كل من مثبطات الأكسيداز أحادي الأمين والأمفيتامين على زيادة مستويات الكاتيكولامينات في الپلازما (أي النورإپينفرين والدوپامين)؛[28] من ثم، فإن الاستخدام المتزامن لكليهما يعد خطيراً.[28]
يعمل الأمفيتامين على تعديل نشاط أغلب الأدوية المؤثرة نفسياً. وعلى وجه الخصوص، قد يعمل الأمفيتامين على تقليل تأثيرات المهدئات والعقاقير المسببة للاكتئاب ويزيد من تأثيرات المنشطات ومضادات الاكتئاب.[28] قد يقلل الأمفيتامين أيضًا من تأثيرات الأدوية الخافضة لضغط الدم ومضادات الذهان بسبب تأثيره على ضغط الدم والدوپامين على التوالي.[28] قد تؤدي مكملات الزنك إلى تقليل الحد الأدنى للجرعة الفعالة من الأمفيتامين عند استخدامه لعلاج فرط الحركة ونقص الانتباه.[note 16][168]
بشكل عام، لا يوجد تفاعل كبير عند تناول الأمفيتامين مع الطعام، لكن الأس الهيدروجيني لمحتويات الجهاز الهضمي والبول تؤثر على امتصاص الأمفيتامين وإخراجه على التوالي.[28] تقلل المواد الحمضية من امتصاص الأمفيتامين وتزيد من إخراجه في البول، والمواد القلوية تفعل العكس.[28] بسبب تأثير الأس الهيدروجيني على الامتصاص، يتفاعل الأمفيتامين أيضًا مع مخفضات حموضة المعدة مثل مثبطات مضخة الپروتون و[[|مضادات الهيستامين H2، مما يزيد من درجة حموضة الجهاز الهضمي (أي يجعله أقل حمضية).[28]
علم الأدوية
الديناميكية الدوائية
الديناميكية الدوائية للأمفيتامين في العصبو الدوپاميني
|
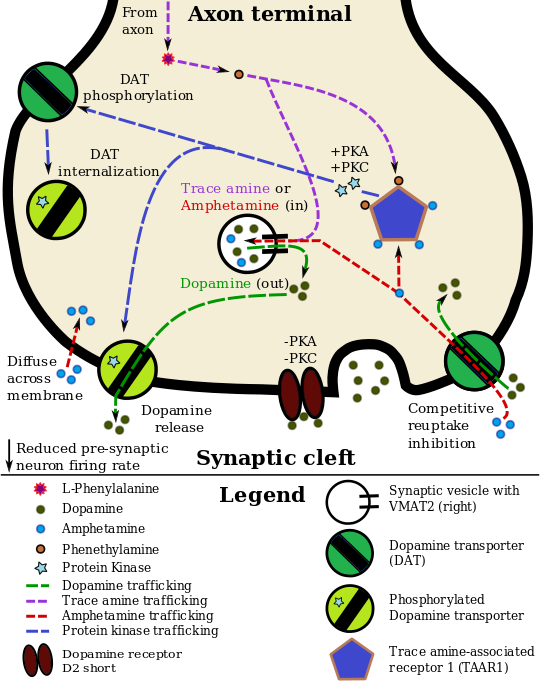
يمارس الأمفيتامين تأثيراته السلوكية عن طريق تغيير استخدام الأحاديات الأمينية كإشارات عصبية في المخ، وخاصة في العصبونات الكاتيكولامينية في مسارات المكافأة والوظيفة التنفيذية في المخ.[37][58] تزداد تركيزات الناقلات العصبية الرئيسية المشاركة في دائرة المكافأة والأداء التنفيذي، الدوپامين والنورأدرينالين، بشكل كبير بطريقة تعتمد على الجرعة بواسطة الأمفيتامين بسبب تأثيراته على الناقلات أحادية الأمين.[37][58][169] إن تأثيرات الأمفيتامين المعززة بالتدعيم والتمييز التحفيزي ترجع في الغالب إلى زيادة نشاط الدوپامين في المسار الوسطي الطرفي.[26] إن تأثيرات الأمفيتامين المبهجة والمحفزة للحركة تعتمد على حجم وسرعة زيادة تركيزات الدوپامين والنورأدرينالين الشبكية في الجسم المخطط.[2]
تم تحديد الأمفيتامين باعتباره ناهضة كاملة قوية للمستقبل المرتبط بالأمين النزر 1 (TAAR1)، a Gs-coupled وGq-coupled المستقبل المقترن بالپروتين ج (GPCR) أُكتشفت عام 2001، الذي يلعب دوراً هاماً في تنظيم أحاديات الأمين في المخ.[37][175] إن تنشيط مستقبل TAAR1 يزيد من إنتاج cAMP عن طريق تنشيط سيكليز الأدينيل وتثبيط وظيفة ناقل أحادي الأمين.[37][176] تمتلك المستقبلات الذاتية أحادية الأمين (على سبيل المثال، D2 short، والمستقبلات قبل المشبكية ألفا2، والمستقبلات قبل المشبكية 5-HT1A) التأثير المعاكس لـ TAAR1، وتوفر هذه المستقبلات معًا منظومة تنظيمية لأحاديات الأمين.[37][38] من الجدير بالذكر أن الأمفيتامين وأمينات النزرة تمتلك تقاربًا عاليًا للارتباط بـ TAAR1، ولكن ليس للمستقبلات أحادية الأمين الذاتية.[37][38] تشير دراسات التصوير الطبي إلى أن تثبيط إعادة امتصاص أحادي الأمين بواسطة الأمفيتامين وأمينات النزرة يعتمد على الموقع ويعتمد على وجود توطين مشترك لـ TAAR1 في الخلايا العصبية أحادية الأمين المرتبطة.[37]
بالإضافة إلى ناقلات الپروتينية الغشائية لأحادي الأمين العصبي، يثبط الأمفيتامين أيضًا كلًا من ناقلات أحادي الأمين الحويصلية، VMAT1 وVMAT2، بالإضافة إلى SLC1A1 وSLC22A3 وSLC22A5.[sources 14] SLC1A1 هو ناقل الأحماض الأمينية المثيرة 3 (EAAT3)، وهو ناقل گلوتاماتي يقع في الخلايا العصبية، وSLC22A3 هو ناقل أحادي الأمين خارج الخلايا العصبية موجود في الخلايا النجمية، وSLC22A5 هو ناقل كارنتين عالي الألفة.[sources 14]
من المعروف أن الأمفيتامين يحفز بقوة التعبير الجيني للنسخة المنظمة للكوكايين والأمفيتامين (CART)،[10][182] پپتيد عصبي يشارك في سلوك التغذية والإجهاد والمكافأة، والذي يحفز زيادات ملحوظة في نمو الخلايا العصبية وبقائها في المختبر.[10][183][184] لم يتم تحديد مستقبل CART حتى الآن، لكن هناك أدلة هامة على أن CART يرتبط بـ Gi/Go-coupled GPCR.[184][185] كما يثبط الأمفيتامين أيضًا الأوكسيديز أحادي الأمين عند تناوله بجرعات عالية جدًا، مما يؤدي إلى تقليل استقلاب أحادي الأمين والأمينات الضئيلة وبالتالي زيادة تركيزات أحاديات الأمين المشبكية.[22][186] في البشر، المستقبل الوحيد بعد المشبكي الذي يُعرف ارتباط الأمفيتامين به هو مستقبل 5-HT1A، حيث يعمل كمنشط ذو ألفة ميكرومولية منخفضة.[187][188]
يتم الحصول على الملف الكامل للتأثيرات قصيرة المدى للمخدرات الأمفيتامينية لدى البشر في الغالب من خلال زيادة الاتصال الخلوي أو النقل العصبي للدوپامين،[37] السروتونين،[37] النورإپينفرين،[37] الإپينفرين،[169] الهيستامين،[169] الپپتيدات المنظمة للكوكايين والأمفيتامين،[10][182] الأفيونيات الداخلية،[189][190][191] الهرمون الموجه لقشر الكظرية،[192][193] الستيرويدات القشرية،[192][193] والگلوتامات،[173][178] والتي تؤثر عليها من خلال التفاعلات مع CART، 5-HT1A، EAAT3, TAAR1، VMAT1، VMAT2، وربما مستهدفات حيوية أخرى.[sources 15] كما يقوم الأمفيتامين بتنشيط إنزيمات الأنهيدراز الكربوني البشرية السبعة، ويتم التعبير عن العديد منها في المخ البشري.[194]
الدكستروأمفيتامين هي ناهضة أقوى لمستقبلات الأمين النزر المرتبطة بالمستقبل المرتبط بأمين النزر ذ عن اللـِڤوأمفيتامين.[195] نتيجة لذلك، ينتج الدكستروأمفيتامين تحفيزًا أكبر للجهاز العصبي المركزي من اللـِڤوأمفيتامين، أي ما يقرب من ثلاثة إلى أربعة أضعاف، لكن اللـِڤوأمفيتامين له تأثيرات قلبية وعائية ومحيطية أقوى قليلاً.[39][195]
الدوپامين
في مناطق معينة من المخ، يزيد الأمفيتامين من تركيز الدوپامين في الشق المشبكي.[37] يمكن أن يدخل الأمفيتامين إلى العصبون قبل المشبكي إما من خلال DAT أو عن طريق الانتشار عبر الغشاء العصبي مباشرة.[37] كنتيجة لامتصاص DAT، ينتج الأمفيتامين تثبيطًا تنافسيًا لإعادة الامتصاص في الناقل.[37] عند دخوله العصبون قبل المشبكي، يقوم الأمفيتامين بتنشيط TAAR1، والذي من خلال إشارات پروتين كيناز أ (PKA) وپروتين كيناز سي (PKC)، يتسبب في فسفرة DAT.[37] يمكن أن تؤدي الفسفرة بواسطة أي من پروتينات الكيناز إلى الاستيعاب الداخلي DAT (تثبيط إعادة امتصاص غير تنافسي)، لكن الفسفرة التي تتم بوساطة PKC وحده تحفز نقل الدوپامين عكسياً من خلال DAT (أي، تدفق الدوپامين).[note 16][37][196] من المعروف أيضًا أن الأمفيتامين يزيد من الكالسيوم داخل الخلايا، وهو التأثير المرتبط بفسفرة DAT من خلال مسار غير محدد يعتمد على Ca2+/calmodulin-dependent protein kinase (CAMK)، والذي بدوره ينتج تدفق الدوپامين.[175][173][174] من خلال التنشيط المباشر لقنوات الپوتاسيوم الموجهة داخلياً والمقترنة بالپروتين ج، يقلل TAAR1 من معدل إطلاق العصبونات الدوپامينية، مما يمنع حالة فرط الدوپامين.[171][172][197]
الأمفيتامين هو أيضًا ركيزة لناقل أحادي الأمين الحويصلي قبل المشبكي، VMAT2.[169][170] بعد امتصاص الأمفيتامين في VMAT2، يحفز الأمفيتامين انهيار تدرج الأس الهيدروجيني الحويصلي، مما يؤدي إلى إطلاق جزيئات الدوپامين من الحويصلات المشبكية إلى السيتوزول من خلال تدفق الدوپامين عبر VMAT2.[169][170] بعد ذلك، تُطلق جزيئات الدوپامين السيتوپلازمية من العصبون قبل المشبكي إلى الشق المشبكي عبر النقل العكسي في DAT.[37][169][170]
النورإپينفرين
على غرار الدوپامين، يزيد الأمفيتامين اعتماداً على الجرعة من مستوى النورإپينفرين المشبكي، وهو السلف المباشر للإپينفرين.[46][58] معتمداً على تعبير TAAR1 mRNA يُعتقد أن الأمفيتامين يؤثر على النورإپينفرين بشكل مشابه للدوپامين.[37][169][196] بعبارة أخرى، يحفز الأمفيتامين التدفق بوساطة TAAR1 وتثبيط إعادة الامتصاص الغير تنافسي عند NET، ويثبط إعادة امتصاص NET التنافسي، وإطلاق النورإپينفرين من VMAT2.[37][169]
السروتونين
يتمتع الأمفيتامين بتأثيرات مماثلة، وإن كانت أقل وضوحًا، على السروتونين كما هو الحال على الدوپامين والنورأدرينالين.[37][58] يؤثر الأمفيتامين على السروتونين عن طريق VMAT2 ويُعتقد أنه، مثل نورإپينفرين، يعمل على فسفرة SERT عن طريق TAAR1.[37][169] مثل الدوپامين ، فإن للأمفيتامين تقارب ميكرومولي منخفض عند مستقبلات 5-HT1A البشرية.[187][188]
ناقلات عصبية، پپتيدات، هرمونات، وإنزيمات أخرى
| الانزيم | KA (ن.م.) | المصادر |
|---|---|---|
| hCA4 | 94 | [194] |
| hCA5A | 810 | [194][198] |
| hCA5B | 2560 | [194] |
| hCA7 | 910 | [194][198] |
| hCA12 | 640 | [194] |
| hCA13 | 24100 | [194] |
| hCA14 | 9150 | [194] |
يؤدي التناول المفرط للأمفيتامين عند البشر إلى زيادة إطلاق الأفيونيات داخلية المنشأ في العديد من هياكل المخ ضمن نظام المكافأة.[189][190][191] لقد ثبت أن المستويات خارج الخلية من الگلوتامات، وهي الناقلات العصبية المثيرة الأساسية في المخ، تزداد في المخطط بعد التعرض للأمفيتامين.[173] من المفترض أن هذه الزيادة في الگلوتامات خارج الخلية تحدث من خلال الاستيعاب الناجم عن الأمفيتامين للپروتين EAAT3، وهو ناقل لإعادة امتصاص الگلوتامات، في العصبونات الدوپامينية.[173][178] يحفز الأمفيتامين أيضًا الإطلاق الانتقائي للهيستامين من الخلايا الصارية والتدفق من العصبونات الهيستامينية عبر VMAT2.[169] يمكن أن يؤدي التناول المفرط للأمفيتامين أيضًا إلى زيادة مستويات الهرمون الموجه لقشر الكظرية والستيرويدات القشرية في پلازما الدم عن طريق تحفيز محور تحت المهاد-الغدة النخامية-الغدة الكظرية.[35][192][193]
في ديسمبر 2017، نُشرت أول دراسة لتقييم التفاعل بين الأمفيتامين وإنزيمات الأنهيدراز الكربوني البشرية؛[194] من بين إنزيمات الأنهيدراز الكربوني الإحدى عشر التي جرى فحصها، وُجد أن الأمفيتامين ينشط سبعة منها بقوة، أربعة منها يتم التعبير عنها بشكل كبير في المخ البشري، مع تأثيرات تنشيط من النانومول المنخفض إلى الميكرومول.[194] استنادًا إلى الأبحاث السريرية المسبقة، فإن تنشيط إنزيم الأنهيدراز الكربوني في المخ له تأثيرات معززة للإدراك؛[199] لكن بناءً على الاستخدام السريري لمثبطات إنزيم الأنهيدراز الكربوني، فإن تنشيط إنزيم الأنهيدراز الكربوني في أنسجة أخرى قد يكون مرتبطًا بتأثيرات ضارة، مثل التنشيط العيني الذي يؤدي إلى تفاقم الزرق.[199]
الحرائك الدوائية
The oral bioavailability of amphetamine varies with gastrointestinal pH;[28] it is well absorbed from the gut, and bioavailability is typically 90%.[9] Amphetamine is a weak base with a pKa of 9.9;[3] consequently, when the pH is basic, more of the drug is in its lipid soluble free base form, and more is absorbed through the lipid-rich cell membranes of the gut epithelium.[3][28] Conversely, an acidic pH means the drug is predominantly in a water-soluble cationic (salt) form, and less is absorbed.[3] Approximately 20% of amphetamine circulating in the bloodstream is bound to plasma proteins.[10] Following absorption, amphetamine readily distributes into most tissues in the body, with high concentrations occurring in cerebrospinal fluid and brain tissue.[16]
The half-lives of amphetamine enantiomers differ and vary with urine pH.[3] At normal urine pH, the half-lives of dextroamphetamine and levoamphetamine are 9–11 hours and 11–14 hours, respectively.[3] Highly acidic urine will reduce the enantiomer half-lives to 7 hours;[16] highly alkaline urine will increase the half-lives up to 34 hours.[16] The immediate-release and extended release variants of salts of both isomers reach peak plasma concentrations at 3 hours and 7 hours post-dose respectively.[3] Amphetamine is eliminated via the kidneys, with 30–40% of the drug being excreted unchanged at normal urinary pH.[3] When the urinary pH is basic, amphetamine is in its free base form, so less is excreted.[3] When urine pH is abnormal, the urinary recovery of amphetamine may range from a low of 1% to a high of 75%, depending mostly upon whether urine is too basic or acidic, respectively.[3] Following oral administration, amphetamine appears in urine within 3 hours.[16] Roughly 90% of ingested amphetamine is eliminated 3 days after the last oral dose.[16]
Lisdexamfetamine is a prodrug of dextroamphetamine.[200][201] It is not as sensitive to pH as amphetamine when being absorbed in the gastrointestinal tract.[201] Following absorption into the blood stream, lisdexamfetamine is completely converted by red blood cells to dextroamphetamine and the amino acid L-lysine by hydrolysis via undetermined aminopeptidase enzymes.[201][200][202] This is the rate-limiting step in the bioactivation of lisdexamfetamine.[200] The elimination half-life of lisdexamfetamine is generally less than 1 hour.[201][200] Due to the necessary conversion of lisdexamfetamine into dextroamphetamine, levels of dextroamphetamine with lisdexamfetamine peak about one hour later than with an equivalent dose of immediate-release dextroamphetamine.[200][202] Presumably due to its rate-limited activation by red blood cells, intravenous administration of lisdexamfetamine shows greatly delayed time to peak and reduced peak levels compared to intravenous administration of an equivalent dose of dextroamphetamine.[200] The pharmacokinetics of lisdexamfetamine are similar regardless of whether it is administered orally, intranasally, or intravenously.[200][202] Hence, in contrast to dextroamphetamine, parenteral use does not enhance the subjective effects of lisdexamfetamine.[200][202] Because of its behavior as a prodrug and its pharmacokinetic differences, lisdexamfetamine has a longer duration of therapeutic effect than immediate-release dextroamphetamine and shows reduced misuse potential.[200][202]
CYP2D6, dopamine β-hydroxylase (DBH), flavin-containing monooxygenase 3 (FMO3), butyrate-CoA ligase (XM-ligase), and glycine N-acyltransferase (GLYAT) are the enzymes known to metabolize amphetamine or its metabolites in humans.[sources 16] Amphetamine has a variety of excreted metabolic products, including 4-hydroxyamphetamine, 4-hydroxynorephedrine, 4-hydroxyphenylacetone, benzoic acid, hippuric acid, norephedrine, and phenylacetone.[3][11] Among these metabolites, the active sympathomimetics are 4-hydroxyamphetamine,[203] 4-hydroxynorephedrine,[204] and norephedrine.[205] The main metabolic pathways involve aromatic para-hydroxylation, aliphatic alpha- and beta-hydroxylation, N-oxidation, N-dealkylation, and deamination.[3][206] The known metabolic pathways, detectable metabolites, and metabolizing enzymes in humans include the following: قالب:Amphetamine pharmacokinetics
الميكروبيومات الدوائية
The human metagenome (i.e., the genetic composition of an individual and all microorganisms that reside on or within the individual's body) varies considerably between individuals.[207][208] Since the total number of microbial and viral cells in the human body (over 100 trillion) greatly outnumbers human cells (tens of trillions),[note 17][207][209] there is considerable potential for interactions between drugs and an individual's microbiome, including: drugs altering the composition of the human microbiome, drug metabolism by microbial enzymes modifying the drug's pharmacokinetic profile, and microbial drug metabolism affecting a drug's clinical efficacy and toxicity profile.[207][208][210] The field that studies these interactions is known as pharmacomicrobiomics.[207]
Similar to most biomolecules and other orally administered xenobiotics (i.e., drugs), amphetamine is predicted to undergo promiscuous metabolism by human gastrointestinal microbiota (primarily bacteria) prior to absorption into the blood stream.[210] The first amphetamine-metabolizing microbial enzyme, tyramine oxidase from a strain of E. coli commonly found in the human gut, was identified in 2019.[210] This enzyme was found to metabolize amphetamine, tyramine, and phenethylamine with roughly the same binding affinity for all three compounds.[210]
المركبات الداخلية ذات الصلة
Amphetamine has a very similar structure and function to the endogenous trace amines, which are naturally occurring neuromodulator molecules produced in the human body and brain.[37][46][211] Among this group, the most closely related compounds are phenethylamine, the parent compound of amphetamine, and N-methylphenethylamine, a structural isomer of amphetamine (i.e., it has an identical molecular formula).[37][46][212] In humans, phenethylamine is produced directly from L-phenylalanine by the aromatic amino acid decarboxylase (AADC) enzyme, which converts L-DOPA into dopamine as well.[46][212] In turn, N-methylphenethylamine is metabolized from phenethylamine by phenylethanolamine N-methyltransferase, the same enzyme that metabolizes norepinephrine into epinephrine.[46][212] Like amphetamine, both phenethylamine and N-methylphenethylamine regulate monoamine neurotransmission via TAAR1;[37][211][212] unlike amphetamine, both of these substances are broken down by monoamine oxidase B, and therefore have a shorter half-life than amphetamine.[46][212]
الكيمياء
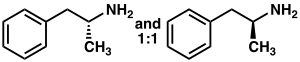
Racemic amphetamine
|
Phenyl-2-nitropropene (right cups)
Amphetamine is a methyl homolog of the mammalian neurotransmitter phenethylamine with the chemical formula C
9H
13N. The carbon atom adjacent to the primary amine is a stereogenic center, and amphetamine is composed of a racemic 1:1 mixture of two enantiomers.[10] This racemic mixture can be separated into its optical isomers:[note 18] levoamphetamine and dextroamphetamine.[10] At room temperature, the pure free base of amphetamine is a mobile, colorless, and volatile liquid with a characteristically strong amine odor, and acrid, burning taste.[21] Frequently prepared solid salts of amphetamine include amphetamine adipate,[213] aspartate,[28] hydrochloride,[214] phosphate,[215] saccharate,[28] sulfate,[28] and tannate.[216] Dextroamphetamine sulfate is the most common enantiopure salt.[47] Amphetamine is also the parent compound of its own structural class, which includes a number of psychoactive derivatives.[4][10] In organic chemistry, amphetamine is an excellent chiral ligand for the stereoselective synthesis of 1,1'-bi-2-naphthol.[217]
المشتقات البديلة
المشتقات البديلة للأمفيتامين، أو "الأمفيتامينات البديلة"، هي مجموعة واسعة من المواد الكيميائية التي تحتوي على الأمفيتامين باعتباره "مادة أساسية"[4][48][218] خاصة، تلك الفئات الكيميائية التي تتضمن مركبات مشتق يتكون عن طريق استبدال ذرة هيدروجين واحدة أو أكثر في بنية نواة الأمفيتامين بالمستبدلات.[4][48][219] تتضمن الفئة الأمفيتامين نفسه، والمنشطات مثل المثامفيتامين، وEmpathogens السروتونينية مثل المثيلينديوكسي-مثامفيتامين، ومزيلات الاحتقان مثل الإفدرين، من بين مجموعات فرعية أخرى.[4][48][218]
التخليق
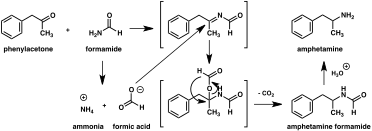
Since the first preparation was reported in 1887,[220] numerous synthetic routes to amphetamine have been developed.[221][222] The most common route of both legal and illicit amphetamine synthesis employs a non-metal reduction known as the Leuckart reaction (method 1).[47][223] In the first step, a reaction between phenylacetone and formamide, either using additional formic acid or formamide itself as a reducing agent, yields N-formylamphetamine. This intermediate is then hydrolyzed using hydrochloric acid, and subsequently basified, extracted with organic solvent, concentrated, and distilled to yield the free base. The free base is then dissolved in an organic solvent, sulfuric acid added, and amphetamine precipitates out as the sulfate salt.[223][224]
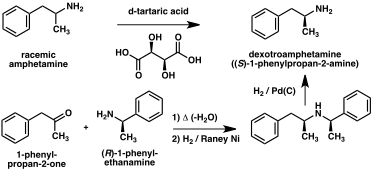
A number of chiral resolutions have been developed to separate the two enantiomers of amphetamine.[221] For example, racemic amphetamine can be treated with d-tartaric acid to form a diastereoisomeric salt which is fractionally crystallized to yield dextroamphetamine.[225] Chiral resolution remains the most economical method for obtaining optically pure amphetamine on a large scale.[226] In addition, several enantioselective syntheses of amphetamine have been developed. In one example, optically pure (R)-1-phenyl-ethanamine is condensed with phenylacetone to yield a chiral Schiff base. In the key step, this intermediate is reduced by catalytic hydrogenation with a transfer of chirality to the carbon atom alpha to the amino group. Cleavage of the benzylic amine bond by hydrogenation yields optically pure dextroamphetamine.[226]
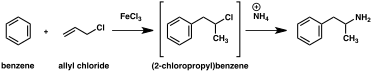
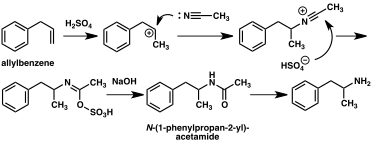
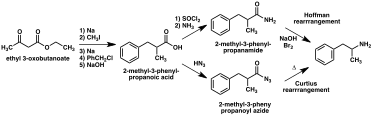
A large number of alternative synthetic routes to amphetamine have been developed based on classic organic reactions.[221][222] One example is the Friedel–Crafts alkylation of benzene by allyl chloride to yield beta chloropropylbenzene which is then reacted with ammonia to produce racemic amphetamine (method 2).[227] Another example employs the Ritter reaction (method 3). In this route, allylbenzene is reacted acetonitrile in sulfuric acid to yield an organosulfate which in turn is treated with sodium hydroxide to give amphetamine via an acetamide intermediate.[228][229] A third route starts with ethyl 3-oxobutanoate which through a double alkylation with methyl iodide followed by benzyl chloride can be converted into 2-methyl-3-phenyl-propanoic acid. This synthetic intermediate can be transformed into amphetamine using either a Hofmann or Curtius rearrangement (method 4).[230]
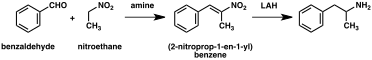
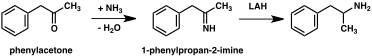
A significant number of amphetamine syntheses feature a reduction of a nitro, imine, oxime, or other nitrogen-containing functional groups.[222] In one such example, a Knoevenagel condensation of benzaldehyde with nitroethane yields phenyl-2-nitropropene. The double bond and nitro group of this intermediate is reduced using either catalytic hydrogenation or by treatment with lithium aluminium hydride (method 5).[223][231] Another method is the reaction of phenylacetone with ammonia, producing an imine intermediate that is reduced to the primary amine using hydrogen over a palladium catalyst or lithium aluminum hydride (method 6).[223]
|
|
|
Detection in body fluids
Amphetamine is frequently measured in urine or blood as part of a drug test for sports, employment, poisoning diagnostics, and forensics.[sources 17] Techniques such as immunoassay, which is the most common form of amphetamine test, may cross-react with a number of sympathomimetic drugs.[235] Chromatographic methods specific for amphetamine are employed to prevent false positive results.[236] Chiral separation techniques may be employed to help distinguish the source of the drug, whether prescription amphetamine, prescription amphetamine prodrugs, (e.g., selegiline), over-the-counter drug products that contain levomethamphetamine,[note 19] or illicitly obtained substituted amphetamines.[236][239][240] Several prescription drugs produce amphetamine as a metabolite, including benzphetamine, clobenzorex, famprofazone, fenproporex, lisdexamfetamine, mesocarb, methamphetamine, prenylamine, and selegiline, among others.[2][241][242] These compounds may produce positive results for amphetamine on drug tests.[241][242] Amphetamine is generally only detectable by a standard drug test for approximately 24 hours, although a high dose may be detectable for 2–4 days.[235]
For the assays, a study noted that an enzyme multiplied immunoassay technique (EMIT) assay for amphetamine and methamphetamine may produce more false positives than liquid chromatography–tandem mass spectrometry.[239] Gas chromatography–mass spectrometry (GC–MS) of amphetamine and methamphetamine with the derivatizing agent (S)-(−)-trifluoroacetylprolyl chloride allows for the detection of methamphetamine in urine.[236] GC–MS of amphetamine and methamphetamine with the chiral derivatizing agent Mosher's acid chloride allows for the detection of both dextroamphetamine and dextromethamphetamine in urine.[236] Hence, the latter method may be used on samples that test positive using other methods to help distinguish between the various sources of the drug.[236]
التاريخ، المجتمع، والثقافة
| المادة | أفضل تقدير |
أقل تقدير |
أعلى تقدير |
|---|---|---|---|
| منبهات- الأمفيتامين |
34.16 | 13.42 | 55.24 |
| القنب | 192.15 | 165.76 | 234.06 |
| الكوكايين | 18.20 | 13.87 | 22.85 |
| الأستروكس | 20.57 | 8.99 | 32.34 |
| الأفيونيات | 19.38 | 13.80 | 26.15 |
| الأفيونانيات | 34.26 | 27.01 | 44.54 |
تم تحضير الأمفيتامين لأول مرة عام 1887 في ألمانيا من قبل الكيميائي الروماني لازار إدليانو الذي أطلق عليه اسم فينيلأيزوپروپيلأمين؛[220][244][245] وظلت تأثيراته المنشطة غير معروفة حتى عام 1927، عندما أعاد گوردون أليس تحضيره بشكل مستقل وأفادت التقارير أنه يتمتع بخصائص محاكيات الودي.[245] لم يكن للأمفيتامين أي استخدام طبي حتى أواخر عام 1933، عندما بدأت سميث وكلاين وفرنش في بيعه كمُستنشق مزيل للاحتقان تحت الاسم التجاري البنزدرين.[29] طُرحت كبريتات البنزيدرين بعد 3 سنوات وكانت تستخدم لعلاج مجموعة واسعة من الحالات الطبية، بما في ذلك الخدار، [البدانة]]، انخفاض ضغط الدم، اضطراب الرغبة الجنسية، الألم المزمن، وغيرها.[49][29] أثناء الحرب العالمية الثانية، أُستخدم الأمفيتامين والمثامفتامين على نطاق واسع من قبل كل من قوات الحلفاء والمحور لتأثيراتهما المنشطة والمحسنة للأداء.[220][246][247] مع انتشار الخصائص الإدمانية للدواء، بدأت الحكومات في فرض ضوابط صارمة على بيع الأمفيتامين.[220] على سبيل المثال، خلال أوائل السبعينيات في الولايات المتحدة، أصبح الأمفيتامين مادة خاضعة للرقابة من الجدول الثاني بموجب قانون المواد الخاضعة للرقابة.[248][249] وعلى الرغم من الضوابط الحكومية الصارمة، فقد أُستخدم الأمفيتامين بشكل قانوني أو غير قانوني من قبل أشخاص من خلفيات متنوعة، بما في ذلك المؤلفون،[250] الموسيقيون،[251] الرياضياتيون،[252] والرياضيون.[27]
اليوم، لا يزال الأمفيتامين يُحضر بشكل غير قانوني في مختبرات سرية ويباع في السوق السوداء، وخاصة في البلدان الأوروپية.[253] عام 2018، من بين دول الاتحاد الأوروپي، استخدم 11.9 مليون شخص بالغ تتراوح أعمارهم بين 15 و64 عامًا الأمفيتامين أو المثامفتامين مرة واحدة على الأقل في حياتهم، واستخدم 1.7 مليون منهم أيًا من العقارين في السنة الماضية.[254] خلال عام 2012، ضُبط ما يقرب من 5.9 طن متري من الأمفيتامين الغير مشروع داخل دول الاتحاد الأوروپي؛[255] تراوح "سعر الشارع" للأمفيتامين غير المشروع داخل الاتحاد الأوروپي من 6-38 يورو للجرام خلال نفس الفترة.[255] خارج أوروپا، السوق غير المشروعة للأمفيتامين أصغر بكثير من سوق المثامفيتامين والمثيلينديوكسي-مثامفيتامين.[253]
الوضع القانوني
نتيجة لاتفاقية الأمم المتحدة لعام 1971 بشأن المؤثرات العقلية، أصبح الأمفيتامين مادة خاضعة للرقابة من الجدول الثاني، كما هو محدد في المعاهدة، في جميع الدول الأطراف البالغ عددها 183 دولة.[30] وبالتالي، تخضع للتنظيم الموسع في معظم البلدان.[256][257] بعض البلدان، مثل كوريا الجنوبية واليابان، حظرت استخدام الأمفيتامينات البديلة حتى للاستخدام الطبي.[258][259] وفي بلدان أخرى، مثل كندا (دواء من الجدول الأول)،[260] هولندا (دواء من القائمة الأولى)،[261] الولايات المتحدة (دواء من الجدول الثاني)،[28] أستراليا (الجدول الثامن),[262] تايلند (مخدر من الفئة الأولى)،[263] والمملكة المتحدة (دواء من الدرجة ب),[264] تُدرج الأمفيتامين في جدول المخدرات الوطني المقيد الذي يسمح باستخدامه كعلاج طبي.[253][31]
المستحضرات الصيدلانية
تحتوي العديد من تركيبات الأمفيتامين التي تُسوق حاليًا على كل من المتصاوغات المرآتية، بما في ذلك تلك التي تُسوق تحت الأسماء التجارية أديرال، أديرال إكس آر، ميدايس،[note 1] أدزنيس إير آر، أدزنيس إكس آر-أو دي تي، دياناڤيل إكس آر، إڤكيو، وإڤكيو أو دي تي. من بين هذه المنتجات، يعد إڤكيو (بما في ذلك إڤكيو أو دي تي) المنتج الوحيد الذي يحتوي فقط على الأمفيتامين الراسيمي (كبريتات الأمفيتامين)، وبالتالي فهو المنتج الوحيد الذي يمكن الإشارة إلى جزئه النشط بدقة باسم "الأمفيتامين".[1][35][105] الدكستروأمفيتامين، الذي يُسوق تحت الأسماء التجارية دكسيدرين وزنزيدي، هو المنتج الوحيد من الأمفيتامينات المتجانسة المتوفر حاليًا. كما يتوفر دواء أولي من الدكستروأمفيتامين، وهو الليسديكسامفيتامين، ويُسوق تحت الاسم التجاري ڤيڤانس. ولأنه دواء أولي، فإن الليسديكسامفيتامين يختلف هيكليًا عن الدكستروأمفيتامين، وهو غير نشط حتى يتحول إلى دكستروأمفيتامين.[36][201] كانت القاعدة الحرة للأمفيتامين الراسيمي متوفرة في السابق باسم بنزيدرين، وسايكيدرين، وسيمپاتدرين.[2] كان اللـِڤوامفيتامين متاحًا في السابق باسم سيدريل.[2] العديد من المستحضرات الصيدلانية الأمفيتامينية الحالية عبارة عن أملاح بسبب التقلبات العالية نسبيًا للقاعدة الحرة.[2][36][47] ومع ذلك، فقد طُرح المعلق الفموي وأشكال الجرعات من الأقراص التي تنحل في الفم (ODT) المكونة من القاعدة الحرة، عامي 2015 و2016 على التوالي.[105][265][266]مذكور أدناه بعض العلامات التجارية الحالية ومثيلاتها العامة.
| الاسم التجاري |
اسم معتمد بالولايات المتحدة |
نسبة (D:L) |
شكل الجرعة |
تاريخ بدء التسويق |
المصادر |
|---|---|---|---|---|---|
| أديرال (Adderall) | – | 3:1 (salts) | أقراص | 1996 | [2][36] |
| أديرال إكس آر (Adderall XR) | – | 3:1 (أملاح) | كبسولات | 2001 | [2][36] |
| ميدايس (Mydayis) | – | 3:1 (أملاح) | كبسولات | 2017 | [267][268] |
| أدزينس إي آر (Adzenys ER) | أمفيتامين | 3:1 (قاعدي) | معلق | 2017 | [269] |
| أديزنس إكس آر-أو دي تي (Adzenys XR-ODT) | أمفيتامين | 3:1 (قاعدي) | ق.ي.ف. | 2016 | [266][270] |
| دياناڤيل إكس آر (Dyanavel XR) | أمفيتامين | 3.2:1 (قاعدي) | معلق | 2015 | [105][265] |
| إڤكيو (Evekeo) | كبريتات الأمفيتامين | 1:1 (أملاح) | أقراص | 2012 | [35][271] |
| إڤكيو أو دي تي (Evekeo ODT) | كبريتات الأمفيتامين | 1:1 (أملاح) | ق.ي.ف. | 2019 | [272] |
| الدكسدرين (Dexedrine) | كبريتات الدكستروأمفيتامين | 1:0 (أملاح) | كبسولات | 1976 | [2][36] |
| زنزيدي (Zenzedi) | كبريتات الدكستروأمفيتامين | 1:0 (أملاح ) | أقراص | 2013 | [36][273] |
| ڤيڤانس (Vyvanse) | ديميسيلات الليزديكسامفيتامين | 1:0 (دواء أولي) | كبسولات | 2007 | [2][201][274] |
| أقراص | |||||
| إكسلستريم (Xelstrym) | دكستروأمفيتامين | 1:0 (قاعدي) | لقصة | 2022 | [275] |
| الدواء | التركيبة | الكتلة المولية [note 20] |
قاعدة الأمفيتامين [note 21] |
قاعدة الأمفيتامين في الجرعات المتساوية |
الجرعات بمحتوى قاعدي متساوي [note 22] | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| (جم/مول) | (النسبة المئوية) | (جرعة 30 مجم) | ||||||||
| الإجمالي | القاعدة | الإجمالي | الدكسترو- | اللـِڤو- | الدكسترو- | اللـِڤو- | ||||
| كبريتات الدكستروأمفيتامين[277][278] | (C9H13N)2•H2SO4 | 368.49
|
270.41
|
73.38%
|
73.38%
|
—
|
22.0 مج
|
—
|
30.0 مج
| |
| كبريتات الأمفيتامين[279] | (C9H13N)2•H2SO4 | 368.49
|
270.41
|
73.38%
|
36.69%
|
36.69%
|
11.0 مجم
|
11.0 مجم
|
30.0 مجم
| |
| أديرال | 62.57%
|
47.49%
|
15.08%
|
14.2 مجم
|
4.5 مجم
|
35.2 مجم
| ||||
| 25% | كبريتات الدكستروأمفيتامين[277][278] | (C9H13N)2•H2SO4 | 368.49
|
270.41
|
73.38%
|
73.38%
|
—
|
|||
| 25% | كبريتات الأمفيتامين [279] | (C9H13N)2•H2SO4 | 368.49
|
270.41
|
73.38%
|
36.69%
|
36.69%
|
|||
| 25% | سكريدات الدكستروأمفيتامين[280] | (C9H13N)2•C6H10O8 | 480.55
|
270.41
|
56.27%
|
56.27%
|
—
|
|||
| 25% | مونوهيدرات أسپارتات الأمفيتامين [281] | (C9H13N)•C4H7NO4•H2O | 286.32
|
135.21
|
47.22%
|
23.61%
|
23.61%
|
|||
| ديميسيلات الليزديكسامفيتامين[201] | C15H25N3O•(CH4O3S)2 | 455.49
|
135.21
|
29.68%
|
29.68%
|
—
|
8.9 mg
|
—
|
74.2 mg
| |
| معلق الأمفيتامين القاعدي[105] | C9H13N | 135.21
|
135.21
|
100%
|
76.19%
|
23.81%
|
22.9 مجم
|
7.1 مجم
|
22.0 مجم
| |
الهوامش
- ^ أ ب Adderall and other mixed amphetamine salts products such as Mydayis are not racemic amphetamine – they are a mixture composed of equal parts racemate and dextroamphetamine.
See Mixed amphetamine salts for more information about the mixture, and this section for information about the various mixtures of amphetamine enantiomers currently marketed. - ^ Synonyms and alternate spellings include: 1-phenylpropan-2-amine (IUPAC name), α-methylphenethylamine, amfetamine (International Nonproprietary Name [INN]), β-phenylisopropylamine, thyramine, and speed.[22][10][23]
- ^ Enantiomers are molecules that are mirror images of one another; they are structurally identical, but of the opposite orientation.[25]
Levoamphetamine and dextroamphetamine are also known as L-amph or levamfetamine (INN) and D-amph or dexamfetamine (INN) respectively.[22] - ^ The brand name Adderall is used throughout this article to refer to the amphetamine four-salt mixture it contains (dextroamphetamine sulfate 25%, dextroamphetamine saccharate 25%, amphetamine sulfate 25%, and amphetamine aspartate 25%). The nonproprietary name, which lists all four active constituent chemicals, is excessively lengthy.[36]
- ^ The term "amphetamines" also refers to a chemical class, but, unlike the class of substituted amphetamines,[4] the "amphetamines" class does not have a standardized definition in academic literature.[18] One of the more restrictive definitions of this class includes only the racemate and enantiomers of amphetamine and methamphetamine.[18] The most general definition of the class encompasses a broad range of pharmacologically and structurally related compounds.[18]
Due to confusion that may arise from use of the plural form, this article will only use the terms "amphetamine" and "amphetamines" to refer to racemic amphetamine, levoamphetamine, and dextroamphetamine and reserve the term "substituted amphetamines" for its structural class. - ^ The ADHD-related outcome domains with the greatest proportion of significantly improved outcomes from long-term continuous stimulant therapy include academics (≈55% of academic outcomes improved), driving (100% of driving outcomes improved), non-medical drug use (47% of addiction-related outcomes improved), obesity (≈65% of obesity-related outcomes improved), self-esteem (50% of self-esteem outcomes improved), and social function (67% of social function outcomes improved).[56]
The largest effect sizes for outcome improvements from long-term stimulant therapy occur in the domains involving academics (e.g., grade point average, achievement test scores, length of education, and education level), self-esteem (e.g., self-esteem questionnaire assessments, number of suicide attempts, and suicide rates), and social function (e.g., peer nomination scores, social skills, and quality of peer, family, and romantic relationships).[56]
Long-term combination therapy for ADHD (i.e., treatment with both a stimulant and behavioral therapy) produces even larger effect sizes for outcome improvements and improves a larger proportion of outcomes across each domain compared to long-term stimulant therapy alone.[56] - ^ Cochrane reviews are high quality meta-analytic systematic reviews of randomized controlled trials.[62]
- ^ The statements supported by the USFDA come from prescribing information, which is the copyrighted intellectual property of the manufacturer and approved by the USFDA. USFDA contraindications are not necessarily intended to limit medical practice but limit claims by pharmaceutical companies.[100]
- ^ According to one review, amphetamine can be prescribed to individuals with a history of abuse provided that appropriate medication controls are employed, such as requiring daily pick-ups of the medication from the prescribing physician.[2]
- ^ In individuals who experience sub-normal height and weight gains, a rebound to normal levels is expected to occur if stimulant therapy is briefly interrupted.[43][55][104] The average reduction in final adult height from 3 years of continuous stimulant therapy is 2 cm.[104]
- ^ Transcription factors are proteins that increase or decrease the expression of specific genes.[134]
- ^ In simpler terms, this necessary and sufficient relationship means that ΔFosB overexpression in the nucleus accumbens and addiction-related behavioral and neural adaptations always occur together and never occur alone.
- ^ NMDA receptors are voltage-dependent ligand-gated ion channels that requires simultaneous binding of glutamate and a co-agonist (D-serine or glycine) to open the ion channel.[148]
- ^ The review indicated that magnesium L-aspartate and magnesium chloride produce significant changes in addictive behavior;[125] other forms of magnesium were not mentioned.
- ^ The 95% confidence interval indicates that there is a 95% probability that the true number of deaths lies between 3,425 and 4,145.
- ^ أ ب The human dopamine transporter (hDAT) contains a high-affinity, extracellular, and allosteric Zn2+ (zinc ion) binding site which, upon zinc binding, inhibits dopamine reuptake, inhibits amphetamine-induced hDAT internalization, and amplifies amphetamine-induced dopamine efflux.[164][165][166][167] The human serotonin transporter and norepinephrine transporter do not contain zinc binding sites.[166]
- ^ There is substantial variation in microbiome composition and microbial concentrations by anatomical site.[207][208] Fluid from the human colon – which contains the highest concentration of microbes of any anatomical site – contains approximately one trillion (10^12) bacterial cells/ml.[207]
- ^ Enantiomers are molecules that are mirror images of one another; they are structurally identical, but of the opposite orientation.[25]
- ^ The active ingredient in some OTC inhalers in the United States is listed as levmetamfetamine, the INN and USAN of levomethamphetamine.[237][238]
- ^ من أجل التوحيد، حُسبت الكتل المولية باستخدام حاسبة الوزن الجزيئي[276] وكانت في حدود 0.01 جم/مول من القيم الصيدلانية المنشورة.
- ^ النسبة المئوية لقاعدة الأمفيتامين = الكتلة الموليةالقاعدية / الكتلة الموليةالإجمالية . النسبة المئوية لقاعدة الأمفيتامين في الأديرال = مجموع النسب المئوية للمكونات / 4.
- ^ dose = (1 / النسبة المئوية لقاعدة الأمفيتامين) &المرات؛ عامل القياس = (الكتلة المولية الإجمالية / الكتلة الموليةالقاعدية) &المرات؛ عامل القياس. تم قياس القيم في هذا العمود على أساس جرعة 30 مجم من كبريتات الدكستروأمفيتامين. نظرًا للاختلافات الدوائية بين هذه الأدوية (على سبيل المثال، الاختلافات في الإطلاق، والامتصاص، والتحويل، والتركيز، والتأثيرات المختلفة للنظائر المتماثلة، ونصف العمر، وما إلى ذلك)، لا ينبغي اعتبار القيم المدرجة جرعات متساوية الفعالية.
- مفتاح الصور
- ^ (Text color) Transcription factors
الحواشي
- ^ [2][18][26][27][28][29][30][31][32][33][34][35]
- ^ [2][15][26][29][35][37][38]
- ^ [15][26][27][28][32][39][40][41][42][43][44][45]
- ^ [46][47][48]
- ^ [1][28][39][104][105][106]
- ^ [107][108][109][110]
- ^ [28][101][107][109]
- ^ [32][28][39][111]
- ^ أ ب [128][129][130][131][150]
- ^ [126][128][127][135][136]
- ^ [127][138][139][140]
- ^ [23][28][39][154][156]
- ^ [50][158][161][162]
- ^ أ ب [169][173][177][178][179][180][181]
- ^ [37][169][177][178][182][187]
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةamphetamine metabolism - ^ [27][232][233][234]
المصادر
- ^ أ ب ت ث ج ح خ د ذ ر Stahl SM (March 2017). "Amphetamine (D,L)". Prescriber's Guide: Stahl's Essential Psychopharmacology (6th ed.). Cambridge, United Kingdom: Cambridge University Press. pp. 45–51. ISBN 9781108228749. Retrieved 5 August 2017.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش Heal DJ, Smith SL, Gosden J, Nutt DJ (June 2013). "Amphetamine, past and present – a pharmacological and clinical perspective". Journal of Psychopharmacology. 27 (6): 479–496. doi:10.1177/0269881113482532. PMC 3666194. PMID 23539642.
The intravenous use of d-amphetamine and other stimulants still pose major safety risks to the individuals indulging in this practice. Some of this intravenous abuse is derived from the diversion of ampoules of d-amphetamine, which are still occasionally prescribed in the UK for the control of severe narcolepsy and other disorders of excessive sedation. ... For these reasons, observations of dependence and abuse of prescription d-amphetamine are rare in clinical practice, and this stimulant can even be prescribed to people with a history of drug abuse provided certain controls, such as daily pick-ups of prescriptions, are put in place (Jasinski and Krishnan, 2009b).
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةFDA Pharmacokinetics - ^ أ ب ت ث ج ح خ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةSubstituted amphetamines, FMO, and DBH - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةDBH amph primary - ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةFMO - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةFMO3-Primary - ^ Anvisa (2023-03-31). "RDC Nº 784 - Listas de Substâncias Entorpecentes, Psicotrópicas, Precursoras e Outras sob Controle Especial" [Collegiate Board Resolution No. 784 - Lists of Narcotic, Psychotropic, Precursor, and Other Substances under Special Control] (in البرتغالية البرازيلية). Diário Oficial da União (published 2023-04-04). Archived from the original on 2023-08-03. Retrieved 2023-08-03.
- ^ أ ب Patel VB, Preedy VR, eds. (2022). Handbook of Substance Misuse and Addictions. Cham: Springer International Publishing. p. 2006. doi:10.1007/978-3-030-92392-1. ISBN 978-3-030-92391-4.
Amphetamine is usually consumed via inhalation or orally, either in the form of a racemic mixture (levoamphetamine and dextroamphetamine) or dextroamphetamine alone (Childress et al. 2019). In general, all amphetamines have high bioavailability when consumed orally, and in the specific case of amphetamine, 90% of the consumed dose is absorbed in the gastrointestinal tract, with no significant differences in the rate and extent of absorption between the two enantiomers (Carvalho et al. 2012; Childress et al. 2019). The onset of action occurs approximately 30 to 45 minutes after consumption, depending on the ingested dose and on the degree of purity or on the concomitant consumption of certain foods (European Monitoring Centre for Drugs and Drug Addiction 2021a; Steingard et al. 2019). It is described that those substances that promote acidification of the gastrointestinal tract cause a decrease in amphetamine absorption, while gastrointestinal alkalinization may be related to an increase in the compound's absorption (Markowitz and Patrick 2017).
- ^ أ ب ت ث ج ح خ د ذ قالب:Cite DrugBank
- ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةMetabolites - ^ "Pharmacology". amphetamine/dextroamphetamine. Medscape - WebMD. Retrieved 21 January 2016.
Onset of action: 30–60 min
- ^ أ ب ت Millichap JG (2010). "Chapter 9: Medications for ADHD". In Millichap JG (ed.). Attention Deficit Hyperactivity Disorder Handbook: A Physician's Guide to ADHD (2nd ed.). New York: Springer. p. 112. ISBN 9781441913968.
Table 9.2 Dextroamphetamine formulations of stimulant medication
Dexedrine [Peak:2–3 h] [Duration:5–6 h] ...
Adderall [Peak:2–3 h] [Duration:5–7 h]
Dexedrine spansules [Peak:7–8 h] [Duration:12 h] ...
Adderall XR [Peak:7–8 h] [Duration:12 h]
Vyvanse [Peak:3–4 h] [Duration:12 h] - ^ Brams M, Mao AR, Doyle RL (September 2008). "Onset of efficacy of long-acting psychostimulants in pediatric attention-deficit/hyperactivity disorder". Postgraduate Medicine. 120 (3): 69–88. doi:10.3810/pgm.2008.09.1909. PMID 18824827. S2CID 31791162.
- ^ أ ب ت ث "Adderall- dextroamphetamine saccharate, amphetamine aspartate, dextroamphetamine sulfate, and amphetamine sulfate tablet". DailyMed. Teva Pharmaceuticals USA, Inc. 8 November 2019. Retrieved 22 December 2019.
- ^ أ ب ت ث ج ح "Metabolism/Pharmacokinetics". Amphetamine. Hazardous Substances Data Bank. United States National Library of Medicine – Toxicology Data Network. Archived from the original on 2 October 2017. Retrieved 2 October 2017.
Duration of effect varies depending on agent and urine pH. Excretion is enhanced in more acidic urine. Half-life is 7 to 34 hours and is, in part, dependent on urine pH (half-life is longer with alkaline urine). ... Amphetamines are distributed into most body tissues with high concentrations occurring in the brain and CSF. Amphetamine appears in the urine within about 3 hours following oral administration. ... Three days after a dose of (+ or -)-amphetamine, human subjects had excreted 91% of the (14)C in the urine
- ^ أ ب ت ث ج ح خ د ذ ر Mignot EJ (October 2012). "A practical guide to the therapy of narcolepsy and hypersomnia syndromes". Neurotherapeutics. 9 (4): 739–752. doi:10.1007/s13311-012-0150-9. PMC 3480574. PMID 23065655.
At the pathophysiological level, it is now clear that most narcolepsy cases with cataplexy, and a minority of cases (5–30 %) without cataplexy or with atypical cataplexy-like symptoms, are caused by a lack of hypocretin (orexin) of likely an autoimmune origin. In these cases, once the disease is established, the majority of the 70,000 hypocretin-producing cells have been destroyed, and the disorder is irreversible. ... Amphetamines are exceptionally wake-promoting, and at high doses also reduce cataplexy in narcoleptic patients [9], an effect best explained by its action on adrenergic and serotoninergic synapses. ... The D-isomer is more specific for DA transmission and is a better stimulant compound. Some effects on cataplexy (especially for the L-isomer), secondary to adrenergic effects, occur at higher doses. ... Numerous studies have shown that increased dopamine release is the main property explaining wake-promotion [3, 13], although norepinephrine effects also contribute.
- ^ أ ب ت ث ج Yoshida T (1997). "Chapter 1: Use and Misuse of Amphetamines: An International Overview". In Klee H (ed.). Amphetamine Misuse: International Perspectives on Current Trends. Amsterdam, Netherlands: Harwood Academic Publishers. p. 2. ISBN 9789057020810.
Amphetamine, in the singular form, properly applies to the racemate of 2-amino-1-phenylpropane. ... In its broadest context, however, the term [amphetamines] can even embrace a large number of structurally and pharmacologically related substances.
- ^ "Density". Amphetamine. United States National Library of Medicine – National Center for Biotechnology Information. PubChem Compound Database. 5 November 2016. Retrieved 9 November 2016.
- ^ Amphetamine. American Chemical Society. CAS Common Chemistry. Retrieved 25 October 2022.
- ^ أ ب "Chemical and Physical Properties". Amphetamine. United States National Library of Medicine – National Center for Biotechnology Information. PubChem Compound Database. Retrieved 13 October 2013.
- ^ أ ب ت "Compound Summary". Amphetamine. United States National Library of Medicine – National Center for Biotechnology Information. PubChem Compound Database. 11 April 2015. Retrieved 17 April 2015.
- ^ أ ب Greene SL, Kerr F, Braitberg G (October 2008). "Review article: amphetamines and related drugs of abuse". Emergency Medicine Australasia. 20 (5): 391–402. doi:10.1111/j.1742-6723.2008.01114.x. PMID 18973636. S2CID 20755466.
- ^ Rasmussen N (January 2015). Taba P, Lees A, Sikk K (eds.). "Amphetamine-Type Stimulants: The Early History of Their Medical and Non-Medical Uses". International Review of Neurobiology. The Neuropsychiatric Complications of Stimulant Abuse. Academic Press. 120: 9–25. doi:10.1016/bs.irn.2015.02.001. PMID 26070751.
- ^ أ ب "Enantiomer". IUPAC Compendium of Chemical Terminology. International Union of Pure and Applied Chemistry. IUPAC Goldbook. 2009. doi:10.1351/goldbook.E02069. ISBN 9780967855097. Archived from the original on 17 March 2013. Retrieved 14 March 2014.
One of a pair of molecular entities which are mirror images of each other and non-superposable.
- ^ أ ب ت ث ج ح خ د ذ ر Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 13: Higher Cognitive Function and Behavioral Control". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, US: McGraw-Hill Medical. pp. 318, 321. ISBN 9780071481274.
Therapeutic (relatively low) doses of psychostimulants, such as methylphenidate and amphetamine, improve performance on working memory tasks both in normal subjects and those with ADHD. ... stimulants act not only on working memory function, but also on general levels of arousal and, within the nucleus accumbens, improve the saliency of tasks. Thus, stimulants improve performance on effortful but tedious tasks ... through indirect stimulation of dopamine and norepinephrine receptors. ...
Beyond these general permissive effects, dopamine (acting via D1 receptors) and norepinephrine (acting at several receptors) can, at optimal levels, enhance working memory and aspects of attention. - ^ أ ب ت ث ج ح خ Liddle DG, Connor DJ (June 2013). "Nutritional supplements and ergogenic AIDS". Primary Care: Clinics in Office Practice. 40 (2): 487–505. doi:10.1016/j.pop.2013.02.009. PMID 23668655.
Amphetamines and caffeine are stimulants that increase alertness, improve focus, decrease reaction time, and delay fatigue, allowing for an increased intensity and duration of training ...
Physiologic and performance effects
• Amphetamines increase dopamine/norepinephrine release and inhibit their reuptake, leading to central nervous system (CNS) stimulation
• Amphetamines seem to enhance athletic performance in anaerobic conditions 39 40
• Improved reaction time
• Increased muscle strength and delayed muscle fatigue
• Increased acceleration
• Increased alertness and attention to task - ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف ق ك ل م ن هـ و ي أأ أب أت أث أج أح أخ أد أذ أر أز أس "Adderall XR- dextroamphetamine sulfate, dextroamphetamine saccharate, amphetamine sulfate and amphetamine aspartate capsule, extended release". DailyMed. Shire US Inc. 17 July 2019. Retrieved 22 December 2019.
- ^ أ ب ت ث Rasmussen N (July 2006). "Making the first anti-depressant: amphetamine in American medicine, 1929–1950". Journal of the History of Medicine and Allied Sciences. 61 (3): 288–323. doi:10.1093/jhmas/jrj039. PMID 16492800. S2CID 24974454.
However the firm happened to discover the drug, SKF first packaged it as an inhaler so as to exploit the base's volatility and, after sponsoring some trials by East Coast otolaryngological specialists, began to advertise the Benzedrine Inhaler as a decongestant in late 1933.
- ^ أ ب "Convention on psychotropic substances". United Nations Treaty Collection. United Nations. Archived from the original on 31 March 2016. Retrieved 11 November 2013.
- ^ أ ب Wilens TE, Adler LA, Adams J, Sgambati S, Rotrosen J, Sawtelle R, et al. (January 2008). "Misuse and diversion of stimulants prescribed for ADHD: a systematic review of the literature". Journal of the American Academy of Child & Adolescent Psychiatry. 47 (1): 21–31. doi:10.1097/chi.0b013e31815a56f1. PMID 18174822.
Stimulant misuse appears to occur both for performance enhancement and their euphorogenic effects, the latter being related to the intrinsic properties of the stimulants (e.g., IR versus ER profile) ...
Although useful in the treatment of ADHD, stimulants are controlled II substances with a history of preclinical and human studies showing potential abuse liability. - ^ أ ب ت Montgomery KA (June 2008). "Sexual desire disorders". Psychiatry. 5 (6): 50–55. PMC 2695750. PMID 19727285.
- ^ "Amphetamine". Medical Subject Headings. United States National Library of Medicine. Retrieved 16 December 2013.
- ^ "Guidelines on the Use of International Nonproprietary Names (INNS) for Pharmaceutical Substances". World Health Organization. 1997. Archived from the original on 9 January 2015. Retrieved 1 December 2014.
In principle, INNs are selected only for the active part of the molecule which is usually the base, acid or alcohol. In some cases, however, the active molecules need to be expanded for various reasons, such as formulation purposes, bioavailability or absorption rate. In 1975 the experts designated for the selection of INN decided to adopt a new policy for naming such molecules. In future, names for different salts or esters of the same active substance should differ only with regard to the inactive moiety of the molecule. ... The latter are called modified INNs (INNMs).
- ^ أ ب ت ث ج ح خ د ذ "Evekeo- amphetamine sulfate tablet". DailyMed. Arbor Pharmaceuticals, LLC. 14 August 2019. Retrieved 22 December 2019.
- ^ أ ب ت ث ج ح خ د "National Drug Code Amphetamine Search Results". National Drug Code Directory. United States Food and Drug Administration. Archived from the original on 16 December 2013. Retrieved 16 December 2013.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف ق ك ل م ن هـ و ي أأ أب Miller GM (January 2011). "The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity". Journal of Neurochemistry. 116 (2): 164–176. doi:10.1111/j.1471-4159.2010.07109.x. PMC 3005101. PMID 21073468.
- ^ أ ب ت ث ج Grandy DK, Miller GM, Li JX (February 2016). ""TAARgeting Addiction"-The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference". Drug and Alcohol Dependence. 159: 9–16. doi:10.1016/j.drugalcdep.2015.11.014. PMC 4724540. PMID 26644139.
When considered together with the rapidly growing literature in the field a compelling case emerges in support of developing TAAR1-selective agonists as medications for preventing relapse to psychostimulant abuse.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف ق ك ل Westfall DP, Westfall TC (2010). "Miscellaneous Sympathomimetic Agonists". In Brunton LL, Chabner BA, Knollmann BC (eds.). Goodman & Gilman's Pharmacological Basis of Therapeutics (12th ed.). New York, US: McGraw-Hill. ISBN 9780071624428.
- ^ أ ب ت ث ج Shoptaw SJ, Kao U, Ling W (January 2009). Shoptaw SJ, Ali R (eds.). "Treatment for amphetamine psychosis". Cochrane Database of Systematic Reviews. 2009 (1): CD003026. doi:10.1002/14651858.CD003026.pub3. PMC 7004251. PMID 19160215.
A minority of individuals who use amphetamines develop full-blown psychosis requiring care at emergency departments or psychiatric hospitals. In such cases, symptoms of amphetamine psychosis commonly include paranoid and persecutory delusions as well as auditory and visual hallucinations in the presence of extreme agitation. More common (about 18%) is for frequent amphetamine users to report psychotic symptoms that are sub-clinical and that do not require high-intensity intervention ...
About 5–15% of the users who develop an amphetamine psychosis fail to recover completely (Hofmann 1983) ...
Findings from one trial indicate use of antipsychotic medications effectively resolves symptoms of acute amphetamine psychosis.
psychotic symptoms of individuals with amphetamine psychosis may be due exclusively to heavy use of the drug or heavy use of the drug may exacerbate an underlying vulnerability to schizophrenia. - ^ أ ب ت ث ج Bramness JG, Gundersen ØH, Guterstam J, Rognli EB, Konstenius M, Løberg EM, et al. (December 2012). "Amphetamine-induced psychosis—a separate diagnostic entity or primary psychosis triggered in the vulnerable?". BMC Psychiatry. 12: 221. doi:10.1186/1471-244X-12-221. PMC 3554477. PMID 23216941.
In these studies, amphetamine was given in consecutively higher doses until psychosis was precipitated, often after 100–300 mg of amphetamine ... Secondly, psychosis has been viewed as an adverse event, although rare, in children with ADHD who have been treated with amphetamine
- ^ أ ب ت Greydanus D. "Stimulant Misuse: Strategies to Manage a Growing Problem" (PDF). American College Health Association (Review Article). ACHA Professional Development Program. p. 20. Archived from the original (PDF) on 3 November 2013. Retrieved 2 November 2013.
- ^ أ ب ت ث ج ح خ Huang YS, Tsai MH (July 2011). "Long-term outcomes with medications for attention-deficit hyperactivity disorder: current status of knowledge". CNS Drugs. 25 (7): 539–554. doi:10.2165/11589380-000000000-00000. PMID 21699268. S2CID 3449435.
Several other studies,[97-101] including a meta-analytic review[98] and a retrospective study,[97] suggested that stimulant therapy in childhood is associated with a reduced risk of subsequent substance use, cigarette smoking and alcohol use disorders. ... Recent studies have demonstrated that stimulants, along with the non-stimulants atomoxetine and extended-release guanfacine, are continuously effective for more than 2-year treatment periods with few and tolerable adverse effects. The effectiveness of long-term therapy includes not only the core symptoms of ADHD, but also improved quality of life and academic achievements. The most concerning short-term adverse effects of stimulants, such as elevated blood pressure and heart rate, waned in long-term follow-up studies. ... The current data do not support the potential impact of stimulants on the worsening or development of tics or substance abuse into adulthood. In the longest follow-up study (of more than 10 years), lifetime stimulant treatment for ADHD was effective and protective against the development of adverse psychiatric disorders.
- ^ أ ب Malenka RC, Nestler EJ, Hyman SE, Holtzman DM (2015). "Chapter 16: Reinforcement and Addictive Disorders". Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (3rd ed.). New York: McGraw-Hill Medical. ISBN 9780071827706.
Such agents also have important therapeutic uses; cocaine, for example, is used as a local anesthetic (Chapter 2), and amphetamines and methylphenidate are used in low doses to treat attention deficit hyperactivity disorder and in higher doses to treat narcolepsy (Chapter 12). Despite their clinical uses, these drugs are strongly reinforcing, and their long-term use at high doses is linked with potential addiction, especially when they are rapidly administered or when high-potency forms are given.
- ^ أ ب Kollins SH (May 2008). "A qualitative review of issues arising in the use of psycho-stimulant medications in patients with ADHD and co-morbid substance use disorders". Current Medical Research and Opinion. 24 (5): 1345–1357. doi:10.1185/030079908X280707. PMID 18384709. S2CID 71267668.
When oral formulations of psychostimulants are used at recommended doses and frequencies, they are unlikely to yield effects consistent with abuse potential in patients with ADHD.
- ^ أ ب ت ث ج ح خ Broadley KJ (March 2010). "The vascular effects of trace amines and amphetamines". Pharmacology & Therapeutics. 125 (3): 363–375. doi:10.1016/j.pharmthera.2009.11.005. PMID 19948186.
- ^ أ ب ت ث "Amphetamine". European Monitoring Centre for Drugs and Drug Addiction. Retrieved 19 October 2013.
- ^ أ ب ت ث Hagel JM, Krizevski R, Marsolais F, Lewinsohn E, Facchini PJ (2012). "Biosynthesis of amphetamine analogs in plants". Trends in Plant Science. 17 (7): 404–412. doi:10.1016/j.tplants.2012.03.004. PMID 22502775.
Substituted amphetamines, which are also called phenylpropylamino alkaloids, are a diverse group of nitrogen-containing compounds that feature a phenethylamine backbone with a methyl group at the α-position relative to the nitrogen (Figure 1). ... Beyond (1R,2S)-ephedrine and (1S,2S)-pseudoephedrine, myriad other substituted amphetamines have important pharmaceutical applications. ... For example, (S)-amphetamine (Figure 4b), a key ingredient in Adderall and Dexedrine, is used to treat attention deficit hyperactivity disorder (ADHD) [79]. ...
[Figure 4](b) Examples of synthetic, pharmaceutically important substituted amphetamines. - ^ أ ب Bett WR (August 1946). "Benzedrine sulphate in clinical medicine; a survey of the literature". Postgraduate Medical Journal. 22 (250): 205–218. doi:10.1136/pgmj.22.250.205. PMC 2478360. PMID 20997404.
- ^ أ ب Carvalho M, Carmo H, Costa VM, Capela JP, Pontes H, Remião F, et al. (August 2012). "Toxicity of amphetamines: an update". Archives of Toxicology. 86 (8): 1167–1231. doi:10.1007/s00204-012-0815-5. PMID 22392347. S2CID 2873101.
- ^ Berman S, O'Neill J, Fears S, Bartzokis G, London ED (October 2008). "Abuse of amphetamines and structural abnormalities in the brain". Annals of the New York Academy of Sciences. 1141 (1): 195–220. doi:10.1196/annals.1441.031. PMC 2769923. PMID 18991959.
- ^ أ ب Hart H, Radua J, Nakao T, Mataix-Cols D, Rubia K (February 2013). "Meta-analysis of functional magnetic resonance imaging studies of inhibition and attention in attention-deficit/hyperactivity disorder: exploring task-specific, stimulant medication, and age effects". JAMA Psychiatry. 70 (2): 185–198. doi:10.1001/jamapsychiatry.2013.277. PMID 23247506.
- ^ أ ب Spencer TJ, Brown A, Seidman LJ, Valera EM, Makris N, Lomedico A, et al. (September 2013). "Effect of psychostimulants on brain structure and function in ADHD: a qualitative literature review of magnetic resonance imaging-based neuroimaging studies". The Journal of Clinical Psychiatry. 74 (9): 902–917. doi:10.4088/JCP.12r08287. PMC 3801446. PMID 24107764.
- ^ أ ب Frodl T, Skokauskas N (February 2012). "Meta-analysis of structural MRI studies in children and adults with attention deficit hyperactivity disorder indicates treatment effects". Acta Psychiatrica Scandinavica. 125 (2): 114–126. doi:10.1111/j.1600-0447.2011.01786.x. PMID 22118249. S2CID 25954331.
Basal ganglia regions like the right globus pallidus, the right putamen, and the nucleus caudatus are structurally affected in children with ADHD. These changes and alterations in limbic regions like ACC and amygdala are more pronounced in non-treated populations and seem to diminish over time from child to adulthood. Treatment seems to have positive effects on brain structure.
- ^ أ ب ت ث Millichap JG (2010). "Chapter 9: Medications for ADHD". In Millichap JG (ed.). Attention Deficit Hyperactivity Disorder Handbook: A Physician's Guide to ADHD (2nd ed.). New York, US: Springer. pp. 121–123, 125–127. ISBN 9781441913968.
Ongoing research has provided answers to many of the parents' concerns, and has confirmed the effectiveness and safety of the long-term use of medication.
- ^ أ ب ت ث ج Arnold LE, Hodgkins P, Caci H, Kahle J, Young S (February 2015). "Effect of treatment modality on long-term outcomes in attention-deficit/hyperactivity disorder: a systematic review". PLOS ONE. 10 (2): e0116407. doi:10.1371/journal.pone.0116407. PMC 4340791. PMID 25714373.
The highest proportion of improved outcomes was reported with combination treatment (83% of outcomes). Among significantly improved outcomes, the largest effect sizes were found for combination treatment. The greatest improvements were associated with academic, self-esteem, or social function outcomes.
Figure 3: Treatment benefit by treatment type and outcome group - ^ أ ب ت Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, US: McGraw-Hill Medical. pp. 154–157. ISBN 9780071481274.
- ^ أ ب ت ث ج Bidwell LC, McClernon FJ, Kollins SH (August 2011). "Cognitive enhancers for the treatment of ADHD". Pharmacology Biochemistry and Behavior. 99 (2): 262–274. doi:10.1016/j.pbb.2011.05.002. PMC 3353150. PMID 21596055.
- ^ Parker J, Wales G, Chalhoub N, Harpin V (September 2013). "The long-term outcomes of interventions for the management of attention-deficit hyperactivity disorder in children and adolescents: a systematic review of randomized controlled trials". Psychology Research and Behavior Management. 6: 87–99. doi:10.2147/PRBM.S49114. PMC 3785407. PMID 24082796.
Only one paper53 examining outcomes beyond 36 months met the review criteria. ... There is high level evidence suggesting that pharmacological treatment can have a major beneficial effect on the core symptoms of ADHD (hyperactivity, inattention, and impulsivity) in approximately 80% of cases compared with placebo controls, in the short term.
- ^ Millichap JG (2010). "Chapter 9: Medications for ADHD". In Millichap JG (ed.). Attention Deficit Hyperactivity Disorder Handbook: A Physician's Guide to ADHD (2nd ed.). New York, US: Springer. pp. 111–113. ISBN 9781441913968.
- ^ "Stimulants for Attention Deficit Hyperactivity Disorder". WebMD. Healthwise. 12 April 2010. Retrieved 12 November 2013.
- ^ Scholten RJ, Clarke M, Hetherington J (August 2005). "The Cochrane Collaboration". European Journal of Clinical Nutrition. 59 (Suppl 1): S147–S149, discussion S195–S196. doi:10.1038/sj.ejcn.1602188. PMID 16052183. S2CID 29410060.
- ^ أ ب Castells X, Blanco-Silvente L, Cunill R (August 2018). "Amphetamines for attention deficit hyperactivity disorder (ADHD) in adults". Cochrane Database of Systematic Reviews. 2018 (8): CD007813. doi:10.1002/14651858.CD007813.pub3. PMC 6513464. PMID 30091808.
- ^ Punja S, Shamseer L, Hartling L, Urichuk L, Vandermeer B, Nikles J, et al. (February 2016). "Amphetamines for attention deficit hyperactivity disorder (ADHD) in children and adolescents". Cochrane Database of Systematic Reviews. 2016 (2): CD009996. doi:10.1002/14651858.CD009996.pub2. PMC 10329868. PMID 26844979.
- ^ Osland ST, Steeves TD, Pringsheim T (June 2018). "Pharmacological treatment for attention deficit hyperactivity disorder (ADHD) in children with comorbid tic disorders". Cochrane Database of Systematic Reviews. 2018 (6): CD007990. doi:10.1002/14651858.CD007990.pub3. PMC 6513283. PMID 29944175.
- ^ Mahlios J, De la Herrán-Arita AK, Mignot E (October 2013). "The autoimmune basis of narcolepsy". Current Opinion in Neurobiology. 23 (5): 767–773. doi:10.1016/j.conb.2013.04.013. PMC 3848424. PMID 23725858.
- ^ أ ب ت Barateau L, Pizza F, Plazzi G, Dauvilliers Y (August 2022). "Narcolepsy". Journal of Sleep Research. 31 (4): e13631. doi:10.1111/jsr.13631. PMID 35624073.
Narcolepsy type 1 was called "narcolepsy with cataplexy" before 2014 (AASM, 2005), but was renamed NT1 in the third and last international classification of sleep disorders (AASM, 2014). ... A low level of Hcrt-1 in the CSF is very sensitive and specific for the diagnosis of NT1. ... All patients with low CSF Hcrt-1 levels are considered as NT1 patients, even if they report no cataplexy (in about 10–20% of cases), and all patients with normal CSF Hcrt-1 levels (or without cataplexy when the lumbar puncture is not performed) as NT2 patients (Baumann et al., 2014). ... In patients with NT1, the absence of Hcrt leads to the inhibition of regions that suppress REM sleep, thus allowing the activation of descending pathways inhibiting motoneurons, leading to cataplexy.
- ^ أ ب Malenka RC, Nestler EJ, Hyman SE, Holtzman DM (2015). "Chapter 10: Neural and Neuroendocrine Control of the Internal Milieu". Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (3rd ed.). New York: McGraw-Hill Medical. pp. 456–457. ISBN 9780071827706.
More recently, the lateral hypothalamus was also found to play a central role in arousal. Neurons in this region contain cell bodies that produce the orexin (also called hypocretin) peptides (Chapter 6). These neurons project widely throughout the brain and are involved in sleep, arousal, feeding, reward,aspects of emotion, and learning. In fact, orexin is thought to promote feeding primarily by promoting arousal. Mutations in orexin receptors are responsible for narcolepsy in a canine model, knockout of the orexin gene produces narcolepsy in mice, and humans with narcolepsy have low or absent levels of orexin peptides in cerebrospinal fluid (Chapter 13). Lateral hypothalamus neurons have reciprocal connections with neurons that produce monoamine neurotransmitters (Chapter 6).
- ^ أ ب ت Malenka RC, Nestler EJ, Hyman SE, Holtzman DM (2015). "Chapter 13: Sleep and Arousal". Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (3rd ed.). McGraw-Hill Medical. p. 521. ISBN 9780071827706.
The ARAS consists of several different circuits including the four main monoaminergic pathways discussed in Chapter 6. The norepinephrine pathway originates from the LC and related brainstem nuclei; the serotonergic neurons originate from the RN within the brainstem as well; the dopaminergic neurons originate in the ventral tegmental area (VTA); and the histaminergic pathway originates from neurons in the tuberomammillary nucleus (TMN) of the posterior hypothalamus. As discussed in Chapter 6, these neurons project widely throughout the brain from restricted collections of cell bodies. Norepinephrine, serotonin,dopamine, and histamine have complex modulatory functions and, in general, promote wakefulness. The PT in the brainstem is also an important component of the ARAS. Activity of PT cholinergic neurons (REM-on cells) promotes REM sleep, as noted earlier. During waking, REM-on cells are inhibited by a subset of ARAS norepinephrine and serotonin neurons called REM-off cells.
- ^ Shneerson JM (2009). Sleep medicine a guide to sleep and its disorders (2nd ed.). John Wiley & Sons. p. 81. ISBN 9781405178518.
All the amphetamines enhance activity at dopamine, noradrenaline and 5HT synapses. They cause presynaptic release of preformed transmitters, and also inhibit the re-uptake of dopamine and noradrenaline. These actions are most prominent in the brainstem ascending reticular activating system and the cerebral cortex.
- ^ Schwartz JR, Roth T (2008). "Neurophysiology of sleep and wakefulness: basic science and clinical implications". Current Neuropharmacology. 6 (4): 367–378. doi:10.2174/157015908787386050. PMC 2701283. PMID 19587857.
Alertness and associated forebrain and cortical arousal are mediated by several ascending pathways with distinct neuronal components that project from the upper brain stem near the junction of the pons and the midbrain [33]. ... Key cell populations of the ascending arousal pathway include cholinergic, noradrenergic, serotoninergic, dopaminergic, and histaminergic neurons located in the pedunculopontine and laterodorsal tegmental nucleus (PPT/LDT), locus coeruleus, dorsal and median raphe nucleus, and tuberomammillary nucleus (TMN), respectively. ... The mechanism of action of sympathomimetic alerting drugs (eg, dextro- and methamphetamine, methylphenidate) is direct or indirect stimulation of dopaminergic and noradrenergic nuclei, which in turn heightens the efficacy of the ventral periaqueductal grey area and locus coeruleus, both components of the secondary branch of the ascending arousal system. ... Sympathomimetic drugs have long been used to treat narcolepsy
- ^ أ ب ت ث ج Maski K, Trotti LM, Kotagal S, Robert Auger R, Rowley JA, Hashmi SD, et al. (September 2021). "Treatment of central disorders of hypersomnolence: an American Academy of Sleep Medicine clinical practice guideline". Journal of Clinical Sleep Medicine. 17 (9): 1881–1893. doi:10.5664/jcsm.9328. PMC 8636351. PMID 34743789.
The TF identified 1 double-blind RCT, 1 single-blind RCT, and 1 retrospective observational long-term self-reported case series assessing the efficacy of dextroamphetamine in patients with narcolepsy type 1 and narcolepsy type 2. These studies demonstrated clinically significant improvements in excessive daytime sleepiness and cataplexy.
- ^ Dauvilliers Y, Barateau L (August 2017). "Narcolepsy and Other Central Hypersomnias". Continuum. 23 (4, Sleep Neurology): 989–1004. doi:10.1212/CON.0000000000000492. PMID 28777172.
Recent clinical trials and practice guidelines have confirmed that stimulants such as modafinil, armodafinil, or sodium oxybate (as first line); methylphenidate and pitolisant (as second line [pitolisant is currently only available in Europe]); and amphetamines (as third line) are appropriate medications for excessive daytime sleepiness.
- ^ أ ب ت ث ج Barateau L, Lopez R, Dauvilliers Y (October 2016). "Management of Narcolepsy". Current Treatment Options in Neurology. 18 (10): 43. doi:10.1007/s11940-016-0429-y. PMID 27549768.
The usefulness of amphetamines is limited by a potential risk of abuse, and their cardiovascular adverse effects (Table 1). That is why, even though they are cheaper than other drugs, and efficient, they remain third-line therapy in narcolepsy. Three class II studies showed an improvement of EDS in that disease [22, 33, 34]. ... Despite the potential for drug abuse or tolerance using stimulants, patients with narcolepsy rarely exhibit addiction to their medication [35]. ... Some stimulants, such as mazindol, amphetamines, and pitolisant, may also have some anticataplectic effects [26, 27•, 39•].
- ^ Thorpy MJ, Bogan RK (April 2020). "Update on the pharmacologic management of narcolepsy: mechanisms of action and clinical implications". Sleep Medicine. 68: 97–109. doi:10.1016/j.sleep.2019.09.001. PMID 32032921.
The first agents used to treat EDS (ie, amphetamines, methylphenidate) are now considered second- or third-line options [24], [47], [105] because newer medications have been developed with improved tolerability and lower abuse potential (eg, modafinil/armodafinil, solriamfetol, pitolisant)
- ^ أ ب Spencer RC, Devilbiss DM, Berridge CW (June 2015). "The Cognition-Enhancing Effects of Psychostimulants Involve Direct Action in the Prefrontal Cortex". Biological Psychiatry. 77 (11): 940–950. doi:10.1016/j.biopsych.2014.09.013. PMC 4377121. PMID 25499957.
The procognitive actions of psychostimulants are only associated with low doses. Surprisingly, despite nearly 80 years of clinical use, the neurobiology of the procognitive actions of psychostimulants has only recently been systematically investigated. Findings from this research unambiguously demonstrate that the cognition-enhancing effects of psychostimulants involve the preferential elevation of catecholamines in the PFC and the subsequent activation of norepinephrine α2 and dopamine D1 receptors. ... This differential modulation of PFC-dependent processes across dose appears to be associated with the differential involvement of noradrenergic α2 versus α1 receptors. Collectively, this evidence indicates that at low, clinically relevant doses, psychostimulants are devoid of the behavioral and neurochemical actions that define this class of drugs and instead act largely as cognitive enhancers (improving PFC-dependent function). ... In particular, in both animals and humans, lower doses maximally improve performance in tests of working memory and response inhibition, whereas maximal suppression of overt behavior and facilitation of attentional processes occurs at higher doses.
- ^ Ilieva IP, Hook CJ, Farah MJ (June 2015). "Prescription Stimulants' Effects on Healthy Inhibitory Control, Working Memory, and Episodic Memory: A Meta-analysis". Journal of Cognitive Neuroscience. 27 (6): 1069–1089. doi:10.1162/jocn_a_00776. PMID 25591060. S2CID 15788121.
Specifically, in a set of experiments limited to high-quality designs, we found significant enhancement of several cognitive abilities. ... The results of this meta-analysis ... do confirm the reality of cognitive enhancing effects for normal healthy adults in general, while also indicating that these effects are modest in size.
- ^ Bagot KS, Kaminer Y (April 2014). "Efficacy of stimulants for cognitive enhancement in non-attention deficit hyperactivity disorder youth: a systematic review". Addiction. 109 (4): 547–557. doi:10.1111/add.12460. PMC 4471173. PMID 24749160.
Amphetamine has been shown to improve consolidation of information (0.02 ≥ P ≤ 0.05), leading to improved recall.
- ^ Devous MD, Trivedi MH, Rush AJ (April 2001). "Regional cerebral blood flow response to oral amphetamine challenge in healthy volunteers". Journal of Nuclear Medicine. 42 (4): 535–542. PMID 11337538.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 10: Neural and Neuroendocrine Control of the Internal Milieu". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, US: McGraw-Hill Medical. p. 266. ISBN 9780071481274.
Dopamine acts in the nucleus accumbens to attach motivational significance to stimuli associated with reward.
- ^ أ ب ت Wood S, Sage JR, Shuman T, Anagnostaras SG (January 2014). "Psychostimulants and cognition: a continuum of behavioral and cognitive activation". Pharmacological Reviews. 66 (1): 193–221. doi:10.1124/pr.112.007054. PMC 3880463. PMID 24344115.
- ^ Twohey M (26 March 2006). "Pills become an addictive study aid". JS Online. Archived from the original on 15 August 2007. Retrieved 2 December 2007.
- ^ Teter CJ, McCabe SE, LaGrange K, Cranford JA, Boyd CJ (October 2006). "Illicit use of specific prescription stimulants among college students: prevalence, motives, and routes of administration". Pharmacotherapy. 26 (10): 1501–1510. doi:10.1592/phco.26.10.1501. PMC 1794223. PMID 16999660.
- ^ Weyandt LL, Oster DR, Marraccini ME, Gudmundsdottir BG, Munro BA, Zavras BM, et al. (September 2014). "Pharmacological interventions for adolescents and adults with ADHD: stimulant and nonstimulant medications and misuse of prescription stimulants". Psychology Research and Behavior Management. 7: 223–249. doi:10.2147/PRBM.S47013. PMC 4164338. PMID 25228824.
misuse of prescription stimulants has become a serious problem on college campuses across the US and has been recently documented in other countries as well. ... Indeed, large numbers of students claim to have engaged in the nonmedical use of prescription stimulants, which is reflected in lifetime prevalence rates of prescription stimulant misuse ranging from 5% to nearly 34% of students.
- ^ Clemow DB, Walker DJ (September 2014). "The potential for misuse and abuse of medications in ADHD: a review". Postgraduate Medicine. 126 (5): 64–81. doi:10.3810/pgm.2014.09.2801. PMID 25295651. S2CID 207580823.
Overall, the data suggest that ADHD medication misuse and diversion are common health care problems for stimulant medications, with the prevalence believed to be approximately 5% to 10% of high school students and 5% to 35% of college students, depending on the study.
- ^ Bracken NM (January 2012). "National Study of Substance Use Trends Among NCAA College Student-Athletes" (PDF). NCAA Publications. National Collegiate Athletic Association. Archived (PDF) from the original on 2022-10-09. Retrieved 8 October 2013.
- ^ Docherty JR (June 2008). "Pharmacology of stimulants prohibited by the World Anti-Doping Agency (WADA)". British Journal of Pharmacology. 154 (3): 606–622. doi:10.1038/bjp.2008.124. PMC 2439527. PMID 18500382.
- ^ أ ب ت ث Parr JW (July 2011). "Attention-deficit hyperactivity disorder and the athlete: new advances and understanding". Clinics in Sports Medicine. 30 (3): 591–610. doi:10.1016/j.csm.2011.03.007. PMID 21658550.
In 1980, Chandler and Blair47 showed significant increases in knee extension strength, acceleration, anaerobic capacity, time to exhaustion during exercise, pre-exercise and maximum heart rates, and time to exhaustion during maximal oxygen consumption (VO2 max) testing after administration of 15 mg of dextroamphetamine versus placebo. Most of the information to answer this question has been obtained in the past decade through studies of fatigue rather than an attempt to systematically investigate the effect of ADHD drugs on exercise.
- ^ أ ب ت Roelands B, de Koning J, Foster C, Hettinga F, Meeusen R (May 2013). "Neurophysiological determinants of theoretical concepts and mechanisms involved in pacing". Sports Medicine. 43 (5): 301–311. doi:10.1007/s40279-013-0030-4. PMID 23456493. S2CID 30392999.
In high-ambient temperatures, dopaminergic manipulations clearly improve performance. The distribution of the power output reveals that after dopamine reuptake inhibition, subjects are able to maintain a higher power output compared with placebo. ... Dopaminergic drugs appear to override a safety switch and allow athletes to use a reserve capacity that is 'off-limits' in a normal (placebo) situation.
- ^ Parker KL, Lamichhane D, Caetano MS, Narayanan NS (October 2013). "Executive dysfunction in Parkinson's disease and timing deficits". Frontiers in Integrative Neuroscience. 7: 75. doi:10.3389/fnint.2013.00075. PMC 3813949. PMID 24198770.
Manipulations of dopaminergic signaling profoundly influence interval timing, leading to the hypothesis that dopamine influences internal pacemaker, or "clock," activity. For instance, amphetamine, which increases concentrations of dopamine at the synaptic cleft advances the start of responding during interval timing, whereas antagonists of D2 type dopamine receptors typically slow timing;... Depletion of dopamine in healthy volunteers impairs timing, while amphetamine releases synaptic dopamine and speeds up timing.
- ^ Rattray B, Argus C, Martin K, Northey J, Driller M (March 2015). "Is it time to turn our attention toward central mechanisms for post-exertional recovery strategies and performance?". Frontiers in Physiology. 6: 79. doi:10.3389/fphys.2015.00079. PMC 4362407. PMID 25852568.
Aside from accounting for the reduced performance of mentally fatigued participants, this model rationalizes the reduced RPE and hence improved cycling time trial performance of athletes using a glucose mouthwash (Chambers et al., 2009) and the greater power output during a RPE matched cycling time trial following amphetamine ingestion (Swart, 2009). ... Dopamine stimulating drugs are known to enhance aspects of exercise performance (Roelands et al., 2008)
- ^ Roelands B, De Pauw K, Meeusen R (June 2015). "Neurophysiological effects of exercise in the heat". Scandinavian Journal of Medicine & Science in Sports. 25 (Suppl 1): 65–78. doi:10.1111/sms.12350. PMID 25943657. S2CID 22782401.
This indicates that subjects did not feel they were producing more power and consequently more heat. The authors concluded that the "safety switch" or the mechanisms existing in the body to prevent harmful effects are overridden by the drug administration (Roelands et al., 2008b). Taken together, these data indicate strong ergogenic effects of an increased DA concentration in the brain, without any change in the perception of effort.
- ^ "Commonly Abused Prescription Drugs Chart". National Institute on Drug Abuse. Retrieved 7 May 2012.
- ^ "Stimulant ADHD Medications – Methylphenidate and Amphetamines". National Institute on Drug Abuse. Archived from the original on 2 May 2012. Retrieved 7 May 2012.
- ^ أ ب ت ث ج "National Institute on Drug Abuse. 2009. Stimulant ADHD Medications – Methylphenidate and Amphetamines". National Institute on Drug Abuse. Retrieved 27 February 2013.
- ^ أ ب ت Wilson A (2008). "Mixing the Medicine: The Unintended Consequence of Amphetamine Control on the Northern Soul Scene" (PDF). The Internet Journal of Criminology. SSRN 1339332. Archived from the original (PDF) on 13 July 2011.
- ^ Schultz W (2015). "Neuronal reward and decision signals: from theories to data". Physiological Reviews. 95 (3): 853–951. doi:10.1152/physrev.00023.2014. PMC 4491543. PMID 26109341.
Rewards in operant conditioning are positive reinforcers. ... Operant behavior gives a good definition for rewards. Anything that makes an individual come back for more is a positive reinforcer and therefore a reward. Although it provides a good definition, positive reinforcement is only one of several reward functions. ... Rewards are attractive. They are motivating and make us exert an effort. ... Rewards induce approach behavior, also called appetitive or preparatory behavior, sexual behavior, and consummatory behavior. ... Thus any stimulus, object, event, activity, or situation that has the potential to make us approach and consume it is by definition a reward. ... Rewarding stimuli, objects, events, situations, and activities consist of several major components. First, rewards have basic sensory components (visual, auditory, somatosensory, gustatory, and olfactory) ... Second, rewards are salient and thus elicit attention, which are manifested as orienting responses. The salience of rewards derives from three principal factors, namely, their physical intensity and impact (physical salience), their novelty and surprise (novelty/surprise salience), and their general motivational impact shared with punishers (motivational salience). A separate form not included in this scheme, incentive salience, primarily addresses dopamine function in addiction and refers only to approach behavior (as opposed to learning) ... Third, rewards have a value component that determines the positively motivating effects of rewards and is not contained in, nor explained by, the sensory and attentional components. This component reflects behavioral preferences and thus is subjective and only partially determined by physical parameters. Only this component constitutes what we understand as a reward. It mediates the specific behavioral reinforcing, approach generating, and emotional effects of rewards that are crucial for the organism's survival and reproduction, whereas all other components are only supportive of these functions. ... Rewards can also be intrinsic to behavior. They contrast with extrinsic rewards that provide motivation for behavior and constitute the essence of operant behavior in laboratory tests. Intrinsic rewards are activities that are pleasurable on their own and are undertaken for their own sake, without being the means for getting extrinsic rewards. ... Intrinsic rewards are genuine rewards in their own right, as they induce learning, approach, and pleasure, like perfectioning, playing, and enjoying the piano. Although they can serve to condition higher order rewards, they are not conditioned, higher order rewards, as attaining their reward properties does not require pairing with an unconditioned reward. ... These emotions are also called liking (for pleasure) and wanting (for desire) in addiction research and strongly support the learning and approach generating functions of reward.
- ^ Canadian ADHD Practice Guidelines (PDF) (Fourth ed.). Canadian ADHD Resource Alliance. 2018. p. 67. Archived from the original (PDF) on 2 May 2023. Retrieved 2 May 2023.
- ^ Bright GM (May 2008). "Abuse of medications employed for the treatment of ADHD: results from a large-scale community survey". Medscape Journal of Medicine. 10 (5): 111. PMC 2438483. PMID 18596945.
- ^ Kessler S (January 1996). "Drug therapy in attention-deficit hyperactivity disorder". Southern Medical Journal. 89 (1): 33–38. doi:10.1097/00007611-199601000-00005. PMID 8545689. S2CID 12798818.
statements on package inserts are not intended to limit medical practice. Rather they are intended to limit claims by pharmaceutical companies. ... the FDA asserts explicitly, and the courts have upheld that clinical decisions are to be made by physicians and patients in individual situations.
- ^ أ ب ت ث ج ح خ د ذ ر ز Heedes G, Ailakis J. "Amphetamine (PIM 934)". INCHEM. International Programme on Chemical Safety. Retrieved 24 June 2014.
- ^ Feinberg SS (November 2004). "Combining stimulants with monoamine oxidase inhibitors: a review of uses and one possible additional indication". The Journal of Clinical Psychiatry. 65 (11): 1520–1524. doi:10.4088/jcp.v65n1113. PMID 15554766.
- ^ Stewart JW, Deliyannides DA, McGrath PJ (June 2014). "How treatable is refractory depression?". Journal of Affective Disorders. 167: 148–152. doi:10.1016/j.jad.2014.05.047. PMID 24972362.
- ^ أ ب ت ث Vitiello B (April 2008). "Understanding the risk of using medications for attention deficit hyperactivity disorder with respect to physical growth and cardiovascular function". Child and Adolescent Psychiatric Clinics of North America. 17 (2): 459–474. doi:10.1016/j.chc.2007.11.010. PMC 2408826. PMID 18295156.
- ^ Ramey JT, Bailen E, Lockey RF (2006). "Rhinitis medicamentosa" (PDF). Journal of Investigational Allergology & Clinical Immunology. 16 (3): 148–155. PMID 16784007. Retrieved 29 April 2015.
Table 2. Decongestants Causing Rhinitis Medicamentosa
– Nasal decongestants:
– Sympathomimetic:
• Amphetamine - ^ أ ب "FDA Drug Safety Communication: Safety Review Update of Medications used to treat Attention-Deficit/Hyperactivity Disorder (ADHD) in children and young adults". United States Food and Drug Administration. 1 November 2011. Archived from the original on 25 August 2019. Retrieved 24 December 2019.
- ^ Cooper WO, Habel LA, Sox CM, Chan KA, Arbogast PG, Cheetham TC, et al. (November 2011). "ADHD drugs and serious cardiovascular events in children and young adults". New England Journal of Medicine. 365 (20): 1896–1904. doi:10.1056/NEJMoa1110212. PMC 4943074. PMID 22043968.
- ^ أ ب "FDA Drug Safety Communication: Safety Review Update of Medications used to treat Attention-Deficit/Hyperactivity Disorder (ADHD) in adults". United States Food and Drug Administration. 12 December 2011. Archived from the original on 14 December 2019. Retrieved 24 December 2013.
- ^ Habel LA, Cooper WO, Sox CM, Chan KA, Fireman BH, Arbogast PG, et al. (December 2011). "ADHD medications and risk of serious cardiovascular events in young and middle-aged adults". JAMA. 306 (24): 2673–2683. doi:10.1001/jama.2011.1830. PMC 3350308. PMID 22161946.
- ^ O'Connor PG (February 2012). "Amphetamines". Merck Manual for Health Care Professionals. Merck. Retrieved 8 May 2012.
- ^ أ ب Childs E, de Wit H (May 2009). "Amphetamine-induced place preference in humans". Biological Psychiatry. 65 (10): 900–904. doi:10.1016/j.biopsych.2008.11.016. PMC 2693956. PMID 19111278.
This study demonstrates that humans, like nonhumans, prefer a place associated with amphetamine administration. These findings support the idea that subjective responses to a drug contribute to its ability to establish place conditioning.
- ^ أ ب
{{cite book}}: Empty citation (help) - ^ أ ب ت ث ج Nestler EJ (December 2013). "Cellular basis of memory for addiction". Dialogues Clin. Neurosci. 15 (4): 431–443. PMC 3898681. PMID 24459410.
Despite the importance of numerous psychosocial factors, at its core, drug addiction involves a biological process: the ability of repeated exposure to a drug of abuse to induce changes in a vulnerable brain that drive the compulsive seeking and taking of drugs, and loss of control over drug use, that define a state of addiction. ... A large body of literature has demonstrated that such ΔFosB induction in D1-type [nucleus accumbens] neurons increases an animal's sensitivity to drug as well as natural rewards and promotes drug self-administration, presumably through a process of positive reinforcement ... Another ΔFosB target is cFos: as ΔFosB accumulates with repeated drug exposure it represses c-Fos and contributes to the molecular switch whereby ΔFosB is selectively induced in the chronic drug-treated state.41. ... Moreover, there is increasing evidence that, despite a range of genetic risks for addiction across the population, exposure to sufficiently high doses of a drug for long periods of time can transform someone who has relatively lower genetic loading into an addict.
- ^ "Glossary of Terms". Mount Sinai School of Medicine. Department of Neuroscience. Retrieved 9 February 2015.
- ^ Volkow ND, Koob GF, McLellan AT (January 2016). "Neurobiologic Advances from the Brain Disease Model of Addiction". N. Engl. J. Med. 374 (4): 363–371. doi:10.1056/NEJMra1511480. PMID 26816013.
Substance-use disorder: A diagnostic term in the fifth edition of the Diagnostic and Statistical Manual of Mental Disorders (DSM-5) referring to recurrent use of alcohol or other drugs that causes clinically and functionally significant impairment, such as health problems, disability, and failure to meet major responsibilities at work, school, or home. Depending on the level of severity, this disorder is classified as mild, moderate, or severe.
Addiction: A term used to indicate the most severe, chronic stage of substance-use disorder, in which there is a substantial loss of self-control, as indicated by compulsive drug taking despite the desire to stop taking the drug. In the DSM-5, the term addiction is synonymous with the classification of severe substance-use disorder. - ^ أ ب ت Renthal W, Nestler EJ (September 2009). "Chromatin regulation in drug addiction and depression". Dialogues Clin. Neurosci. 11 (3): 257–268. PMC 2834246. PMID 19877494.
[Psychostimulants] increase cAMP levels in striatum, which activates protein kinase A (PKA) and leads to phosphorylation of its targets. This includes the cAMP response element binding protein (CREB), the phosphorylation of which induces its association with the histone acetyltransferase, CREB binding protein (CBP) to acetylate histones and facilitate gene activation. This is known to occur on many genes including fosB and c-fos in response to psychostimulant exposure. ΔFosB is also upregulated by chronic psychostimulant treatments, and is known to activate certain genes (eg, cdk5) and repress others (eg, c-fos) where it recruits HDAC1 as a corepressor. ... Chronic exposure to psychostimulants increases glutamatergic [signaling] from the prefrontal cortex to the NAc. Glutamatergic signaling elevates Ca2+ levels in NAc postsynaptic elements where it activates CaMK (calcium/calmodulin protein kinases) signaling, which, in addition to phosphorylating CREB, also phosphorylates HDAC5.
Figure 2: Psychostimulant-induced signaling events - ^ Broussard JI (January 2012). "Co-transmission of dopamine and glutamate". J. Gen. Physiol. 139 (1): 93–96. doi:10.1085/jgp.201110659. PMC 3250102. PMID 22200950.
Coincident and convergent input often induces plasticity on a postsynaptic neuron. The NAc integrates processed information about the environment from basolateral amygdala, hippocampus, and prefrontal cortex (PFC), as well as projections from midbrain dopamine neurons. Previous studies have demonstrated how dopamine modulates this integrative process. For example, high frequency stimulation potentiates hippocampal inputs to the NAc while simultaneously depressing PFC synapses (Goto and Grace, 2005). The converse was also shown to be true; stimulation at PFC potentiates PFC–NAc synapses but depresses hippocampal–NAc synapses. In light of the new functional evidence of midbrain dopamine/glutamate co-transmission (references above), new experiments of NAc function will have to test whether midbrain glutamatergic inputs bias or filter either limbic or cortical inputs to guide goal-directed behavior.
- ^ Kanehisa Laboratories (10 October 2014). "Amphetamine – Homo sapiens (human)". KEGG Pathway. Retrieved 31 October 2014.
Most addictive drugs increase extracellular concentrations of dopamine (DA) in nucleus accumbens (NAc) and medial prefrontal cortex (mPFC), projection areas of mesocorticolimbic DA neurons and key components of the "brain reward circuit". Amphetamine achieves this elevation in extracellular levels of DA by promoting efflux from synaptic terminals. ... Chronic exposure to amphetamine induces a unique transcription factor delta FosB, which plays an essential role in long-term adaptive changes in the brain.
- ^ Cadet JL, Brannock C, Jayanthi S, Krasnova IN (2015). "Transcriptional and epigenetic substrates of methamphetamine addiction and withdrawal: evidence from a long-access self-administration model in the rat". Mol. Neurobiol. 51 (2): 696–717. doi:10.1007/s12035-014-8776-8. PMC 4359351. PMID 24939695.
Figure 1
{{cite journal}}: External link in|quote= - ^ أ ب ت Robison AJ, Nestler EJ (November 2011). "Transcriptional and epigenetic mechanisms of addiction". Nat. Rev. Neurosci. 12 (11): 623–637. doi:10.1038/nrn3111. PMC 3272277. PMID 21989194.
ΔFosB serves as one of the master control proteins governing this structural plasticity. ... ΔFosB also represses G9a expression, leading to reduced repressive histone methylation at the cdk5 gene. The net result is gene activation and increased CDK5 expression. ... In contrast, ΔFosB binds to the c-fos gene and recruits several co-repressors, including HDAC1 (histone deacetylase 1) and SIRT 1 (sirtuin 1). ... The net result is c-fos gene repression.
Figure 4: Epigenetic basis of drug regulation of gene expression - ^ أ ب ت Nestler EJ (December 2012). "Transcriptional mechanisms of drug addiction". Clin. Psychopharmacol. Neurosci. 10 (3): 136–143. doi:10.9758/cpn.2012.10.3.136. PMC 3569166. PMID 23430970.
The 35-37 kD ΔFosB isoforms accumulate with chronic drug exposure due to their extraordinarily long half-lives. ... As a result of its stability, the ΔFosB protein persists in neurons for at least several weeks after cessation of drug exposure. ... ΔFosB overexpression in nucleus accumbens induces NFκB ... In contrast, the ability of ΔFosB to repress the c-Fos gene occurs in concert with the recruitment of a histone deacetylase and presumably several other repressive proteins such as a repressive histone methyltransferase
- ^ Nestler EJ (October 2008). "Review. Transcriptional mechanisms of addiction: role of DeltaFosB". Philos. Trans. R. Soc. Lond., B, Biol. Sci. 363 (1507): 3245–3255. doi:10.1098/rstb.2008.0067. PMC 2607320. PMID 18640924.
Recent evidence has shown that ΔFosB also represses the c-fos gene that helps create the molecular switch—from the induction of several short-lived Fos family proteins after acute drug exposure to the predominant accumulation of ΔFosB after chronic drug exposure
- ^ Kanehisa Laboratories (10 October 2014). "Amphetamine – Homo sapiens (human)". KEGG Pathway. Retrieved 31 October 2014.
- ^ أ ب ت ث ج ح Nechifor M (March 2008). "Magnesium in drug dependences". Magnesium Research. 21 (1): 5–15. doi:10.1684/mrh.2008.0124 (inactive 31 January 2024). PMID 18557129.
{{cite journal}}: CS1 maint: DOI inactive as of يناير 2024 (link) - ^ أ ب ت ث ج Ruffle JK (November 2014). "Molecular neurobiology of addiction: what's all the (Δ)FosB about?". The American Journal of Drug and Alcohol Abuse. 40 (6): 428–437. doi:10.3109/00952990.2014.933840. PMID 25083822. S2CID 19157711.
ΔFosB is an essential transcription factor implicated in the molecular and behavioral pathways of addiction following repeated drug exposure.
- ^ أ ب ت ث ج ح خ د ذ ر ز Robison AJ, Nestler EJ (November 2011). "Transcriptional and epigenetic mechanisms of addiction". Nature Reviews Neuroscience. 12 (11): 623–637. doi:10.1038/nrn3111. PMC 3272277. PMID 21989194.
ΔFosB has been linked directly to several addiction-related behaviors ... Importantly, genetic or viral overexpression of ΔJunD, a dominant negative mutant of JunD which antagonizes ΔFosB- and other AP-1-mediated transcriptional activity, in the NAc or OFC blocks these key effects of drug exposure14,22–24. This indicates that ΔFosB is both necessary and sufficient for many of the changes wrought in the brain by chronic drug exposure. ΔFosB is also induced in D1-type NAc MSNs by chronic consumption of several natural rewards, including sucrose, high fat food, sex, wheel running, where it promotes that consumption14,26–30. This implicates ΔFosB in the regulation of natural rewards under normal conditions and perhaps during pathological addictive-like states. ... ΔFosB serves as one of the master control proteins governing this structural plasticity.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف ق ك Olsen CM (December 2011). "Natural rewards, neuroplasticity, and non-drug addictions". Neuropharmacology. 61 (7): 1109–1122. doi:10.1016/j.neuropharm.2011.03.010. PMC 3139704. PMID 21459101.
Similar to environmental enrichment, studies have found that exercise reduces self-administration and relapse to drugs of abuse (Cosgrove et al., 2002; Zlebnik et al., 2010). There is also some evidence that these preclinical findings translate to human populations, as exercise reduces withdrawal symptoms and relapse in abstinent smokers (Daniel et al., 2006; Prochaska et al., 2008), and one drug recovery program has seen success in participants that train for and compete in a marathon as part of the program (Butler, 2005). ... In humans, the role of dopamine signaling in incentive-sensitization processes has recently been highlighted by the observation of a dopamine dysregulation syndrome in some patients taking dopaminergic drugs. This syndrome is characterized by a medication-induced increase in (or compulsive) engagement in non-drug rewards such as gambling, shopping, or sex (Evans et al., 2006; Aiken, 2007; Lader, 2008).
- ^ أ ب ت ث Lynch WJ, Peterson AB, Sanchez V, Abel J, Smith MA (September 2013). "Exercise as a novel treatment for drug addiction: a neurobiological and stage-dependent hypothesis". Neuroscience & Biobehavioral Reviews. 37 (8): 1622–1644. doi:10.1016/j.neubiorev.2013.06.011. PMC 3788047. PMID 23806439.
These findings suggest that exercise may "magnitude"-dependently prevent the development of an addicted phenotype possibly by blocking/reversing behavioral and neuroadaptive changes that develop during and following extended access to the drug. ... Exercise has been proposed as a treatment for drug addiction that may reduce drug craving and risk of relapse. Although few clinical studies have investigated the efficacy of exercise for preventing relapse, the few studies that have been conducted generally report a reduction in drug craving and better treatment outcomes ... Taken together, these data suggest that the potential benefits of exercise during relapse, particularly for relapse to psychostimulants, may be mediated via chromatin remodeling and possibly lead to greater treatment outcomes.
- ^ أ ب ت Zhou Y, Zhao M, Zhou C, Li R (July 2015). "Sex differences in drug addiction and response to exercise intervention: From human to animal studies". Frontiers in Neuroendocrinology. 40: 24–41. doi:10.1016/j.yfrne.2015.07.001. PMC 4712120. PMID 26182835.
Collectively, these findings demonstrate that exercise may serve as a substitute or competition for drug abuse by changing ΔFosB or cFos immunoreactivity in the reward system to protect against later or previous drug use. ... The postulate that exercise serves as an ideal intervention for drug addiction has been widely recognized and used in human and animal rehabilitation.
- ^ أ ب ت Linke SE, Ussher M (January 2015). "Exercise-based treatments for substance use disorders: evidence, theory, and practicality". The American Journal of Drug and Alcohol Abuse. 41 (1): 7–15. doi:10.3109/00952990.2014.976708. PMC 4831948. PMID 25397661.
The limited research conducted suggests that exercise may be an effective adjunctive treatment for SUDs. In contrast to the scarce intervention trials to date, a relative abundance of literature on the theoretical and practical reasons supporting the investigation of this topic has been published. ... numerous theoretical and practical reasons support exercise-based treatments for SUDs, including psychological, behavioral, neurobiological, nearly universal safety profile, and overall positive health effects.
- ^ Hyman SE, Malenka RC, Nestler EJ (July 2006). "Neural mechanisms of addiction: the role of reward-related learning and memory" (PDF). Annual Review of Neuroscience. 29: 565–598. doi:10.1146/annurev.neuro.29.051605.113009. PMID 16776597. S2CID 15139406. Archived from the original (PDF) on 2018-09-19.
- ^ أ ب ت ث ج Steiner H, Van Waes V (January 2013). "Addiction-related gene regulation: risks of exposure to cognitive enhancers vs. other psychostimulants". Progress in Neurobiology. 100: 60–80. doi:10.1016/j.pneurobio.2012.10.001. PMC 3525776. PMID 23085425.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 4: Signal Transduction in the Brain". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, US: McGraw-Hill Medical. p. 94. ISBN 9780071481274.
- ^ Kanehisa Laboratories (29 October 2014). "Alcoholism – Homo sapiens (human)". KEGG Pathway. Retrieved 31 October 2014.
- ^ Kim Y, Teylan MA, Baron M, Sands A, Nairn AC, Greengard P (February 2009). "Methylphenidate-induced dendritic spine formation and DeltaFosB expression in nucleus accumbens". Proceedings of the National Academy of Sciences. 106 (8): 2915–2920. Bibcode:2009PNAS..106.2915K. doi:10.1073/pnas.0813179106. PMC 2650365. PMID 19202072.
- ^ أ ب Nestler EJ (January 2014). "Epigenetic mechanisms of drug addiction". Neuropharmacology. 76 (Pt B): 259–268. doi:10.1016/j.neuropharm.2013.04.004. PMC 3766384. PMID 23643695.
- ^ أ ب Biliński P, Wojtyła A, Kapka-Skrzypczak L, Chwedorowicz R, Cyranka M, Studziński T (2012). "Epigenetic regulation in drug addiction". Annals of Agricultural and Environmental Medicine. 19 (3): 491–496. PMID 23020045.
- ^ Kennedy PJ, Feng J, Robison AJ, Maze I, Badimon A, Mouzon E, et al. (April 2013). "Class I HDAC inhibition blocks cocaine-induced plasticity by targeted changes in histone methylation". Nature Neuroscience. 16 (4): 434–440. doi:10.1038/nn.3354. PMC 3609040. PMID 23475113.
- ^ Whalley K (December 2014). "Psychiatric disorders: a feat of epigenetic engineering". Nature Reviews. Neuroscience. 15 (12): 768–769. doi:10.1038/nrn3869. PMID 25409693. S2CID 11513288.
- ^ أ ب Blum K, Werner T, Carnes S, Carnes P, Bowirrat A, Giordano J, et al. (March 2012). "Sex, drugs, and rock 'n' roll: hypothesizing common mesolimbic activation as a function of reward gene polymorphisms". Journal of Psychoactive Drugs. 44 (1): 38–55. doi:10.1080/02791072.2012.662112. PMC 4040958. PMID 22641964.
It has been found that deltaFosB gene in the NAc is critical for reinforcing effects of sexual reward. Pitchers and colleagues (2010) reported that sexual experience was shown to cause DeltaFosB accumulation in several limbic brain regions including the NAc, medial pre-frontal cortex, VTA, caudate, and putamen, but not the medial preoptic nucleus. ... these findings support a critical role for DeltaFosB expression in the NAc in the reinforcing effects of sexual behavior and sexual experience-induced facilitation of sexual performance. ... both drug addiction and sexual addiction represent pathological forms of neuroplasticity along with the emergence of aberrant behaviors involving a cascade of neurochemical changes mainly in the brain's rewarding circuitry.
- ^ Pitchers KK, Vialou V, Nestler EJ, Laviolette SR, Lehman MN, Coolen LM (February 2013). "Natural and drug rewards act on common neural plasticity mechanisms with ΔFosB as a key mediator". The Journal of Neuroscience. 33 (8): 3434–3442. doi:10.1523/JNEUROSCI.4881-12.2013. PMC 3865508. PMID 23426671.
- ^ Beloate LN, Weems PW, Casey GR, Webb IC, Coolen LM (February 2016). "Nucleus accumbens NMDA receptor activation regulates amphetamine cross-sensitization and deltaFosB expression following sexual experience in male rats". Neuropharmacology. 101: 154–164. doi:10.1016/j.neuropharm.2015.09.023. PMID 26391065. S2CID 25317397.
- ^ Malenka RC, Nestler EJ, Hyman SE, Holtzman DM (2015). "Chapter 16: Reinforcement and Addictive Disorders". Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (3rd ed.). New York: McGraw-Hill Medical. ISBN 9780071827706.
Pharmacologic treatment for psychostimulant addiction is generally unsatisfactory. As previously discussed, cessation of cocaine use and the use of other psychostimulants in dependent individuals does not produce a physical withdrawal syndrome but may produce dysphoria, anhedonia, and an intense desire to reinitiate drug use.
- ^ أ ب ت ث Chan B, Freeman M, Kondo K, Ayers C, Montgomery J, Paynter R, et al. (December 2019). "Pharmacotherapy for methamphetamine/amphetamine use disorder-a systematic review and meta-analysis". Addiction. 114 (12): 2122–2136. doi:10.1111/add.14755. PMID 31328345. S2CID 198136436.
- ^ Stoops WW, Rush CR (May 2014). "Combination pharmacotherapies for stimulant use disorder: a review of clinical findings and recommendations for future research". Expert Review of Clinical Pharmacology. 7 (3): 363–374. doi:10.1586/17512433.2014.909283. PMC 4017926. PMID 24716825.
Despite concerted efforts to identify a pharmacotherapy for managing stimulant use disorders, no widely effective medications have been approved.
- ^ أ ب Jing L, Li JX (August 2015). "Trace amine-associated receptor 1: A promising target for the treatment of psychostimulant addiction". European Journal of Pharmacology. 761: 345–352. doi:10.1016/j.ejphar.2015.06.019. PMC 4532615. PMID 26092759.
Existing data provided robust preclinical evidence supporting the development of TAAR1 agonists as potential treatment for psychostimulant abuse and addiction.
- ^ أ ب Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 5: Excitatory and Inhibitory Amino Acids". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, US: McGraw-Hill Medical. pp. 124–125. ISBN 9780071481274.
- ^ أ ب ت Carroll ME, Smethells JR (February 2016). "Sex Differences in Behavioral Dyscontrol: Role in Drug Addiction and Novel Treatments". Frontiers in Psychiatry. 6: 175. doi:10.3389/fpsyt.2015.00175. PMC 4745113. PMID 26903885.
Physical Exercise
There is accelerating evidence that physical exercise is a useful treatment for preventing and reducing drug addiction ... In some individuals, exercise has its own rewarding effects, and a behavioral economic interaction may occur, such that physical and social rewards of exercise can substitute for the rewarding effects of drug abuse. ... The value of this form of treatment for drug addiction in laboratory animals and humans is that exercise, if it can substitute for the rewarding effects of drugs, could be self-maintained over an extended period of time. Work to date in [laboratory animals and humans] regarding exercise as a treatment for drug addiction supports this hypothesis. ... Animal and human research on physical exercise as a treatment for stimulant addiction indicates that this is one of the most promising treatments on the horizon. - ^ Perez-Mana C, Castells X, Torrens M, Capella D, Farre M (September 2013). "Efficacy of psychostimulant drugs for amphetamine abuse or dependence". Cochrane Database of Systematic Reviews. 9 (9): CD009695. doi:10.1002/14651858.CD009695.pub2. PMID 23996457.
- ^ "Amphetamines: Drug Use and Abuse". Merck Manual Home Edition. Merck. February 2003. Archived from the original on 17 February 2007. Retrieved 28 February 2007.
- ^ أ ب ت ث Shoptaw SJ, Kao U, Heinzerling K, Ling W (April 2009). Shoptaw SJ (ed.). "Treatment for amphetamine withdrawal". Cochrane Database of Systematic Reviews. 2009 (2): CD003021. doi:10.1002/14651858.CD003021.pub2. PMC 7138250. PMID 19370579.
The prevalence of this withdrawal syndrome is extremely common (Cantwell 1998; Gossop 1982) with 87.6% of 647 individuals with amphetamine dependence reporting six or more signs of amphetamine withdrawal listed in the DSM when the drug is not available (Schuckit 1999) ... The severity of withdrawal symptoms is greater in amphetamine dependent individuals who are older and who have more extensive amphetamine use disorders (McGregor 2005). Withdrawal symptoms typically present within 24 hours of the last use of amphetamine, with a withdrawal syndrome involving two general phases that can last 3 weeks or more. The first phase of this syndrome is the initial "crash" that resolves within about a week (Gossop 1982;McGregor 2005) ...
- ^ أ ب Spiller HA, Hays HL, Aleguas A (June 2013). "Overdose of drugs for attention-deficit hyperactivity disorder: clinical presentation, mechanisms of toxicity, and management". CNS Drugs. 27 (7): 531–543. doi:10.1007/s40263-013-0084-8. PMID 23757186. S2CID 40931380.
Amphetamine, dextroamphetamine, and methylphenidate act as substrates for the cellular monoamine transporter, especially the dopamine transporter (DAT) and less so the norepinephrine (NET) and serotonin transporter. The mechanism of toxicity is primarily related to excessive extracellular dopamine, norepinephrine, and serotonin.
- ^ Collaborators (2015). "Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013". The Lancet. 385 (9963): 117–171. doi:10.1016/S0140-6736(14)61682-2. hdl:11655/15525. PMC 4340604. PMID 25530442.
Amphetamine use disorders ... 3,788 (3,425–4,145)
- ^ Albertson TE (2011). "Amphetamines". In Olson KR, Anderson IB, Benowitz NL, Blanc PD, Kearney TE, Kim-Katz SY, Wu AH (eds.). Poisoning & Drug Overdose (6th ed.). New York: McGraw-Hill Medical. pp. 77–79. ISBN 9780071668330.
- ^ Advokat C (July 2007). "Update on amphetamine neurotoxicity and its relevance to the treatment of ADHD". Journal of Attention Disorders. 11 (1): 8–16. doi:10.1177/1087054706295605. PMID 17606768. S2CID 7582744.
- ^ أ ب ت ث Bowyer JF, Hanig JP (November 2014). "Amphetamine- and methamphetamine-induced hyperthermia: Implications of the effects produced in brain vasculature and peripheral organs to forebrain neurotoxicity". Temperature. 1 (3): 172–182. doi:10.4161/23328940.2014.982049. PMC 5008711. PMID 27626044.
Hyperthermia alone does not produce amphetamine-like neurotoxicity but AMPH and METH exposures that do not produce hyperthermia (≥40 °C) are minimally neurotoxic. Hyperthermia likely enhances AMPH and METH neurotoxicity directly through disruption of protein function, ion channels and enhanced ROS production. ... The hyperthermia and the hypertension produced by high doses amphetamines are a primary cause of transient breakdowns in the blood-brain barrier (BBB) resulting in concomitant regional neurodegeneration and neuroinflammation in laboratory animals. ... In animal models that evaluate the neurotoxicity of AMPH and METH, it is quite clear that hyperthermia is one of the essential components necessary for the production of histological signs of dopamine terminal damage and neurodegeneration in cortex, striatum, thalamus and hippocampus.
- ^ "Amphetamine". United States National Library of Medicine – Toxicology Data Network. Hazardous Substances Data Bank. Archived from the original on 2 October 2017. Retrieved 2 October 2017.
Direct toxic damage to vessels seems unlikely because of the dilution that occurs before the drug reaches the cerebral circulation.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 15: Reinforcement and addictive disorders". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, US: McGraw-Hill Medical. p. 370. ISBN 9780071481274.
Unlike cocaine and amphetamine, methamphetamine is directly toxic to midbrain dopamine neurons.
- ^ Sulzer D, Zecca L (February 2000). "Intraneuronal dopamine-quinone synthesis: a review". Neurotoxicity Research. 1 (3): 181–195. doi:10.1007/BF03033289. PMID 12835101. S2CID 21892355.
- ^ Miyazaki I, Asanuma M (June 2008). "Dopaminergic neuron-specific oxidative stress caused by dopamine itself" (PDF). Acta Medica Okayama. 62 (3): 141–150. doi:10.18926/AMO/30942. PMID 18596830.
- ^ Hofmann FG (1983). A Handbook on Drug and Alcohol Abuse: The Biomedical Aspects (2nd ed.). New York, US: Oxford University Press. p. 329. ISBN 9780195030570.
- ^ Hasenhuetl PS, Bhat S, Freissmuth M, Sandtner W (March 2019). "Functional Selectivity and Partial Efficacy at the Monoamine Transporters: A Unified Model of Allosteric Modulation and Amphetamine-Induced Substrate Release". Molecular Pharmacology. 95 (3): 303–312. doi:10.1124/mol.118.114793. PMID 30567955. S2CID 58557130.
Although the monoamine transport cycle has been resolved in considerable detail, kinetic knowledge on the molecular actions of synthetic allosteric modulators is still scarce. Fortunately, the DAT catalytic cycle is allosterically modulated by an endogenous ligand (namely, Zn2+; Norregaard et al., 1998). It is worth consulting Zn2+ as an instructive example, because its action on the DAT catalytic cycle has been deciphered to a large extent ... Zn+ binding stabilizes the outward-facing conformation of DAT ... This potentiates both the forward-transport mode (i.e., DA uptake; Li et al., 2015) and the substrate-exchange mode (i.e., amphetamine-induced DA release; Meinild et al., 2004; Li et al., 2015). Importantly, the potentiating effect on substrate uptake is only evident when internal Na+ concentrations are low ... If internal Na+ concentrations rise during the experiment, the substrate-exchange mode dominates and the net effect of Zn2+ on uptake is inhibitory. Conversely, Zn2+ accelerates amphetamine-induced substrate release via DAT. ... t is important to emphasize that Zn2+ has been shown to reduce dopamine uptake under conditions that favor intracellular Na+ accumulation
—Fig. 3. Functional selectivity by conformational selection. - ^ Krause J (April 2008). "SPECT and PET of the dopamine transporter in attention-deficit/hyperactivity disorder". Expert Review of Neurotherapeutics. 8 (4): 611–625. doi:10.1586/14737175.8.4.611. PMID 18416663. S2CID 24589993.
Zinc binds at ... extracellular sites of the DAT [103], serving as a DAT inhibitor. In this context, controlled double-blind studies in children are of interest, which showed positive effects of zinc [supplementation] on symptoms of ADHD [105,106]. It should be stated that at this time [supplementation] with zinc is not integrated in any ADHD treatment algorithm.
- ^ أ ب Scholze P, Nørregaard L, Singer EA, Freissmuth M, Gether U, Sitte HH (June 2002). "The role of zinc ions in reverse transport mediated by monoamine transporters". Journal of Biological Chemistry. 277 (24): 21505–21513. doi:10.1074/jbc.M112265200. PMID 11940571. S2CID 10521850.
The human dopamine transporter (hDAT) contains an endogenous high affinity Zn2+ binding site with three coordinating residues on its extracellular face (His193, His375, and Glu396). ... Although Zn2+ inhibited uptake, Zn2+ facilitated [3H]MPP+ release induced by amphetamine, MPP+, or K+-induced depolarization specifically at hDAT but not at the human serotonin and the norepinephrine transporter (hNET). ... Surprisingly, this amphetamine-elicited efflux was markedly enhanced, rather than inhibited, by the addition of 10 μM Zn2+ to the superfusion buffer (Fig. 2 A, open squares). ... The concentrations of Zn2+ shown in this study, required for the stimulation of dopamine release (as well as inhibition of uptake), covered this physiologically relevant range, with maximum stimulation occurring at 3–30 μM. ... Thus, when Zn2+ is co-released with glutamate, it may greatly augment the efflux of dopamine.
- ^ Kahlig KM, Lute BJ, Wei Y, Loland CJ, Gether U, Javitch JA, et al. (August 2006). "Regulation of dopamine transporter trafficking by intracellular amphetamine". Molecular Pharmacology. 70 (2): 542–548. doi:10.1124/mol.106.023952. PMID 16684900. S2CID 10317113.
Coadministration of Zn(2+) and AMPH consistently reduced WT-hDAT trafficking
- ^ Scassellati C, Bonvicini C, Faraone SV, Gennarelli M (October 2012). "Biomarkers and attention-deficit/hyperactivity disorder: a systematic review and meta-analyses". Journal of the American Academy of Child & Adolescent Psychiatry. 51 (10): 1003–1019.e20. doi:10.1016/j.jaac.2012.08.015. PMID 23021477.
With regard to zinc supplementation, a placebo controlled trial reported that doses up to 30 mg/day of zinc were safe for at least 8 weeks, but the clinical effect was equivocal except for the finding of a 37% reduction in amphetamine optimal dose with 30 mg per day of zinc.110
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص Eiden LE, Weihe E (January 2011). "VMAT2: a dynamic regulator of brain monoaminergic neuronal function interacting with drugs of abuse". Annals of the New York Academy of Sciences. 1216 (1): 86–98. doi:10.1111/j.1749-6632.2010.05906.x. PMC 4183197. PMID 21272013.
VMAT2 is the CNS vesicular transporter for not only the biogenic amines DA, NE, EPI, 5-HT, and HIS, but likely also for the trace amines TYR, PEA, and thyronamine (THYR) ... [Trace aminergic] neurons in mammalian CNS would be identifiable as neurons expressing VMAT2 for storage, and the biosynthetic enzyme aromatic amino acid decarboxylase (AADC). ... AMPH release of DA from synapses requires both an action at VMAT2 to release DA to the cytoplasm and a concerted release of DA from the cytoplasm via "reverse transport" through DAT.
- ^ أ ب ت ث Sulzer D, Cragg SJ, Rice ME (August 2016). "Striatal dopamine neurotransmission: regulation of release and uptake". Basal Ganglia. 6 (3): 123–148. doi:10.1016/j.baga.2016.02.001. PMC 4850498. PMID 27141430.
Despite the challenges in determining synaptic vesicle pH, the proton gradient across the vesicle membrane is of fundamental importance for its function. Exposure of isolated catecholamine vesicles to protonophores collapses the pH gradient and rapidly redistributes transmitter from inside to outside the vesicle. ... Amphetamine and its derivatives like methamphetamine are weak base compounds that are the only widely used class of drugs known to elicit transmitter release by a non-exocytic mechanism. As substrates for both DAT and VMAT, amphetamines can be taken up to the cytosol and then sequestered in vesicles, where they act to collapse the vesicular pH gradient.
- ^ أ ب Ledonne A, Berretta N, Davoli A, Rizzo GR, Bernardi G, Mercuri NB (July 2011). "Electrophysiological effects of trace amines on mesencephalic dopaminergic neurons". Frontiers in Systems Neuroscience. 5: 56. doi:10.3389/fnsys.2011.00056. PMC 3131148. PMID 21772817.
Three important new aspects of TAs action have recently emerged: (a) inhibition of firing due to increased release of dopamine; (b) reduction of D2 and GABAB receptor-mediated inhibitory responses (excitatory effects due to disinhibition); and (c) a direct TA1 receptor-mediated activation of GIRK channels which produce cell membrane hyperpolarization.
- ^ أ ب "TAAR1". GenAtlas. University of Paris. 28 January 2012. Retrieved 29 May 2014.
• tonically activates inwardly rectifying K(+) channels, which reduces the basal firing frequency of dopamine (DA) neurons of the ventral tegmental area (VTA)
- ^ أ ب ت ث ج ح Underhill SM, Wheeler DS, Li M, Watts SD, Ingram SL, Amara SG (July 2014). "Amphetamine modulates excitatory neurotransmission through endocytosis of the glutamate transporter EAAT3 in dopamine neurons". Neuron. 83 (2): 404–416. doi:10.1016/j.neuron.2014.05.043. PMC 4159050. PMID 25033183.
AMPH also increases intracellular calcium (Gnegy et al., 2004) that is associated with calmodulin/CamKII activation (Wei et al., 2007) and modulation and trafficking of the DAT (Fog et al., 2006; Sakrikar et al., 2012). ... For example, AMPH increases extracellular glutamate in various brain regions including the striatum, VTA and NAc (Del Arco et al., 1999; Kim et al., 1981; Mora and Porras, 1993; Xue et al., 1996), but it has not been established whether this change can be explained by increased synaptic release or by reduced clearance of glutamate. ... DHK-sensitive, EAAT2 uptake was not altered by AMPH (Figure 1A). The remaining glutamate transport in these midbrain cultures is likely mediated by EAAT3 and this component was significantly decreased by AMPH
- ^ أ ب Vaughan RA, Foster JD (September 2013). "Mechanisms of dopamine transporter regulation in normal and disease states". Trends in Pharmacological Sciences. 34 (9): 489–496. doi:10.1016/j.tips.2013.07.005. PMC 3831354. PMID 23968642.
AMPH and METH also stimulate DA efflux, which is thought to be a crucial element in their addictive properties [80], although the mechanisms do not appear to be identical for each drug [81]. These processes are PKCβ– and CaMK–dependent [72, 82], and PKCβ knock-out mice display decreased AMPH-induced efflux that correlates with reduced AMPH-induced locomotion [72].
- ^ أ ب Maguire JJ, Davenport AP (2 December 2014). "TA1 receptor". IUPHAR database. International Union of Basic and Clinical Pharmacology. Archived from the original on 29 June 2015. Retrieved 8 December 2014.
- ^ Borowsky B, Adham N, Jones KA, Raddatz R, Artymyshyn R, Ogozalek KL, et al. (July 2001). "Trace amines: identification of a family of mammalian G protein-coupled receptors". Proceedings of the National Academy of Sciences. 98 (16): 8966–8971. Bibcode:2001PNAS...98.8966B. doi:10.1073/pnas.151105198. PMC 55357. PMID 11459929.
- ^ أ ب "SLC18 family of vesicular amine transporters". IUPHAR database. International Union of Basic and Clinical Pharmacology. Retrieved 13 November 2015.
- ^ أ ب ت ث "SLC1A1 solute carrier family 1 (neuronal/epithelial high affinity glutamate transporter, system Xag), member 1 [ Homo sapiens (human) ]". NCBI Gene. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 11 November 2014.
Amphetamine modulates excitatory neurotransmission through endocytosis of the glutamate transporter EAAT3 in dopamine neurons. ... internalization of EAAT3 triggered by amphetamine increases glutamatergic signaling and thus contributes to the effects of amphetamine on neurotransmission.
- ^ Zhu HJ, Appel DI, Gründemann D, Markowitz JS (July 2010). "Interaction of organic cation transporter 3 (SLC22A3) and amphetamine". Journal of Neurochemistry. 114 (1): 142–149. doi:10.1111/j.1471-4159.2010.06738.x. PMC 3775896. PMID 20402963.
- ^ Rytting E, Audus KL (January 2005). "Novel organic cation transporter 2-mediated carnitine uptake in placental choriocarcinoma (BeWo) cells". Journal of Pharmacology and Experimental Therapeutics. 312 (1): 192–198. doi:10.1124/jpet.104.072363. PMID 15316089. S2CID 31465243.
- ^ Inazu M, Takeda H, Matsumiya T (August 2003). "[The role of glial monoamine transporters in the central nervous system]". Nihon Shinkei Seishin Yakurigaku Zasshi (in اليابانية). 23 (4): 171–178. PMID 13677912.
- ^ أ ب ت Vicentic A, Jones DC (February 2007). "The CART (cocaine- and amphetamine-regulated transcript) system in appetite and drug addiction". Journal of Pharmacology and Experimental Therapeutics. 320 (2): 499–506. doi:10.1124/jpet.105.091512. PMID 16840648. S2CID 14212763.
The physiological importance of CART was further substantiated in numerous human studies demonstrating a role of CART in both feeding and psychostimulant addiction. ... Colocalization studies also support a role for CART in the actions of psychostimulants. ... CART and DA receptor transcripts colocalize (Beaudry et al., 2004). Second, dopaminergic nerve terminals in the NAc synapse on CART-containing neurons (Koylu et al., 1999), hence providing the proximity required for neurotransmitter signaling. These studies suggest that DA plays a role in regulating CART gene expression possibly via the activation of CREB.
- ^ Zhang M, Han L, Xu Y (June 2012). "Roles of cocaine- and amphetamine-regulated transcript in the central nervous system". Clinical and Experimental Pharmacology and Physiology. 39 (6): 586–592. doi:10.1111/j.1440-1681.2011.05642.x. PMID 22077697. S2CID 25134612.
Recently, it was demonstrated that CART, as a neurotrophic peptide, had a cerebroprotective against focal ischaemic stroke and inhibited the neurotoxicity of β-amyloid protein, which focused attention on the role of CART in the central nervous system (CNS) and neurological diseases. ... The literature indicates that there are many factors, such as regulation of the immunological system and protection against energy failure, that may be involved in the cerebroprotection afforded by CART
- ^ أ ب Rogge G, Jones D, Hubert GW, Lin Y, Kuhar MJ (October 2008). "CART peptides: regulators of body weight, reward and other functions". Nature Reviews Neuroscience. 9 (10): 747–758. doi:10.1038/nrn2493. PMC 4418456. PMID 18802445.
Several studies on CART (cocaine- and amphetamine-regulated transcript)-peptide-induced cell signalling have demonstrated that CART peptides activate at least three signalling mechanisms. First, CART 55–102 inhibited voltage-gated L-type Ca2+ channels ...
- ^ Lin Y, Hall RA, Kuhar MJ (October 2011). "CART peptide stimulation of G protein-mediated signaling in differentiated PC12 cells: identification of PACAP 6–38 as a CART receptor antagonist". Neuropeptides. 45 (5): 351–358. doi:10.1016/j.npep.2011.07.006. PMC 3170513. PMID 21855138.
- ^ Monoamine oxidase (Homo sapiens). Technische Universität Braunschweig. BRENDA. 1 January 2014. Retrieved 4 May 2014.
- ^ أ ب ت "Targets". Amphetamine. University of Alberta: T3DB. Retrieved 24 February 2015.
- ^ أ ب Toll L, Berzetei-Gurske IP, Polgar WE, Brandt SR, Adapa ID, Rodriguez L, et al. (March 1998). "Standard binding and functional assays related to medications development division testing for potential cocaine and opiate narcotic treatment medications". NIDA Research Monograph. 178: 440–466. PMID 9686407.
- ^ أ ب Finnema SJ, Scheinin M, Shahid M, Lehto J, Borroni E, Bang-Andersen B, et al. (November 2015). "Application of cross-species PET imaging to assess neurotransmitter release in brain". Psychopharmacology. 232 (21–22): 4129–4157. doi:10.1007/s00213-015-3938-6. PMC 4600473. PMID 25921033.
More recently, Colasanti and colleagues reported that a pharmacologically induced elevation in endogenous opioid release reduced [11C]carfentanil binding in several regions of the human brain, including the basal ganglia, frontal cortex, and thalamus (Colasanti et al. 2012). Oral administration of d-amphetamine, 0.5 mg/kg, 3 h before [11C]carfentanil injection, reduced BPND values by 2–10%. The results were confirmed in another group of subjects (Mick et al. 2014). However, Guterstam and colleagues observed no change in [11C]carfentanil binding when d-amphetamine, 0.3 mg/kg, was administered intravenously directly before injection of [11C]carfentanil (Guterstam et al. 2013). It has been hypothesized that this discrepancy may be related to delayed increases in extracellular opioid peptide concentrations following amphetamine-evoked monoamine release (Colasanti et al. 2012; Mick et al. 2014).
- ^ أ ب Loseth GE, Ellingsen DM, Leknes S (December 2014). "State-dependent μ-opioid modulation of social motivation". Frontiers in Behavioral Neuroscience. 8: 430. doi:10.3389/fnbeh.2014.00430. PMC 4264475. PMID 25565999.
Similar MOR activation patterns were reported during positive mood induced by an amusing video clip (Koepp et al., 2009) and following amphetamine administration in humans (Colasanti et al., 2012).
- ^ أ ب Colasanti A, Searle GE, Long CJ, Hill SP, Reiley RR, Quelch D, et al. (September 2012). "Endogenous opioid release in the human brain reward system induced by acute amphetamine administration". Biological Psychiatry. 72 (5): 371–377. doi:10.1016/j.biopsych.2012.01.027. PMID 22386378. S2CID 18555036.
- ^ أ ب ت Gunne LM (2013). "Effects of Amphetamines in Humans". Drug Addiction II: Amphetamine, Psychotogen, and Marihuana Dependence. Berlin, Germany; Heidelberg, Germany: Springer. pp. 247–260. ISBN 9783642667091. Retrieved 4 December 2015.
- ^ أ ب ت Oswald LM, Wong DF, McCaul M, Zhou Y, Kuwabara H, Choi L, et al. (April 2005). "Relationships among ventral striatal dopamine release, cortisol secretion, and subjective responses to amphetamine". Neuropsychopharmacology. 30 (4): 821–832. doi:10.1038/sj.npp.1300667. PMID 15702139. S2CID 12302237.
Findings from several prior investigations have shown that plasma levels of glucocorticoids and ACTH are increased by acute administration of AMPH in both rodents and humans
- ^ أ ب ت ث ج ح خ د ذ ر Angeli A, Vaiano F, Mari F, Bertol E, Supuran CT (December 2017). "Psychoactive substances belonging to the amphetamine class potently activate brain carbonic anhydrase isoforms VA, VB, VII, and XII". Journal of Enzyme Inhibition and Medicinal Chemistry. 32 (1): 1253–1259. doi:10.1080/14756366.2017.1375485. PMC 6009978. PMID 28936885.
Here, we report the first such study, showing that amphetamine, methamphetamine, phentermine, mephentermine, and chlorphenteramine, potently activate several CA isoforms, some of which are highly abundant in the brain, where they play important functions connected to cognition and memory, among others26,27. ... We investigated psychotropic amines based on the phenethylamine scaffold, such as amphetamine 5, methamphetamine 6, phentermine 7, mephentermine 8, and the structurally diverse chlorphenteramine 9, for their activating effects on 11 CA isoforms of human origin ... The widespread hCA I and II, the secreted hCA VI, as well as the cytosolic hCA XIII and membrane-bound hCA IX and XIV were poorly activated by these amines, whereas the extracellular hCA IV, the mitochondrial enzymes hCA VA/VB, the cytosolic hCA VII, and the transmembrane isoform hCA XII were potently activated. Some of these enzymes (hCA VII, VA, VB, XII) are abundant in the brain, raising the possibility that some of the cognitive effects of such psychoactive substances might be related to the activation of these enzymes. ... CAAs started to be considered only recently for possible pharmacologic applications in memory/cognition therapy27. This work may bring new lights on the intricate relationship between CA activation by this type of compounds and the multitude of pharmacologic actions that they can elicit.
—Table 1: CA activation of isoforms hCA I, II, IV, VII, and XIII [5: amphetamine]
—Table 2: CA activation of isoforms hCA VA, VB, VI, IX, XII, and XIV [5: amphetamine] - ^ أ ب Lewin AH, Miller GM, Gilmour B (December 2011). "Trace amine-associated receptor 1 is a stereoselective binding site for compounds in the amphetamine class". Bioorganic & Medicinal Chemistry. 19 (23): 7044–7048. doi:10.1016/j.bmc.2011.10.007. PMC 3236098. PMID 22037049.
- ^ أ ب Maguire JJ, Parker WA, Foord SM, Bonner TI, Neubig RR, Davenport AP (March 2009). "International Union of Pharmacology. LXXII. Recommendations for trace amine receptor nomenclature". Pharmacological Reviews. 61 (1): 1–8. doi:10.1124/pr.109.001107. PMC 2830119. PMID 19325074.
- ^ Revel FG, Moreau JL, Gainetdinov RR, Bradaia A, Sotnikova TD, Mory R, et al. (May 2011). "TAAR1 activation modulates monoaminergic neurotransmission, preventing hyperdopaminergic and hypoglutamatergic activity". Proceedings of the National Academy of Sciences. 108 (20): 8485–8490. doi:10.1073/pnas.1103029108. PMC 3101002. PMID 21525407.
- ^ أ ب "Amphetamine: Biological activity". IUPHAR/BPS Guide to Pharmacology. International Union of Basic and Clinical Pharmacology. Retrieved 31 December 2019.
- ^ أ ب Bozdag M, Altamimi AA, Vullo D, Supuran CT, Carta F (2019). "State of the Art on Carbonic Anhydrase Modulators for Biomedical Purposes". Current Medicinal Chemistry. 26 (15): 2558–2573. doi:10.2174/0929867325666180622120625. PMID 29932025. S2CID 49345601.
CARBONIC ANHYDRASE INHIBITORS (CAIs). The design and development of CAIs represent the most prolific area within the CA research field. Since the introduction of CAIs in the clinical use in the 40', they still are the first choice for the treatment of edema [9], altitude sickness [9], glaucoma [7] and epilepsy [31]. ... CARBONIC ANHYDRASE ACTIVATORS (CAAs) ... The emerging class of CAAs has recently gained attraction as the enhancement of the kinetic properties in hCAs expressed in the CNS were proved in animal models to be beneficial for the treatment of both cognitive and memory impairments. Thus, CAAs have enormous potentiality in medicinal chemistry to be developed for the treatment of symptoms associated to aging, trauma or deterioration of the CNS tissues.
- ^ أ ب ت ث ج ح خ د ذ Ermer JC, Pennick M, Frick G (May 2016). "Lisdexamfetamine Dimesylate: Prodrug Delivery, Amphetamine Exposure and Duration of Efficacy". Clinical Drug Investigation. 36 (5): 341–356. doi:10.1007/s40261-015-0354-y. PMC 4823324. PMID 27021968.
- ^ أ ب ت ث ج ح خ "Vyvanse- lisdexamfetamine dimesylate capsule Vyvanse- lisdexamfetamine dimesylate tablet, chewable". DailyMed. Shire US Inc. 30 October 2019. Retrieved 22 December 2019. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "USVyvanselabel" معرف أكثر من مرة بمحتويات مختلفة. - ^ أ ب ت ث ج Dolder PC, Strajhar P, Vizeli P, Hammann F, Odermatt A, Liechti ME (2017). "Pharmacokinetics and Pharmacodynamics of Lisdexamfetamine Compared with D-Amphetamine in Healthy Subjects". Front Pharmacol. 8: 617. doi:10.3389/fphar.2017.00617. PMC 5594082. PMID 28936175.
Inactive lisdexamfetamine is completely (>98%) converted to its active metabolite D-amphetamine in the circulation (Pennick, 2010; Sharman and Pennick, 2014). When lisdexamfetamine is misused intranasally or intravenously, the pharmacokinetics are similar to oral use (Jasinski and Krishnan, 2009b; Ermer et al., 2011), and the subjective effects are not enhanced by parenteral administration in contrast to D-amphetamine (Lile et al., 2011) thus reducing the risk of parenteral misuse of lisdexamfetamine compared with D-amphetamine. Intravenous lisdexamfetamine use also produced significantly lower increases in "drug liking" and "stimulant effects" compared with D-amphetamine in intravenous substance users (Jasinski and Krishnan, 2009a).
- ^ "Compound Summary". p-Hydroxyamphetamine. PubChem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 15 October 2013.
- ^ "Compound Summary". p-Hydroxynorephedrine. PubChem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 15 October 2013.
- ^ "Compound Summary". Phenylpropanolamine. PubChem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 15 October 2013.
- ^ "Pharmacology and Biochemistry". Amphetamine. Pubchem Compound Database. United States National Library of Medicine – National Center for Biotechnology Information. Retrieved 12 October 2013.
- ^ أ ب ت ث ج ح ElRakaiby M, Dutilh BE, Rizkallah MR, Boleij A, Cole JN, Aziz RK (July 2014). "Pharmacomicrobiomics: the impact of human microbiome variations on systems pharmacology and personalized therapeutics". Omics. 18 (7): 402–414. doi:10.1089/omi.2014.0018. PMC 4086029. PMID 24785449.
The hundred trillion microbes and viruses residing in every human body, which outnumber human cells and contribute at least 100 times more genes than those encoded on the human genome (Ley et al., 2006), offer an immense accessory pool for inter-individual genetic variation that has been underestimated and largely unexplored (Savage, 1977; Medini et al., 2008; Minot et al., 2011; Wylie et al., 2012). ... Meanwhile, a wealth of literature has long been available about the biotransformation of xenobiotics, notably by gut bacteria (reviewed in Sousa et al., 2008; Rizkallah et al., 2010; Johnson et al., 2012; Haiser and Turnbaugh, 2013). This valuable information is predominantly about drug metabolism by unknown human-associated microbes; however, only a few cases of inter-individual microbiome variations have been documented [e.g., digoxin (Mathan et al., 1989) and acetaminophen (Clayton et al., 2009)].
- ^ أ ب ت Cho I, Blaser MJ (March 2012). "The human microbiome: at the interface of health and disease". Nature Reviews Genetics. 13 (4): 260–270. doi:10.1038/nrg3182. PMC 3418802. PMID 22411464.
The composition of the microbiome varies by anatomical site (Figure 1). The primary determinant of community composition is anatomical location: interpersonal variation is substantial23,24 and is higher than the temporal variability seen at most sites in a single individual25. ... How does the microbiome affect the pharmacology of medications? Can we "micro-type" people to improve pharmacokinetics and/or reduce toxicity? Can we manipulate the microbiome to improve pharmacokinetic stability?
- ^ Hutter T, Gimbert C, Bouchard F, Lapointe FJ (2015). "Being human is a gut feeling". Microbiome. 3: 9. doi:10.1186/s40168-015-0076-7. PMC 4359430. PMID 25774294.
Some metagenomic studies have suggested that less than 10% of the cells that comprise our bodies are Homo sapiens cells. The remaining 90% are bacterial cells. The description of this so-called human microbiome is of great interest and importance for several reasons. For one, it helps us redefine what a biological individual is. We suggest that a human individual is now best described as a super-individual in which a large number of different species (including Homo sapiens) coexist.
- ^ أ ب ت ث Kumar K, Dhoke GV, Sharma AK, Jaiswal SK, Sharma VK (January 2019). "Mechanistic elucidation of amphetamine metabolism by tyramine oxidase from human gut microbiota using molecular dynamics simulations". Journal of Cellular Biochemistry. 120 (7): 11206–11215. doi:10.1002/jcb.28396. PMID 30701587. S2CID 73413138.
Particularly in the case of the human gut, which harbors a large diversity of bacterial species, the differences in microbial composition can significantly alter the metabolic activity in the gut lumen.4 The differential metabolic activity due to the differences in gut microbial species has been recently linked with various metabolic disorders and diseases.5–12 In addition to the impact of gut microbial diversity or dysbiosis in various human diseases, there is an increasing amount of evidence which shows that the gut microbes can affect the bioavailability and efficacy of various orally administrated [ك] drug molecules through promiscuous enzymatic metabolism.13,14 ... The present study on the atomistic details of amphetamine binding and binding affinity to the tyramine oxidase along with the comparison with two natural substrates of this enzyme namely tyramine and phenylalanine provides strong evidence for the promiscuity-based metabolism of amphetamine by the tyramine oxidase enzyme of E. coli. The obtained results will be crucial in designing a surrogate molecule for amphetamine that can help either in improving the efficacy and bioavailability of the amphetamine drug via competitive inhibition or in redesigning the drug for better pharmacological effects. This study will also have useful clinical implications in reducing the gut microbiota caused variation in the drug response among different populations.
- ^ أ ب Khan MZ, Nawaz W (October 2016). "The emerging roles of human trace amines and human trace amine-associated receptors (hTAARs) in central nervous system". Biomedicine & Pharmacotherapy. 83: 439–449. doi:10.1016/j.biopha.2016.07.002. PMID 27424325.
- ^ أ ب ت ث ج Lindemann L, Hoener MC (May 2005). "A renaissance in trace amines inspired by a novel GPCR family". Trends in Pharmacological Sciences. 26 (5): 274–281. doi:10.1016/j.tips.2005.03.007. PMID 15860375.
- ^ "Determination That Delcobese (Amphetamine Adipate, Amphetamine Sulfate, Dextroamphetamine Adipate, Dextroamphetamine Sulfate) Tablets and Capsules Were Not Withdrawn From Sale for Reasons of Safety or Effectiveness". Federal Register. 2003-11-10. Retrieved 2020-01-03.
- ^ Amphetamine Hydrochloride. United States National Library of Medicine – National Center for Biotechnology Information. Pubchem Compound Database. Retrieved 8 November 2013.
- ^ Amphetamine Phosphate. United States National Library of Medicine – National Center for Biotechnology Information. Pubchem Compound Database. Retrieved 8 November 2013.
- ^ Cavallito J (23 August 1960). "Amphetamine Tannate. Patent Application No. 2,950,309" (PDF). United States Patent Office. Archived (PDF) from the original on 2022-10-09.
- ^ Brussee J, Jansen AC (May 1983). "A highly stereoselective synthesis of s(−)-[1,1'-binaphthalene]-2,2'-diol". Tetrahedron Letters. 24 (31): 3261–3262. doi:10.1016/S0040-4039(00)88151-4.
- ^ أ ب Schep LJ, Slaughter RJ, Beasley DM (August 2010). "The clinical toxicology of metamfetamine". Clinical Toxicology. 48 (7): 675–694. doi:10.3109/15563650.2010.516752. ISSN 1556-3650. PMID 20849327. S2CID 42588722.
- ^ Lillsunde P, Korte T (March 1991). "Determination of ring- and N-substituted amphetamines as heptafluorobutyryl derivatives". Forensic Science International. 49 (2): 205–213. doi:10.1016/0379-0738(91)90081-s. PMID 1855720.
- ^ أ ب ت ث "Historical overview of methamphetamine". Vermont Department of Health. Government of Vermont. Archived from the original on 5 October 2012. Retrieved 29 January 2012.
- ^ أ ب ت Allen A, Ely R (April 2009). "Review: Synthetic Methods for Amphetamine" (PDF). Crime Scene. Northwest Association of Forensic Scientists. 37 (2): 15–25. Retrieved 6 December 2014.
- ^ أ ب ت Allen A, Cantrell TS (August 1989). "Synthetic reductions in clandestine amphetamine and methamphetamine laboratories: A review". Forensic Science International. 42 (3): 183–199. doi:10.1016/0379-0738(89)90086-8.
- ^ أ ب ت ث "Recommended methods of the identification and analysis of amphetamine, methamphetamine, and their ring-substituted analogues in seized materials" (PDF). United Nations Office on Drugs and Crime. United Nations. 2006. pp. 9–12. Retrieved 14 October 2013.
- ^ Pollard CB, Young DC (May 1951). "The Mechanism of the Leuckart Reaction". The Journal of Organic Chemistry. 16 (5): 661–672. doi:10.1021/jo01145a001.
- ^ {{{1}}} patent {{{2}}}
- ^ أ ب Gray DL (2007). "Approved Treatments for Attention Deficit Hyperactivity Disorder: Amphetamine (Adderall), Methylphenidate (Ritalin), and Atomoxetine (Straterra)". In Johnson DS, Li JJ (eds.). The Art of Drug Synthesis. New York, US: Wiley-Interscience. p. 247. ISBN 9780471752158.
- ^ Patrick TM, McBee ET, Hass HB (June 1946). "Synthesis of arylpropylamines; from allyl chloride". Journal of the American Chemical Society. 68 (6): 1009–1011. doi:10.1021/ja01210a032. PMID 20985610.
- ^ Ritter JJ, Kalish J (December 1948). "A new reaction of nitriles; synthesis of t-carbinamines". Journal of the American Chemical Society. 70 (12): 4048–4050. doi:10.1021/ja01192a023. PMID 18105933.
- ^ Krimen LI, Cota DJ (March 2011). "The Ritter Reaction". Organic Reactions. Vol. 17. p. 216. doi:10.1002/0471264180.or017.03. ISBN 9780471264187.
- ^ {{{1}}} patent {{{2}}}
- ^ Collins M, Salouros H, Cawley AT, Robertson J, Heagney AC, Arenas-Queralt A (June 2010). "δ13C and δ2H isotope ratios in amphetamine synthesized from benzaldehyde and nitroethane". Rapid Communications in Mass Spectrometry. 24 (11): 1653–1658. doi:10.1002/rcm.4563. PMID 20486262.
- ^ Kraemer T, Maurer HH (August 1998). "Determination of amphetamine, methamphetamine and amphetamine-derived designer drugs or medicaments in blood and urine". Journal of Chromatography B. 713 (1): 163–187. doi:10.1016/S0378-4347(97)00515-X. PMID 9700558.
- ^ Kraemer T, Paul LD (August 2007). "Bioanalytical procedures for determination of drugs of abuse in blood". Analytical and Bioanalytical Chemistry. 388 (7): 1415–1435. doi:10.1007/s00216-007-1271-6. PMID 17468860. S2CID 32917584.
- ^ Goldberger BA, Cone EJ (July 1994). "Confirmatory tests for drugs in the workplace by gas chromatography-mass spectrometry". Journal of Chromatography A. 674 (1–2): 73–86. doi:10.1016/0021-9673(94)85218-9. PMID 8075776.
- ^ أ ب "Clinical Drug Testing in Primary Care" (PDF). University of Colorado Denver. Technical Assistance Publication Series 32. United States Department of Health and Human Services – Substance Abuse and Mental Health Services Administration. 2012. p. 55. Archived (PDF) from the original on 14 May 2018. Retrieved 31 October 2013.
A single dose of amphetamine or methamphetamine can be detected in the urine for approximately 24 hours, depending upon urine pH and individual metabolic differences. People who use chronically and at high doses may continue to have positive urine specimens for 2–4 days after last use (SAMHSA, 2010b).
- ^ أ ب ت ث ج Paul BD, Jemionek J, Lesser D, Jacobs A, Searles DA (September 2004). "Enantiomeric separation and quantitation of (±)-amphetamine, (±)-methamphetamine, (±)-MDA, (±)-MDMA, and (±)-MDEA in urine specimens by GC-EI-MS after derivatization with (R)-(−)- or (S)-(+)-α-methoxy-α-(trifluoromethyl)phenylacetyl chloride (MTPA)". Journal of Analytical Toxicology. 28 (6): 449–455. doi:10.1093/jat/28.6.449. PMID 15516295.
- ^ "Part 341 – cold, cough, allergy, bronchodilator, and antiasthmatic drug products for over-the-counter human use". Code of Federal Regulations Title 21: Subchapter D – Drugs for human use. United States Food and Drug Administration. 1 April 2019. Archived from the original on 25 December 2019. Retrieved 24 December 2019.
Topical nasal decongestants --(i) For products containing levmetamfetamine identified in 341.20(b)(1) when used in an inhalant dosage form. The product delivers in each 800 milliliters of air 0.04 to 0.150 milligrams of levmetamfetamine.
- ^ "Identification". Levomethamphetamine. United States National Library of Medicine – National Center for Biotechnology Information. Pubchem Compound Database. Retrieved 2 January 2014.
- ^ أ ب Verstraete AG, Heyden FV (August 2005). "Comparison of the sensitivity and specificity of six immunoassays for the detection of amphetamines in urine". Journal of Analytical Toxicology. 29 (5): 359–364. doi:10.1093/jat/29.5.359. PMID 16105261.
- ^ Baselt RC (2011). Disposition of Toxic Drugs and Chemicals in Man (9th ed.). Seal Beach, US: Biomedical Publications. pp. 85–88. ISBN 9780962652387.
- ^ أ ب Musshoff F (February 2000). "Illegal or legitimate use? Precursor compounds to amphetamine and methamphetamine". Drug Metabolism Reviews. 32 (1): 15–44. doi:10.1081/DMR-100100562. PMID 10711406. S2CID 20012024.
- ^ أ ب Cody JT (May 2002). "Precursor medications as a source of methamphetamine and/or amphetamine positive drug testing results". Journal of Occupational and Environmental Medicine. 44 (5): 435–450. doi:10.1097/00043764-200205000-00012. PMID 12024689. S2CID 44614179.
- ^ "Annual prevalence of use of drugs, by region and globally, 2016". World Drug Report 2018. United Nations Office on Drugs and Crime. 2018. Retrieved 7 July 2018.
- ^ Rassool GH (2009). Alcohol and Drug Misuse: A Handbook for Students and Health Professionals. London, England: Routledge. p. 113. ISBN 9780203871171.
- ^ أ ب Sulzer D, Sonders MS, Poulsen NW, Galli A (April 2005). "Mechanisms of neurotransmitter release by amphetamines: a review". Progress in Neurobiology. 75 (6): 406–433. doi:10.1016/j.pneurobio.2005.04.003. PMID 15955613. S2CID 2359509.
- ^ Rasmussen N (August 2011). "Medical science and the military: the Allies' use of amphetamine during World War II". Journal of Interdisciplinary History. 42 (2): 205–233. doi:10.1162/JINH_a_00212. PMID 22073434. S2CID 34332132.
- ^ Defalque RJ, Wright AJ (April 2011). "Methamphetamine for Hitler's Germany: 1937 to 1945". Bulletin of Anesthesia History. 29 (2): 21–24, 32. doi:10.1016/s1522-8649(11)50016-2. PMID 22849208.
- ^ "Controlled Substances Act". United States Food and Drug Administration. 11 June 2009. Archived from the original on 2 March 2017. Retrieved 4 November 2013.
- ^ "Controlled Substance Schedules". DEA Diversion Control Division. Retrieved 25 December 2019.
- ^ Gyenis A. "Forty Years of On the Road 1957–1997". wordsareimportant.com. DHARMA beat. Archived from the original on 14 February 2008. Retrieved 18 March 2008.
- ^ Wilson A (2008). "Mixing the Medicine: The unintended consequence of amphetamine control on the Northern Soul Scene" (PDF). Internet Journal of Criminology. Archived from the original (PDF) on 13 July 2011. Retrieved 25 May 2013.
- ^ Hill J (4 June 2004). "Paul Erdos, Mathematical Genius, Human (In That Order)" (PDF). Retrieved 2 November 2013.
- ^ أ ب ت Mohan J, ed. (June 2014). "World Drug Report 2014" (PDF). United Nations Office on Drugs and Crime. p. 3. Retrieved 18 August 2014.
- ^ "Statistical Bulletin 2018 − prevalence of drug use". European Monitoring Centre for Drugs and Drug Addiction. Retrieved 5 February 2019.
- ^ أ ب European Monitoring Centre for Drugs Drug Addiction (May 2014). European drug report 2014: Trends and developments. Lisbon, Portugal: European Monitoring Centre for Drugs and Drug Addiction. pp. 13, 24. doi:. ISSN 2314-9086. Archived from the original. You must specify the date the archive was made using the
|archivedate=parameter. http://www.emcdda.europa.eu/attachements.cfm/att_228272_EN_TDAT14001ENN.pdf. Retrieved on 18 August 2014. "1.2 million or 0.9% of young adults (15–34) used amphetamines in the last year" - ^ United Nations Office on Drugs and Crime (2007). Preventing Amphetamine-type Stimulant Use Among Young People: A Policy and Programming Guide (PDF). New York, US: United Nations. ISBN 9789211482232. Retrieved 11 November 2013.
- ^ "List of psychotropic substances under international control" (PDF). International Narcotics Control Board. United Nations. August 2003. Archived from the original (PDF) on 5 December 2005. Retrieved 19 November 2005.
- ^ "Importing or Bringing Medication into Japan for Personal Use". Japanese Ministry of Health, Labour and Welfare. 1 April 2004. Retrieved 3 November 2013.
- ^ "Controlled Drugs and Substances Act". Canadian Justice Laws Website. Government of Canada. Archived from the original on 22 November 2013. Retrieved 11 November 2013.
- ^ "Opiumwet". Government of the Netherlands. Retrieved 3 April 2015.
- ^ "Schedule 8". Poisons Standard. Australian Government Department of Health. October 2015. Retrieved 15 December 2015.
- ^ "Table of controlled Narcotic Drugs under the Thai Narcotics Act" (PDF). Thailand Food and Drug Administration. 22 May 2013. Archived from the original (PDF) on 8 March 2014. Retrieved 11 November 2013.
- ^ "Class A, B and C drugs". Home Office, Government of the United Kingdom. Archived from the original on 4 August 2007. Retrieved 23 July 2007.
- ^ أ ب "Adzenys XR-ODT- amphetamine tablet, orally disintegrating". DailyMed. Neos Therapeutics, Inc. 9 February 2018. Retrieved 22 December 2019.
ADZENYS XR-ODT (amphetamine extended-release orally disintegrating tablet) contains a 3 to 1 ratio of d- to l-amphetamine, a central nervous system stimulant.
- ^ "Mydayis- dextroamphetamine sulfate, dextroamphetamine saccharate, amphetamine aspartate monohydrate, and amphetamine sulfate capsule, extended release". DailyMed. Shire US Inc. 11 October 2019. Retrieved 22 December 2019.
- ^ "Drug Approval Package: Mydayis (mixed salts of a single-entity amphetamine product)". United States Food and Drug Administration. 6 June 2018. Retrieved 22 December 2019.
- ^ "Adzenys ER- amphetamine suspension, extended release". DailyMed. Neos Therapeutics, Inc. 8 December 2017. Retrieved 25 December 2019.
- ^ "Drug Approval Package: Adzenys XR-ODT (amphetamine)". United States Food and Drug Administration. Retrieved 22 December 2019.
- ^ "Evekeo". United States Food and Drug Administration. Retrieved 11 August 2015.
- ^ "Evekeo ODT- amphetamine sulfate tablet, orally disintegrating". DailyMed. Arbor Pharmaceuticals, LLC. 7 June 2019. Retrieved 25 December 2019.
- ^ "Zenzedi- dextroamphetamine sulfate tablet". DailyMed. Arbor Pharmaceuticals, LLC. 14 August 2019. Retrieved 22 December 2019.
- ^ "Drug Approval Package: Vyvanse (Lisdexamfetamine Dimesylate) NDA #021977". United States Food and Drug Administration. 24 December 1999. Retrieved 22 December 2019.
- ^ "Xelstrym- dextroamphetamine patch, extended release". DailyMed. 28 March 2023. Retrieved 3 May 2023.
- ^ "Molecular Weight Calculator". Lenntech. Retrieved 19 August 2015.
- ^ أ ب "Dextroamphetamine Sulfate USP". Mallinckrodt Pharmaceuticals. March 2014. Retrieved 19 August 2015.
- ^ أ ب "D-amphetamine sulfate". Tocris. 2015. Retrieved 19 August 2015.
- ^ أ ب "Amphetamine Sulfate USP". Mallinckrodt Pharmaceuticals. March 2014. Retrieved 19 August 2015.
- ^ "Dextroamphetamine Saccharate". Mallinckrodt Pharmaceuticals. March 2014. Retrieved 19 August 2015.
- ^ "Amphetamine Aspartate". Mallinckrodt Pharmaceuticals. March 2014. Retrieved 19 August 2015.
وصلات خارجية
- "Amphetamine". Drug Information Portal. United States National Library of Medicine.
- CID 5826 من PubChem – Dextroamphetamine
- CID 32893 من PubChem – Levoamphetamine
- Comparative Toxicogenomics Database entry: Amphetamine
- Comparative Toxicogenomics Database entry: CARTPT
- CS1 البرتغالية البرازيلية-language sources (pt-br)
- CS1 errors: empty citation
- CS1 maint: DOI inactive as of يناير 2024
- CS1 اليابانية-language sources (ja)
- Short description is different from Wikidata
- Template:drugs.com link with non-standard subpage
- ECHA InfoCard ID from Wikidata
- Infobox drug articles with non-default infobox title
- Infobox drug articles with contradicting parameter input
- Articles with hatnote templates targeting a nonexistent page
- PubChem ID (CID) not in Wikidata
- أمفيتامين
- 5-HT1A agonists
- مفقدات الشهية
- منشطات جنسية طبيعية
- Carbonic anhydrase activators
- أدوية تعمل على الجهاز القلبي الوعائي
- أدوية تعمل على الجهاز العصبي
- الأدوية في الرياضة
- Ergogenic aids
- مسببات الابتهاج
- Excitatory amino acid reuptake inhibitors
- اختراعات ألمانية
- خدار
- محسنات الذهن
- Norepinephrine-dopamine releasing agents
- فينيثيلامينات
- منبهات
- أمفيتامينات بديلة
- TAAR1 agonists
- علاج اضطراب قصور الإنتباه وفرط الحركة
- VMAT inhibitors
- مواد تحظرها الوكالة العالمية لمكافحة المنشطات
- Monoamine oxidase inhibitors