تحفيز


التحفيز Catalysis ( /kəˈtælᵻsᵻs/)، هو زيادة في معدل التفاعل الكيميائي بسبب مشاركة مادة إضافية تسمى المحفز[1] ( /ˈkætəlᵻst/)، وهي مادة كيميائية تضاف بكميات قليلة للتفاعل الكيميائي بهدف تسريعه دون أن تتغير خواصها الكيميائية[2] بمعنى أنها قادرة على أن تزيد سرعة التفاعل الكيمائي عن طريق خفض طاقة التفاعل أو تنشيطه دون أن يحدث بها تغيير كيميائي دائم.[3] يسمى الحفاز أيضا بالعامل المساعد والمحفز، وهو ذو أهمية في الكيمياء وعلم الأحياء. ويعرف بأنه قادر على تغيير معدل التفاعل تسريعه أو إباطئه دون أن يـُستهلك، أو يحدث به تغير كيميائي. والإنزيمات محفزات تنشط التفاعلات الحيوية.توفر المحفزات طرقا أخرى للتفاعل الكميائي تتميز بطاقة تنشيط منخفضة عن تلك التي يستهلكها التفاعل الغير محفز.
المنظور التقني
التفاعل المحفز هو:
ـ تفكك H2O2 بيروكسيد الهدروجين (الماء الأكسجيني) أكسيد المنغنيز MnO2 (IV)x.
ـ نترتة البنزن حمض الكبريت المركز. ـ اصطناع النشادر بعملية هابر الحديد.
ـ تحويل SO2 إلى SO3 في طريقة التماس في صناعة حمض الكبريت أكسيد الفانديوم V2O5 (V)X.
ـ هدرجة الرابطة المضاعفة النيكل.
المبادئ العامة للتحفيز
التحفيز وتنشيط التفاعل
وحتى يحدث التفاعل بين المتفاعلات لا يكفي اصطدامها بعضها ببعض فحسب، بل ينبغي إلى جانب ذلك أن تصطدم بحد أدنى من الطاقة يساوي أو يزيد على مقدار محدد يأخذ اسماً خاصاً هو طاقة تنشيط التفاعل Ea.
ويمكن تعيين طاقة التنشيط على مخطط توزع ماكسويل بولتزمان.
وهكذا فإن تلك الجسيمات الممثلة بالمساحة إلى يمين طاقة التنشيط هي فقط التي تتفاعل في الاصطدام. أما القسم الأعظم من الجسيمات فإنها لا تمتلك ما يكفي من الطاقة وسترتد بعد الاصطدام من دون تفاعل.
فلكي تزداد سرعة التفاعل يلزم العمل على زيادة عدد الاصطدامات الناجحة. وإحدى طرائق تحقيق ذلك تقوم على توفير طريقة (آلية) بديلة لحدوث التفاعل ذات طاقة تنشيط أدنى ويمثل ذلك بإزاحة طاقة التنشيط.
تؤدي إضافة الحفّاز إلى توفير مسار بديل للتفاعل، تكون طاقة التنشيط فيه أدنى.
فليس عمل الحفّاز خفض طاقة التنشيط بل توفير مسار بديل للتفاعل بطاقة تنشيط أدنى.
أنواع التحفيز
المحفزات يمكن أن تكون إما غير متجانسة أو متجانسة، حسب ما إذا كان المحفز متواجداً في نفس الحالة مثل substrate. المحفزات الحيوية غالباً ما يـُروا كمجموعة مختلفة.
تحفيز غير متجانس
 مقالة مفصلة: تحفيز غير متجانس
مقالة مفصلة: تحفيز غير متجانس

التحفيز غير المتجانس يكون فيه طور المحفز مختلف عن طور المواد المتفاعلة، إذ يمكن أن يكون المحفز صلباً في حين تكون المواد المتفاعلة غازية أو سائلة، يتكون من أكثر من طور.
ـ هدرجة الرابطة المضاعفة −C =C-
لعل أبسط أمثلة هذا التفاعل ذلك الذي يجري في تفاعل الإيتين والهدروجين بوجود حفاز من النيكل.
[[صورة: سطح الوسيط جاهز لامتزاز مزيد من جزيئات الايتين والهيدروجين.jpg|200px|يمين]]
ولعل هذا التفاعل عديم الجدوى من الناحية العملية، إذ يتحول فيه الإيتين ـ المادة الكبيرة الفائدة ـ إلى الإيتان عديم الفائدة نسبياً، غير أن التفاعل نفسه يحدث مع أي مادة عضوية تحتوي على الرابطة المضاعفة −C =C- [ر: الهدرجة] ولعل من أهم تطبيقات هذا التفاعل هدرجة الزيوت النباتية لصناعة المرغرين.
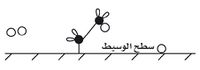
تمتز في هذا التفاعل جزيئات الإيتين على سطح النيكل إذ تنكسر الرابطة بين ذرات الكربون وتقوم الإلكترونات بربط الذرات بسطح النيكل كما في الشكل (1).
وتمتز على سطح النيكل جزيئات الهدروجين التي تنقسم إلى ذرات يمكنها التجول على سطح النيكل.
وإذا قيض لذرة الهدروجين الانتشار مقتربة من إحدى ذرات الكربون المرتبطة، تنقلب الرابطة بين الكربون إلى رابطة بين الكربون والهدروجين الشكل (3).
وينفلت عندها هذا الطرف من جزيء الإيتين من السطح ويعقب ذلك حدوث الشيء ذاته للطرف الآخر من الجزيء.
وكما في السابق تكوّن إحدى ذرات الهدروجين رابطة مع الكربون مع انفلات هذا الطرف أيضاً من السطح. وهكذا يصبح سطح النيكل جاهزاً من جديد لاستقبال جزيء متفاعِل آخر.
يقوم هذا النوع من الحفازات بتغيير الجزيئات السامة مثل CO وأنواع أكاسيد النتروجين في عوادم السيارات إلى جزيئات غير مؤذية مثل CO2 و N2 وذلك باستخدام حفازات غير متجانسة مثل البلاتين والبالاديوم والروديوم.
ترسَّب هذه المعادن على شكل طبقات رقيقة على حامل من السيراميك مما يجعل مساحة سطح الحفاز أعظمياً وبالتالي استخدام مقدار أصغري منه. ففي تفاعل CO مع أحادي أكسيد النتروجين ـ على سبيل المثال ـ يمتز كل من أحادي أكسيد الكربون وأحادي أكسيد النتروجين ـ كما في المثال السابق ـ على سطح الحفّاز ليتفاعلا متحولين إلى ثنائي أكسيد الكربون CO2 وآزوت (نتروجين) N2.
3 ـ استخدام أكسيد الفاناديوم V2O5 في اصطناع حمض الكبريت بطريقة التماس.
يحوَّل ثنائي أكسيد الكبريت في هذه الطريقة إلى ثلاثي أكسيد بإمرار SO2 والأكسجين على سطح حفّاز من أكسيد الفاناديوم:
ويختلف عمل الحفّاز هنا عنه في الأمثلة السابقة بأن الغازات تتفاعل في الواقع على الحفّاز وتؤدي إلى تغييره مؤقتاً، ويوضح هذا المثال مقدرة المعادن الانتقالية ومركباتها على الحفز بسبب مقدرتها على تغيير حالة أكسدتها. يتأكسد ثنائي أكسيد الكبريت إلى ثلاثي أكسيد الكبريت بوساطة أكسيد الفاناديوم V2O5 ويختَزَل أكسيد الفاناديوم (V) في هذه العملية إلى أكسيد الفاناديوم (I V):
ثمَّ يتأكسد V2O4 بالأكسجين متحولاً إلى V2O5 من جديد.
وهكذا يعود الحفّاز في نهاية التفاعل كيمياوياً إلى الحال التي كان عليها قبل التفاعل.
التحفيز المتجانس
 مقالة مفصلة: تحفيز متجانس
مقالة مفصلة: تحفيز متجانس
يكون الحفّاز في هذا النوع في الطور نفسه الذي توجد فيه المتفاعلات، إذ يكون الجميع إما في طور واحد غازي وإما سائل، ويدرج فيما يلي بعض الأمثلة على هذا النوع من الحفز.
1ـ تفاعل أيون (شاردة) البرسلفات مع أيون اليوديد: وهو مثال على التفاعل الحفزي المتجانس في الطور السائل.
يعد أيون البرسلفات -S2O82 عاملاً مؤكسداً قوياً في حين يعدّ أيون اليوديد - I عاملاً مرجعاً يتأكسد بسهولة بأيون البرسلفات، إلا أن التفاعل يجري في الطور المائي ببطء واضح بين هذين النوعين من الأيونات. ويتضح السبب عند النظر في المعادلة:
إذ يحتاج التفاعل إلى حدوث الاصطدام بين أيونين كلاهما سالب. يستخدم لتسريع هذا التفاعل حفّاز من الحديد (II) أو الحديد (III) يضاف إلى محلول التفاعل. ويدل استخدام الحديد هنا وهو معدن انتقالي على مقدرة هذا النوع من المواد على الوساطة (الحفز) بسبب مقدرتها على تغيير حالة أكسدتها. فإذا استخدم حفّاز من الحديد (II) يقوم أيون البرسلفات بأكسدة الحديد (II) إلى الحديد (III) ويرجَع أيون البرسلفات في هذا التفاعل إلى أيون الكبريتات.
ويعد أيون الحديد (III) مؤكسِداً قوياً يستطيع أكسدة أيون اليوديد إلى اليود، ويرجَع الحديد (III) إلى الحديد (II) مرة ثانية:
وفي كلتا العمليتين يتضمن التفاعل اصطداماً بين أيونات سالبة وأخرى موجبة الأمر الذي يعد أسهل منه في الاصطدام بين أيونين كلاهما سالب في التفاعل من دون حفاز.
ويحدث التفاعل نفسه ـ ولكن بترتيب مختلف ـ عندما يستخدم حفّاز من (Fe(III بدلاً من (Fe(II.
2ـ تخريب أوزون الجو
يعد هذا مثال التفاعلات المؤذية للبيئة إذ توجد المتفاعلات والحفاز والمنتجات جميعاً في طور غازي واحد.
يتكون الأوزون O3 ويتفكك على الدوام في الجو العالي بتأثير الأشعة فوق البنفسجية. تمتص جزيئات الأكسجين العادي الأشعة فوق البنفسجية وتنقسم إلى ذرات الأكسجين التي تمتلك الكترونات عازبة. وتسمى هذه الذرات جذوراً حرة free radicals وتتصف بأنها شديدة الفعالية. وتتحد الآن جذور الأكسجين مع جزيئات الأكسجين العادية مكونة الأوزون.
كذلك يمكن للأوزون أن ينفصم معطياً الأكسجين العادي وجذور الأكسجين وذلك بامتصاصه الأشعة فوق البنفسجية:
ويمضي تكون الأوزون وانفصامه على نحو مستمر، الأمر الذي يسهم في منع قدر كبير من الإشعاع فوق البنفسجي الضار من الوصول إلى سطح الأرض.
ويأتي الإنسان بنشاطاته المتنوعة على سطح الأرض «والمؤذية» في كثير منها ليخرب الأوزون الذي يكون في العادة طبقة جد رقيقة تحيط بالكرة الأرضية. وبالتالي يمنعه من امتصاص الأشعة فوق البنفسجية. يطلق الإنسان إلى الجو نوعاً من المركبات الكيمياوية المسماة كلورو فلورو كربون (ومثالهاCF2Cl2) التي تستخدم في الحلالات الهوائية (إيروسولات) aerosols ومواد انجماد. تتفكك هذه المركبات ببطء في الجو و تطلق ذرات الكلور، أي جذور الكلور الحرة التي تحفز تخريب الأوزون، ويحدث ذلك وفق مرحلتين: ينقسم في أولاها الأوزون ويتكون جذر حر جديد:
ويعاد تكوين الحفّاز Cl بتفاعل ثانٍ بين الجذر الحر ClO وذرة O التي سبق بيان كيفية تكونها.
ويستمر جذر الكلور في أداء مهمته التخريبية بحيث يمكن لكل جذر كلور أن يخرب بضعة آلاف من جزيئات الأوزون.
3ـ الحفز الذاتي
أكسدة حمض الحمّاض بأيونات فوق المنگنات (المنگنيز هنا بدرجة أكسدة +7).
يُحفَّز التفاعل في هذه الحالة بواحد من منتجاته ولعل أكسدة محلول حمض الحماض بمحلول محمض من منگنات (VII) البوتاسيوم (المعروفة باسم فوق منگنات البوتاسيوم) مثال بسيط على الحفز الذاتي:
يتصف هذا التفاعل بأنه شديد البطء عند درجة الحرارة العادية ويستخدم في المعايرة الحجمية لتعيين تركيز محلول منگنات (VII) البوتاسيوم ويجري عادة عند درجة حرارة قريبة من 60 ْس ومع ذلك فهو تفاعل بطيء ولاسيما في بدايته.
يحفَّز التفاعل بأيونات المنگنير (II) ولأنها ليست موجودة قبل بدء التفاعل لذلك ينطلق بسرعة جد منخفضة عند درجة الحرارة العادية ولكن تركيز أيونات المنگنير (II) يزداد مع استمرار التفاعل مما يدفع به للتسارع. ويمكن تمثيل هذا التأثير برسم تركيز أحد المتفاعلات بدلالة الزمن كما هو مبيَّن في المخطط البياني (4).
يبدو التفاعل بطيئاً في البدء (تفاعل غير محفَّز) ثمَّ يتسارع التفاعل مع تكون الحفاز (+Mn2) ثمَّ يتباطأ التفاعل لتناقص تراكيز المتفاعلات في النهاية.
ويختلف هذا الشكل عن المخطط البياني (5) الممثل لسرعة التفاعل الاعتياد.[4]
المحفزات الكهربائية
المحفزات العضوية
أهمية التحفيز

تصنيع الطاقة
المواد الكيميائية السائبة
الكيماويات الدقيقة
التصنيع الغذائي
علم الأحياء
 مقالة مفصلة: تحفيز حيوي
مقالة مفصلة: تحفيز حيوي
في البيئة
التاريخ
المستقبلات، السموم والمثيرات
السوق الحالية
انظر أيضاً
- تحفيز ذاتي
- BIG-NSE (كلية برلين للعلوم الطبيعية والهندسة)
- Catalysts and Catalysed Reactions (صحيفة كيمياء)
- المحفزات البيئية
- إنزيم
- محفز إنزيم
- Fractal catalytic model
- Phase Boundary Catalysis
- Phase transfer catalyst
- Ribozyme (RNA Biocatalysis)
- SUMO enzymes
- Temperature-programmed reduction
- Thermal desorption spectroscopy
المصادر
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "catalyst".
- ^ http://goldbook.iupac.org/C00876.html
- ^ الدريس, سعود (2009). المحفزات. مدينة الملك عبدالعزيز للعلوم والتقنية: معهد بحوث البترول والصناعات البتروكيميائية.
{{cite book}}: Cite has empty unknown parameters:|lay-date=,|subscription=,|nopp=,|last-author-amp=,|name-list-format=,|lay-source=,|registration=, and|lay-summary=(help); Missing|author1=(help) - ^ منظمة الأغذية والزراعة
- ^ حسن كلاوي. "الوساطة". الموسوعة العربية.
وصلات خارجية
- Science Aid: Catalysts Page for high school level science
- W.A. Herrmann Technische Universität presentation [1]
- Inorganic Chemistry and Catalysis Group, Utrecht University, The Netherlands
- Centre for Surface Chemistry and Catalysis
- Carbons & Catalysts Group, University of Concepcion, Chile
- Center for Enabling New Technologies Through Catalysis, An NSF Center for Chemical Innovation, USA