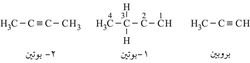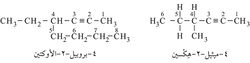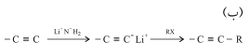ألكاين
الألكاينات Alkynes هي هيدروكربونات بها رابطة ثلاثية على الأقل بين ذرتي كربون. وتعرف الألكاينات أيضا بإسم الأسيتيلينات, وذلك على الرغم من أن الأسيتيلين هو أيضا اسم أول مركبات هذه السلسلة، وإن كان إسمه الرسمي إيثاين.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
بناء الألكاينات
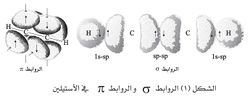
ذرات الكربون في رابطة الألكاينات تكون مهجنة تهجين sp وبها 2 أوربيتال p مدار sp مهجن واحد. تتداخل الأوربيتالات p لينتج من هذا رابطتان باي. بالإضافة إلى ذلك, يتداخل الأوربيتالان sp لتكوين رابطة سيجما sp-sp, وبذلك يكون العدد النهائي للروابط يساوي 3. وهذا يجعل الزاوية بين H-C-C 180 في الأسيتيلين. ونزرا لأن عدد الإلكترونات التى تساهم في تكوين هذه الرابطة الثلاثية, فإنها تكون رابطة قوية وتبلغ 837 KJ/mole. وتساهم الرابطة سيجما بمقدار 39 KJ/mole, وتساهم الرابطة باي الأولى بمقدار 268 KJ/mole, والرابطة باي الثانية تكون ضعيفة وتبلغ 202 KJ/mole. وطول الرابطة C-C يكون 1021 أنجستروم وهذا أقل بكثير من طول الرابطة في الألكينات والتى تبلغ 1034 أنگستروم، والألكانات وتبلغ 1053 أنجستروم.
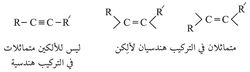
والرابطة الثلاثية هي المجموعة الوظيفية التي تقرر سلوك الألكينات، فالرابطة الثلاثية تشبه الرابطة الثنائية في نوع الرابطة بين ذرتيها، وبذلك تتشابه الألكينات والألكِنات في الكثير من التفاعلات، إلا أن الرابطة الثلاثية أقصر وأقوى وأقل قابلية للتفاعل من الرابطة الثنائية. ويقع مركز كل مــن الذرتين المتصلتين بالرابطة الثلاثية، وكذلك مركز كل من ذرتي الكربون في الرابطة الثلاثية نفسها على مستقيم، في حين تقع مراكز مثيلاتها في الرابطة الثنائية في مستو واحد، وعليه فلا يوجد في الألكينات متماثلات في التركيب isomers هندسية كما هو الحال في الألكنات.
وإذا كانت إحدى ذرتي الكربون في الرابطة الثلاثية تحمل هدروجيناً فتكون مقدرة ذرة الكربون هذه على جذب إلكترونات الرابطة بينها وبين الهدروجين عالية بالنسبة لمثيلتها في الألكِنات، مما يؤدي إلى تزايد الشحنة الموجبة على مدار الهدروجين في الألكينات، ولذلك تسلك هذه الألكينات سلوك حمض قادر على إعطاء الأسس القوية بروتوناً:
التسمية
تتبع الألكينات في تسميتها الطريقة نفسها المتبعة في تسمية الألكِنات على أن يستعاض عن اللاحقة إن ene المميزة للألكِنات باللاحقة إِين yne المميزة للألكينات.
وأبسط الألكينات الأستيلين acetylene وهو يسمى بحسب نظام تسمية الاتحاد الدولي للكيمياء البحتة والتطبيقية International Union of Pure and Applied Chemistry إتين ethyne، وتلاحظ هنا علاقة هذا الاسم باسم الألكان الذي يحوي بنية كربونية مماثلة:
ويسمى الألكين الذي يحتوي ثلاث ذرات كربون: بروبين propyne، ويليه البوتين butyne وهكذا. وأطول سلسلة تحوي الرابطة الثلاثية تُختار على أنها سلسلة رئيسية؛ وهكذا تدعى المركبات الآتية بالأسماء التي تحتها:
ويلاحظ أن قواعد تسمية الألكينات بحسب نظام تسمية الاتحاد الدولي للكيمياء البحتة والتطبيقية مماثلة لقواعد تسمية الألكنات.
وتعرف الألكينات ذات الصيغة العامة R-C º C-H بالألكينات الحقيقية، كما تعرف الألكينات ذات الصيغة العامة R-C º C-Ŕ بالألكينات الثنائية التبادل.
الخواص الفيزيائية
بعكس الألكانات والألكينات فإن الألكاينات تكون غير ثابتة ونشيطة للغاية. وهذا سبب زيادة الحرارة الخارجة من الأسيتيلين أثناء عمليات اللحام.
تشبه الألكينات في خواصها الفيزيائية خواص الألكانات والألْكِنات، فحدودها الثلاثة الأولى الإتين والبروبين و1-البوتين غازات في الدرجة العادية من الحرارة وفي الضغط الجوي. أما 2-البوتين وما يليه فأجسام سائلة، وتغدو الحدود صلبة بدءاً من C14H26رائحتها كرائحة الثوم، وهي قابلة للاشتعال تتقد بلهب مضيء وتغلي في درجات حرارة أعلى من درجات غليان الألْكِنات ذات التركيب المماثل والعدد نفسه من ذرات الكربون. وتزيد نقاط غليانها على نقاط غليان الألكانات الموافقة بفارق من الرتبة 6ْس في الألكينات الحقيقية، و15 ـ 20ْس في الألكينات الثنائية التبادل، ويعزى ذلك إلى كبر قوى الترابط بين جزيئاتها التي تتميز بعزوم ثنائية القطب ضعيفة تراوح بين 0.75 و0.90 ديباي (واحدة العزوم القطبية الكهربائية).
الألكينات أخف من الماء، وتزيد كثافات حدودها الوسطى السائلة على كثافات الألكانات بمقدار 6% تقريباً؛ وتفوق قرائنُ انكسارها قرائن انكسار الألْكِنات.
والألكينات تمتزج بالفحوم الهدروجينية والمذيبات العضوية الشائعة. وهي أكثر ذوباناً في الماء بعض الشيء من الألْكِنات، ففي الدرجة صفر يذيب لترُ الماء لتراً من غاز الأستيلين، أي يذيب 12 ضعفاً مما يذيب من الإيتان.
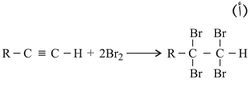
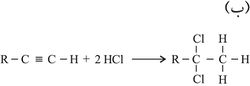
1ـ تفاعلات الضم:
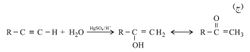
ولضعف قابلية الرابطة الثلاثية إلى تفاعلات الضم مقارنة بالرابطة الثنائية فإن ضم الماء يحتاج إلى حفّاز (وسيط) مثل أملاح الزئبق، ولا يكفي لهذا التفاعل استعمال الحمض وحده، كما هو الحال عند ضم الماء إلى الرابطة الثنائية في الألْكِنات.
أما الناتج المباشر لضم الماء إلى الألكين فقليل الثبات، ويتحول إلى ناتج أكثر ثباتاً هو مركَّبُ كربونيل. ويشكل ضم الماء هذا طريقة مناسبة لتحضير بعض الكيتونات المهمة، كما أن أبسط الكين وهو الأستيلين يعطي الألدهيد المعروف الأسيت ألدهيد.
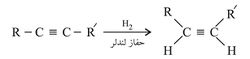
ينضم الهدروجين إلى الرابطة الثلاثية بحضور الحفازات المعدنية كالبلاتين أو البلاديوم أو النيكل. ولا يتوقف التفاعل عند انضمام جزيء واحد من الهدروجين إلى جزيء ألكين إذ تحت الشروط نفسها يتواصل التفاعل ليعطي الجزيء المشبع أي الألكان. ويرجع السبب في عدم توقف التفاعل عند انضمام الجزيء الأول إلى أن الناتج وهو الألْكِن أكثر نشاطاً من الألكين، فإذا ما تحول ألكين إلى ألْكِن فإن الناتج ينافس الألكين في ضم جزيء آخر من الهدروجين.
وللتوقف بالتفاعل عند الألكِن وعدم تجاوزه إلى الألكان تستعمل حفازات خاصة تنشط الانضمام الأول وتعيق الثاني؛ ومن هذه الحفّازات البلاديوم المحضر بطريقة خاصة والمعروف بحفاز لندلر Lindlar catalyst.
ومن الملاحظ أن انضمام الهدروجين يسلك طريقاً ترتبط فيه ذرتا الهدروجين بذرتي الكربون من جهة واحدة، ويكون الناتج مماثلاً في التركيب مقروناً cis.
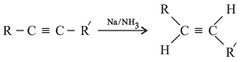
كما أمكن أيضاً تحويل الألكين إلى ألكِن عن طريق إرجاعه بعنصر الصوديوم أو الليثيوم مع الأمونيا. وفي هذا التفاعل تأخذ ذرتا الهدروجين مكانين بجهتين مختلفتين من الرابطة الثنائية أي أن الناتج هو مماثل في التركيب مفروق trans.
3 ـ حموضة الألكينات الحقيقية تسلك ذرة الهدروجين التي ترتبط بالرابطة الثلاثية سلوك هدروجين حمضي عند تعرضها لأسس قوية أقوى من الهدروكسيد OH-.
ويكون الأنيون (الشاردة السالبة) الناتج نفسه أساساً قوياً بإمكانه استخلاص بروتون من كثير من الجزيئات، فمع الماء مثلاً يتم التفاعل التالي:
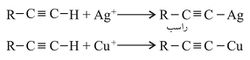
كما يتيح الوضع المتميز للهدروجين المتصل بالرابطة الثلاثية تفاعل الألْكينات التي تحتوي على مثل هذا الهدروجين مع بعض أيونات العناصر الثقيلة وخاصة أيونات الفضة Ag+ والنحاس Cu+:
ومن استخدامات هذه التفاعلات التفريق بين الألكينات التي تحتوي هدروجيناً على كربون الرابطة الثلاثية (الألكينات الحقيقية) والألكينات التي لا يتوافر فيها مثل هذا الهدروجين.
أمثلة للألكاينات
أصغر الألكاينات هو الإيثاين (أسيتيلين)
أطراف الألكاينات
أطراف الألكاينات بها ذرة هيدروجين واحدة كمستبدل ألفا. وهو أول عضو في جدولها homologe columm
الأسيتيليدات الفلزية
تتفاعل الألكاينات الطرفية مه القواعد القوية مثل الصوديوم, أميد الصوديوم, إن-بيوتيل ليثيوم, كاشف جرينيارد وينتج انيون من الألكاين الطرفي واسيتيليد فلزي. الأسيتيلين حمضي إلى حد ما, وله pKa بقيمة (25( وهذه قيمة متوسطة بين الأمونيا (35) والإيثانول (16]]. وسبب هذه الحامضية هو أن الشحنة السالبة في الأسيتيليد تثبت كنتيجة لصفات المدار s المميزة في المدار sp والتى يسكن فيها وزج الإلكترونات. الإلكترونات في المدار s تستفيد من الإقتراب النسبي للنواة الموجبة الشحنة وبالتالى يؤدى هذا لطاقة أقل.
تصنيع الألكاينات
تصنع الألكاينات بصفة عامة عن طريق نزع الماء المهلجن من الألكيل دايهاليد المتجاور, أو عن طريق تفاعل الأسيتيليدات الفلزية مع هاليد الألكيل الأساسي. وفى إعادة ترتيب فريتش-بوتينبرج-فايتشيل يتم تحضير الألكاين من بروميد الفينيل.
قلما توجد مركبات تحوي روابط ثلاثية في الطبيعة. وتعد الألكينات عموماً ـ باستثناء الأستيلين ـ من المواد التي كلفة اصطناعها باهظة، إضافة إلى أنها أقل أهمية بكثير من الأولفينات olefins.
أبسط الألكينات وأكثرها استعمالاً في الصناعات هو الأستيلين (الإتين)، ويمكن الحصول عليه لهذه الأغراض بإحدى طريقتين:
الأولى، وهي طريقة قديمة تقليدية لكنها شائعة الاستعمال، وتعتمد على تحضير كربيد الكلسيوم CaCO2 ابتداء من الفحم الحجري والحجر الكلسي، ومن ثم تحقيق تفاعل الكربيد مع الماء:
أما الطريقة الثانية فتعتمد على الأكسدة الجزئية لغاز المتان الناتج من آبار النفط (البترول):
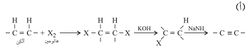
ولتحضير الألكينات الأثقل من الأستيلين تستعمل طرائق مخبرية يمثل بعضها في التفاعلات التالية:
يلاحظ أن بالإمكان إنجاز تفاعل الحذف الأول باستعمال أساس يحتوي على شاردة (أيون) هدروكسيد لإنتاج ألكِن، إلا أن الحذف الثاني يتطلب عادة أساساً مثل NH2- أقوى من الهدروكسيد لأن كلاً من الذرتين المراد حذفهما مرتبط برابطة فينيلية vinylic قوية نسبياً فلا يسهل حذفها.
يُبدأ في سلسلة التفاعلات هذه بمركب تحتوي جزيئاته على رابطة ثلاثية، فالتفاعلات هنا ليس الغرض منها إحداث رابطة ثلاثية ـ كما هو الحال في طريقة التحضير السابقة ـ بل ربط جزيء ألكيني بجزيء آخر يقدم مجموعة ألكيل للحصول على ألكين جديد ذي جزيئات أكبر. والتفاعل الأول في هذه الطريقة يعتمد على حموضة الهدروجين المتصل بالرابطة الثلاثية، فتفاعل ألكين مع أساس قوي مثل NH2- ينتج ملحاً يكون الأنيون فيه نيوكْلِيوفِيلاً (أساساً) جيداً باستطاعته مهاجمة هاليد ألكيل RX ليحل محل الهالوجين فيه. ولنجاح هذه الخطوة يشترط أن تكون الجذور الألكيلية في الهاليد من النوع الأولي primary وذلك لتجنب نواتج ثانوية غير مرغوب فيها، لأن ألكينيدات الليثيوم هي أسس تنزع هاليد هدروجين من هاليد الألكيل الثانوي secondary أو الثالثي tertiary معطية الألْكِنات الموافقة.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
تفاعلات الألكاينات
الألكاينات تدخل في كثير من التفاعلات العضوية
- تفاعلات الإضافة المحبة للإلكترونات
- إضافة الهيدروجين للألكينات أو الألكانات.
- إضافة الهالوجين إلى هاليد الفينيل أو هاليد الألكيل.
- إضافة هاليد الهيدروجين لهاليد الفينيل أو هاليد الألكيل المشابه.
- إضافة الماء لمركب الكاربونيل (عن طريق وسيط الإينول).
- تفاعلات الإضافة الحلقية
- تفاعل ديلز-ألدير مع 2-بيرون لإنتاج مركب أروماتي بعد تصاعد ثاني أكسيد الكربون.
- إضافة هويزن 3,1-ثنائية القطبية الحلقية لإنتاج مركبات الترايازول.
- تحلق بيرجمان للإيني دايأينات لإنتاج المركبات الأروماتية.
- تجمع ألكاين ثلاثي لإنتاج لمركبات الأروماتية.
- مزج الألكاينات في تحولات الألكاينات لإنتاج مركبات ألكاينية جديدة.
- تفاعلات الإستبدال المحبة للنواة لفلزات الأسيتيليدات.
- تكون رابطة كربون-كربون جديدة مع هاليدات الألكيل.
- تفاعلات الإضافة المحبة للنواة ]] لفلزات الأسيتيليدات.
- التفاعل مع مركبات الكربونيل لإنتاج مركبات وسيطة من الألكوكسيدٍ ثم ينتج الهيدروكسي ألكاين بعد الإزالة الحامضية.
- تفاعل الهيدرة بورونية للألكاينات مع بورون عضوي لإنتاج بورونات فينيلية
- ثم إختزال عن طريق بيروكسيد الهيدروجين لإنتاج الألدهيد أو الكيتون المقابل.
- الإنقسام التأكسدي بواسطة برمنجنات البوتاسيوم لإنتاج الأحماض الكربوكسيلية.