پيرين
| |
| |
| الأسماء | |
|---|---|
| اسم أيوپاك المفضل
Pyrene | |
| أسماء أخرى
Benzo[def]phenanthrene
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| مرجع بايلستاين | 1307225 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.004.481 |
| مرجع Gmelin | 84203 |
| KEGG | |
PubChem CID
|
|
| رقم RTECS |
|
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | C16H10 |
| كتلة مولية | 202.25 گ/مول |
| المظهر | مادة صلبة عديمة اللون
(غالباً ما توجد شوائب صفراء بمستوديات ضئيلة في العديد من العينات). |
| الكثافة | 1.271 گ/مول |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 0.135 مگ/ل |
| القابلية المغناطيسية | -147.9·10−6 سم3/مول |
| المخاطر | |
| خطر رئيسي | irritant |
| توصيف المخاطر | 36/37/38-45-53 |
| تحذيرات وقائية | 24/25-26-36 |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | non-flammable |
| مركبات ذا علاقة | |
PAHs ذات العلاقة
|
بنزوپيرين |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
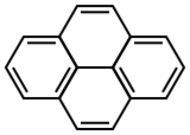
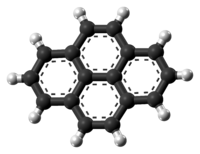
الپيرين، هو هيدروكربون عطري متعدد الحلقات يتألف من أربع حلقات بنزين مندمجة، مما يخلق [[نظام عطري مستوي. التركيبة الكيميائية للپيرين هي C 16H 10. يتكون الپيرين أثناء عملية الاحتراق غير مكتمل للمركبات العضوية.
التواجد والتفاعل
يوجد البرين طبيعياً في قطران الفحم، حيث يشكل حوالي 2% وزناً من التركيب. كما ينتج المركب عند عملية الاحتراق غير الكامل للمواد العضوية، فعلى سبيل المثال، تنتج السيارات حوالي 1 ميكروغرام من المركب في كل كيلومتر.[1]
هناك ارتباط بين نسبة الكربون في الكون وبين الهيدروكربونات العطرية متعددة الحلقات، حيث أن أكثر من 20% من الكربون في الكون مترافق ومرتبط في مركبات PAHs، ومنها البيرين.[2]
الخصائص
يوجد المركب على شكل بلورات بيضاء/عديمة اللون، ذات انحلالية ضعيفة جداً في الماء.
يخضع الپيرين للعديد من التفاعلات الكيميائية، منها تفاعل الأكسدة بالكرومات للحصول على مركب پيرينفثانون ونفثالين 8،5،4،1-رباعي حمض الكربوكسيل. كما يمكن إجراء سلسلة من تفاعلات الهلجنة،[3] والهدرجة والنترتة، بالإضافة إلى تفاعل ديلز-ألدر.[1]
التطبيقات
يستخدم مركب البيرين ومشتقاته في تحضير الأصبغة. كما يستخدم كمركب معياري في مطيافية الفلورية.
السلامة
بالرغم من عدم problematic مثل البنزوپيرين، إلا أن الدراسات الحيوانية قد أظهرت أن الپيرين مادة سامة على الكلى والكبد.[بحاجة لمصدر]
انظر أيضاً
المصادر
- ^ أ ب Senkan, Selim and Castaldi, Marco (2003) "Combustion" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim.
- ^ Hoover, Rachel (February 21, 2014). "Need to Track Organic Nano-Particles Across the Universe? NASA's Got an App for That". ناسا. Retrieved February 22, 2014.
- ^ Gumprecht, W. H. (1968) "3-Bromopyrene" Org. Synth., vol. 48, p. 30. doi:10.15227/orgsyn.048.0030
- ^ Pham, Tuan Anh; Song, Fei; Nguyen, Manh-Thuong; Stöhr, Meike (2014). "Self-assembly of pyrene derivatives on Au(111): Substituent effects on intermolecular interactions". Chem. Commun. 50 (91): 14089. doi:10.1039/C4CC02753A.
قراءات إضافية
- Birks, J. B. (1969). Photophysics of Aromatic Molecules. London: Wiley.
- Valeur, B. (2002). Molecular Fluorescence: Principles and Applications. New York: Wiley-VCH.
- Birks, J.B. (1975). Eximers. london: Reports on Progress in Physics.
- Fetzer, J. C. (2000). The Chemistry and Analysis of the Large Polycyclic Aromatic Hydrocarbons. New York: Wiley.