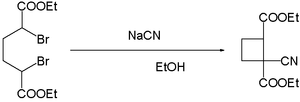
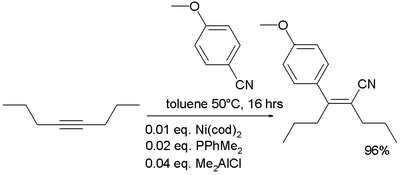
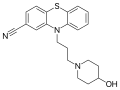
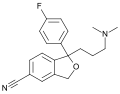
نيتريل
نتريل Nitrile مركّب عضوي ينتج من استبدالالزمرة C ≡ N- (أو اختصاراً -CN) بذرة هدروجين في فحم هدروجيني.
يشار إلى النتريل - وفق نمط جنيڤ أو نمط الاتحاد الدولي للكيمياء البحتة والتطبيقية International Union of Pure and Applied Chemistry (IUPAC) - باستهلال اسم الفحم الهدروجيني الموافق ذي العدد ذاته من ذرات الكربون (أو بعد إضافة «و» إلى نهاية اسم الفحم الهدروجيني) متبوعاً باللاحقة نتريل: CH3-CH2-CH2-CN البوتان نتريل، أو البوتانو نتريل؛ علماً أن هناك تسميات شتى أخرى مستخدمة؛ فالإيتان نتريل CH3-CN (الإيتانو نتريل) يدعى أيضاً أسيتو نتريل، و سيانو ميتان، وسيانور الميتيل، أو سيانيد الميتيل.
بخلاف الحدّ الأول - أي حمض السيانهدريك (حمض سيان الماء) HCN - لاتصادف النتريلات مطلقاً في الحالة الطبيعية.
تنتج النتريلات من بلهمة أملاح الأمونيوم أو الأميدات الأولية:
يمكن إجراء هذه البلمهة الوساطية (الوسيط Al2O3 في الطور الغازي) بـ P2O3 أو PCl5، يمكن في الحالة الأولى الاستعاضة عن الأميد بمولداته (R–CO2Et +NH3)، وبما أن الأميد مركّب وسطي، وأن من الممكن عزله تحت بعض الشروط، لذلك تعد البلمهةُ الأولى طريقةً لاصطناع الأميدات.
كما تتشكل النتريلات ببلمهة الألدوكسيمات ببلاماء حمض الخل ، إلا أن التحضيرات الاصطناعية هي الأكثر انتشاراً.
ففي السلسلة الأليفاتية يكون تفاعل التبادل:
سهلاً دائماً، ولايكون مستحيلاً انطلاقاً من C6H5Br نحو الدرجة 300 ْس، لكنه يكون أنجح مع البنزن سلفونات:
يتشكل البنزونتريل C6H5–C≡N بفعل حمض سيان الماء في مركّب الديازو بحضور سيانيد النحاس (I):
يمكن في السلسلة الأليفاتية (المفتوحة) الانتقال مباشرة من RX إلى R–CH2–CN، ومن أجل ذلك يكثف RX مع استر سيان حمض الخل في وسط قلوي:
وبعد الحلمهة (التحلل بالماء) يفقد النتريل حمض كربوكسيلَه نحو الدرجة 120 ْس:
النتريلات سائلة عموماً، يغلي HCN عند الدرجة 28 ْس؛ ويمتزج بالماء في جميع النسب؛ تنقص انحلالية(حلولية) النتريلات الأخرى في الماء عند ازدياد الكتلة المولية. أما Φ–CN فعديم الانحلال عملياً. وللنتريلات رائحة قوية، وهي سامة، لكنها أقل سمية من حمض سيان الماء HCN. تتميز وظيفة النتريل في ما تحت الأشعة الحمراء بطيف امتصاص قوي نحو 2200سم-1 (مجال الروابط الثلاثية).
إن الرابطة الثلاثية كربون - آزوت شديدة الاستقطاب:
ينبئ هذا بتفاعلات ضم موجهة، فالإلكتروفيل - عملياً الهدروجين أو المعدن - ينضم إلى الآزوت، في حين يتحد النوكليوفيل بالكربون؛ يمكن لتفاعلات الضم هذه أن تتكرر في الاتجاه نفسه:
تقود الهدرجة الوساطية أو الكيمياوية بسهولة إلى الأمين الأولي R–CH2NH2، غير أن الانتقال يتم بوساطة الإيمين R–CH=NH الذي يمكن أن يؤثر إذا تم العمل في وسط مُعقِّد (SnCl4)، ويُحَصل بحلمهة هذا الإيمين على الألدهيد R–CHO (تفاعل ستيفان Stéphan).
تقود الحموض الهدروجينية (أي العديمة الأكسجين) إلى منتجات ضم:
إن ضروب كلورهيدرات الكلور إيمينات هذه هي المركّبات الوسطية لتفاعلات ضم تتم بوجود HCl.
تجري الحلمهة في طورين:
وتكون الحلمهة بطيئة في وسط معتدل، وسريعة في وسط حمضي، كما تكون كذلك في وسط قلوي؛ وهي لاتتوقف في مرحلة الأميد إلا إذا كان هذا الأميد مزدحماً فراغياً.
تُعْطي الأغوال الأولية عند الدرجة صفر مئوية ضروب كلور هدرات الإيمينوإيترات القابلة للحلمهة إلى استرات..[1]
تتشكل عند درجة حرارة أعلى أورتو إيترات amidines:
تقود الأمينات غير الثالثية إلى الأميدينات:
إن ذرات الهدروجين المرتبطة بالكربون، والتي تتصف بفعالية خاصة تتحد بالآزوت: فمع الفينول يتم التفاعل:
وبالحلمهة يُحصل على NH4Cl وعلى كيتون ـ فنول.
تقود المركّبات العضوية المغنزيومية إلىإيميدورات imidures قابلة للحلمهة إلى كيتونات:
غير أن الهدروجين في الموقع ألفا α بالنسبة إلى CN - له، إن وُجِدَ - بعض الخواص الحمضية؛ ومن ذلك نشأ التفاعل الطفيلي:
إن النتريلات قابلة للتماثر؛ ويكون هذا التماثر غير محدود إن وجدت ذرات هدروجين في الموقع ألفا بالنسبة إلى -CN، ويقود التماثر إلى راتنجات؛ وفي الحالة العكسية يلاحظ تماثر ثلاثي غير عكوس:
التاريخ
التخليق
التفاعلات
Nitrile groups in organic compounds can undergo a variety of reactions depending on the reactants or conditions. A nitrile group can be hydrolyzed, reduced, or ejected from a molecule as a cyanide ion.
التحلل بالماء
The hydrolysis of nitriles RCN proceeds in the distinct steps under acid or base treatment to first give carboxamides RC(=O)NH2 and then carboxylic acids RCOOH. The hydrolysis of nitriles to carboxylic acids is efficient. In acid or base, the balanced equations are as follows:
- RCN + 2H2O + HCl → RCO2H + NH4Cl
- RCN + H2O + NaOH → RCO2Na + NH3
Note that strictly speaking, these reactions are mediated (as opposed to catalyzed) by acid or base, since one equivalent of the acid or base is consumed to form the ammonium or carboxylate salt, respectively.
Kinetic studies show that the second-order rate constant for hydroxide-ion catalyzed hydrolysis of acetonitrile to acetamide is 1.6 × 10−6 M−1 s−1, which is slower than the hydrolysis of the amide to the carboxylate (7.4 × 10−5 M−1 s−1). Thus, the base hydrolysis route will afford the carboxylate (or the amide contaminated with the carboxylate). On the other hand, the acid catalyzed reactions requires a careful control of the temperature and of the ratio of reagents in order to avoid the formation of polymers, which is promoted by the exothermic character of the hydrolysis.[2] The classical procedure to convert a nitrile to the corresponding primary amide calls for adding the nitrile to cold concentrated sulfuric acid.[3] The further conversion to the carboxylic acid is disfavored by the low temperature and low concentration of water.
- RCN + H2O → RC(O)NH2 (H2SO4 is a catalyst)
Two families of enzymes catalyze the hydrolysis of nitriles. Nitrilases hydrolyze nitriles to carboxylic acids:
- RCN + 2 H2O → RCO2H + NH3
Nitrile hydratases are metalloenzymes that hydrolyze nitriles to amides.
- RCN + H2O → RC(O)NH2
These enzymes are used commercially to produce acrylamide.
الاختزال
Nitriles are susceptible to hydrogenation over diverse metal catalysts. The reaction can afford either the primary amine (RCH2NH2) or the tertiary amine ((RCH2)3N), depending on conditions.[4] In conventional organic reductions, nitrile is reduced by treatment with lithium aluminium hydride to the amine. Reduction to the imine followed by hydrolysis to the aldehyde takes place in the Stephen aldehyde synthesis, which uses stannous chloride in acid.
Alkylation
Alkyl nitriles are sufficiently acidic to form nitrile anions, which alkylate a wide variety of electrophiles.[5] Key to the exceptional nucleophilicity is the small steric demand of the CN unit combined with its inductive stabilization. These features make nitriles ideal for creating new carbon-carbon bonds in sterically demanding environments for use in syntheses of medicinal chemistry. Recent developments have shown that the nature of the metal counter-ion causes different coordination to either the nitrile nitrogen or the adjacent nucleophilic carbon, often with profound differences in reactivity and stereochemistry.[6]
شغوف النواة
The carbon center of a nitrile is electrophilic, hence it is susceptible to nucleophilic addition reactions:
- with an organozinc compound in the Blaise reaction
- with alcohols in the Pinner reaction.
- with amines, e.g. the reaction of the amine sarcosine with cyanamide yields creatine[7]
- Nitriles react in Friedel–Crafts acylation in the Houben–Hoesch reaction to ketones
طرق ومركبات متفرقة
- In reductive decyanation the nitrile group is replaced by a proton.[8] Decyanations can be accomplished by dissolving metal reduction (e.g. HMPA and potassium metal in tert-butanol) or by fusion of a nitrile in KOH.[9] Similarly, α-aminonitriles can be decyanated with other reducing agents such as lithium aluminium hydride.[8]
- Nitriles self-react in presence of base in the Thorpe reaction in a nucleophilic addition
- In organometallic chemistry nitriles are known to add to alkynes in carbocyanation:[10]
التعقد
Nitriles are precursors to transition metal nitrile complexes, which are reagents and catalysts. Examples include [Cu(MeCN)4]+ and PdCl2(PhCN)2).[11]
مشتقات النيتريل
السياناميدات العضوية
السياناميدات هي مركبات N-cyano ببنية عامة R1R2N−CN وهي على صلة بالأب غير العضوي سياناميد.
أكاسيد النيتريل
البنية العامة لأكاسيد النيتريل تضم البنية R−CNO.
التواجد والتطبيقات
Nitriles occur naturally in a diverse set of plant and animal sources. Over 120 naturally occurring nitriles have been isolated from terrestrial and marine sources. Nitriles are commonly encountered in fruit pits, especially almonds, and during cooking of Brassica crops (such as cabbage, brussel sprouts, and cauliflower), which release nitriles through hydrolysis. Mandelonitrile, a cyanohydrin produced by ingesting almonds or some fruit pits, releases hydrogen cyanide and is responsible for the toxicity of cyanogenic glycosides.[12]
Over 30 nitrile-containing pharmaceuticals are currently marketed for a diverse variety of medicinal indications with more than 20 additional nitrile-containing leads in clinical development. The nitrile group is quite robust and, in most cases, is not readily metabolized but passes through the body unchanged.[بحاجة لمصدر] The types of pharmaceuticals containing nitriles are diverse, from vildagliptin, an antidiabetic drug, to anastrozole, which is the gold standard in treating breast cancer. In many instances the nitrile mimics functionality present in substrates for enzymes, whereas in other cases the nitrile increases water solubility or decreases susceptibility to oxidative metabolism in the liver.[13] The nitrile functional group is found in several drugs.
Structure of periciazine, an antipsychotic studied in the treatment of opiate dependence.
Structure of citalopram, an antidepressant drug of the selective serotonin reuptake inhibitor (SSRI) class.
Structure of cyamemazine, an antipsychotic drug.
Structure of fadrozole, an aromatase inhibitor for the treatment of breast cancer.
Structure of letrozole, an oral nonsteroidal aromatase inhibitor for the treatment of certain breast cancers.
انظر أيضاً
- للپوليمر المستخدم لصنع القفازات الواقية، انظر مطاط النتريل.
- النتريلات مضافة النواة: نترليوم
- النتريلات فاقدة النواة: أنيون النتريل
- سيانوكربون
- Nitrile ylide
المصادر
- ^ النتريل, الموسوعة العربية
- ^ Kukushkin, V. Yu.; Pombeiro, A. J. L. (2005). "Metal-mediated and metal-catalyzed hydrolysis of nitriles". Inorg. Chim. Acta. 358: 1–21. doi:10.1016/j.ica.2004.04.029.
- ^ Abbas, Khamis A. (2008-01-01). "Substituent Effects on the Hydrolysis of p-Substituted Benzonitriles in Sulfuric Acid Solutions at (25.0± 0.1) °C". Zeitschrift für Naturforschung A. 63 (9): 603–608. Bibcode:2008ZNatA..63..603A. doi:10.1515/zna-2008-0912. ISSN 1865-7109.
- ^ Barrault, J.; Pouilloux, Y. (1997). "Catalytic Amination Reactions: Synthesis of fatty amines. Selectivity control in presence of multifunctional catalysts". Catalysis Today. 1997 (2): 137–153. doi:10.1016/S0920-5861(97)00006-0.
- ^ Adams, Roger (1957). Organic Reactions, Volume 9. New York: John Wiley & Sons, Inc. ISBN 9780471007265. Retrieved 18 July 2014.
- ^ Fleming, Fraser F.; Zhang, Zhiyu (24 January 2005). "Cyclic nitriles: tactical advantages in synthesis". Tetrahedron. 61 (4): 747–789. doi:10.1016/j.tet.2004.11.012.
- ^ Smith, Andri L.; Tan, Paula (2006). "Creatine Synthesis: An Undergraduate Organic Chemistry Laboratory Experiment". J. Chem. Educ. 83 (11): 1654. Bibcode:2006JChEd..83.1654S. doi:10.1021/ed083p1654.
- ^ أ ب The reductive decyanation reaction: chemical methods and synthetic applications Jean-Marc Mattalia, Caroline Marchi-Delapierre, Hassan Hazimeh, and Michel Chanon Arkivoc (AL-1755FR) pp 90–118 2006 Article[dead link]
- ^ Berkoff, Charles E.; Rivard, Donald E.; Kirkpatrick, David; Ives, Jeffrey L. (1980). "The Reductive Decyanation of Nitriles by Alkali Fusion". Synthetic Communications. 10 (12): 939–945. doi:10.1080/00397918008061855.
- ^ Yoshiaki Nakao; Akira Yada; Shiro Ebata; Tamejiro Hiyama (2007). "A Dramatic Effect of Lewis-Acid Catalysts on Nickel-Catalyzed Carbocyanation of Alkynes". J. Am. Chem. Soc. (Communication). 129 (9): 2428–2429. doi:10.1021/ja067364x. PMID 17295484.
{{cite journal}}:|format=requires|url=(help); Unknown parameter|last-author-amp=ignored (|name-list-style=suggested) (help) - ^ Rach, S. F.; Kühn, F. E. (2009). "Nitrile Ligated Transition Metal Complexes with Weakly Coordinating Counteranions and Their Catalytic Applications". Chemical Reviews. 109 (5): 2061–2080. doi:10.1021/cr800270h. PMID 19326858.
- ^ Natural Product Reports Issue 5, 1999 Nitrile-containing natural products
- ^ Fleming, Fraser F.; Yao, Lihua; Ravikumar, P. C.; Funk, Lee; Shook, Brian C. (November 2010). "Nitrile-containing pharmaceuticals: efficacious roles of the nitrile pharmacophore". J Med Chem. 53 (22): 7902–17. doi:10.1021/jm100762r. PMC 2988972. PMID 20804202.
وصلات خارجية
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "nitrile".
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "cyanide".