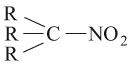نترات

| |
| الأسماء | |
|---|---|
| اسم أيوپاك النظامي
Nitrate | |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
PubChem CID
|
|
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | NO3 |
| كتلة مولية | 61.99 g mol-1 |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
النترات Nitrate، هي أيون متعدد الذرات مع الصيغة الجزيئية NO3− والكتلة الجزيئية 62.0049 g/mol.
البنية
الخصائص
مشتقات النترات
المشتقات النترية nitrated derivatives (أو مركبات النترو) في الكيمياء هي المركبات التي تحتوي على الزمرة
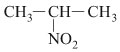
في بنيتها، وهي لاتوجد في الحالة الطبيعية. وهي نوعان أليفاتية aliphatic وعطرية aromatic، تشير إليها التسمية باسم الفحم الهدروجيني الموافق مسبوقاً بكلمة نترو:
وتتصف مركبات النترو العضوية عموماً بتفاعلات مميزة يمكن من خلالها اصطناع مركبات عضوية جديدة. وللمركبات الأليفاتية مثل النترو ميتان صفات حمضية واضحة مقارنة بالحموض العضوية الأخرى.[1]
مركبات النترو الأليفاتية
يمكن من حيث المبدأ تحضير مركبات النترو بفعل حمض الآزوت في الفحوم الهدروجينية:
ويطلق على هذا التفاعل الاسم (تفاعل النترجة)؛ إلا أن الكيفيات تتغير بتغير طبيعة الفحم الهدروجيني. وتتكرر النترجة بسهولة في حالة نترو الميتان أو الفحوم الهدروجينية العطرية مؤدية إلى متعددات النترو.
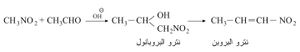
لايمكن تحضير نترو البارافينات الدنيا نقية بالتأثير المباشر بين حمض الآزوت HNO3 والبارافين إذ إنه يحصل التفاعل:
وتتم نترجة البرافينات في الطور البخاري بين الدرجتين 150 ْس و170 ْس مؤدية إلى خليط معقد من ضروب أحادي نترو البرافين. فيتألف الخليط من جميع المشتقات أحاديات النترو الممكنة ومن المشتقات المنترجة المتشكلة حسب احتمالات انقطاع سلسلة البرافين. فالإيتان على سبيل المثال يعطي مزيجاً من نترو الإيتان ونترو الميتان، والبروبان يعطي مزيجاً من نترو الإيتان ونترو الميتان. ولكن في حالة مركبات نترو البرافينات الأعلى فإنه من الممكن الحصول عليها بالنترجة المباشرة.
تنفرد مشتقات النترو الأليفاتية بإمكان الحصول عليها بتفاعل التبادل:
فعندما يُستخدم بروميد الميتيل على سبيل المثال ينتج نترو ميتان.
مركبات النترو سوائل لا لون لها ذات رائحة لطيفة ويمكن تقطيرها من دون أن تتفكك. ودرجات غليانها أعلى من درجات غليان البارافينات القريبة لها بالوزن.
النترو ميتان مركب زيتي له رائحة اللوز المر لا لون له، يتفكك بوجود حمض الكبريت المدخن (الكثيف) إلى أحادي أكسيد الكربون وهدروكسيل أمين NH2OH. يستخدم وقوداً للصواريخ.
ويبيِّن الجدول (1) الخواص الفيزيائية لبعض مركبات النترو الأليفاتية.
| درجة حرارة الانصهار (سْ) | درجة حرارة الغليان (سْ) | الكتلة الحجمية غ/سم3 (20سْ) | قرينة الانكسار (20سْ) | |
|---|---|---|---|---|
| CH3NO2 | -17 | 101 | 1.137 | 1.382 |
| CH3CH2NO2 | 1.392 | 1.045 | 115 | -50 |
| CH3(CH3)2NO2 | -108 | 131 | 1.008 | 1.402 |
| -93 | 120 | 0.988 |
1.394 |
ومركبات النترو الأليفاتية فعّالة كيمياوياً. يتم إرجاع (اختزال) مجموعة النترو بسهولة إلى أمين أولي بالهدرجة الوساطية أو بالهدروجين المحضّر من معدن نشيط وحمض معدني، أو بهدريد الليثيوم والألمنيوم LiAlH4
وإذا كانت ذرة الكربون التي ثبتت عليها زمرة النترو NO2 حاملة ذرة هدروجين فهناك إمكانية لتشكل شاردة ميزوميرية. ويطلق على الشكل الموافق للإينول الاسم: الشكل الحمضي. الذي يمكن عزله في بعض الحالات:
وللشرسبة الخواص نفسها التي للاينولات فهي تتفاعل مع مختلف الكواشف الإلكتروفيلية (مثل الهالوجينات، وحمض الآزوتي). وتعطي مع الألدهيدات والكيتونات بحسب الحالات نترو أغوال أو نترو ألكِنات:
تتفاعل نترو الألكانات الأولية مع حمض الآزوتي مشكلة مشتقات نتروزية زرقاء تُعرف باسم حمض النتروليك، وتنحل هذه الحموض في القلويات مشكلة أملاحاً حلولة في الماء حمراء اللون:
وتعطي مركبات نترو الألكانات الثانوية مشتقات نتروزية زرقاء لا تنحل في القلويات لأنها لا تحتوي على هدروجين حمضي:
أما نترو الألكانات الثالثية
التي لا تحوي هدروجينات −α فلا تتفاعل مع حمض الآزوتي. وتعرف اختبارات الكشف اللوني لنترو الألكانات الأولية والثانوية والثالثية أحياناً باسم التفاعل الأحمر الأبيض الأزرق.
مركبات النترو العطرية
يُحصل على مركبات النترو العطرية عامة نتيجة التأثير المباشر بين المركب العطري مع حمض الآزوت المدخِّن أو مزيج من حمض الآزوت وحمض الكبريت المركز، وفي حالة البنزن على سبيل المثال يتكون النترو بنزن. وهذه المركبات بصورة عامة، مُحِلات جيدة وحدودها العليا، غالباً، ما تكون متبلورة.
يفسَّر التفاعل أنه استبدال أروماتي (عطري) إلكتروفيلي. والإلكتروفيل هو أيون النترونيوم nitronium المتولد من التفاعل بين الحمضين:
للنترو بنزن رائحة اللوز المر وقد استُحضر في فرنسا باسم عطر الميربان essence de mirbane لتعطير الصابون.
ويتوقف عدد زمر النترو التي تدخل إلى المركب العطري على شروط التفاعل؛ فإذا جرى التفاعل السابق في شروط أقسى تشكل ثنائي أو ثلاثي نترو البنزن:
يُستخدم حمض الكبريت في التفاعلات السابقة لامتصاص الماء المتشكل في أثناء عملية النترجة، ويمكن الحصول على مركبات النترو أيضاً بفعل أكسيد النحاس (I) وصيغته Cu2O على أملاح الديازونيوم (C6H5− N≡NX-) أو نتيجة أكسدة الأمينات الأولية العطرية.
المركبات العطرية التي تحوي زمرة نترو واحدة ثابتة ويمكن تقطيرها من دون أن تتفكك، وهي ذات رائحة مقبولة وبلوراتها ذات لون أصفر باهت. ويكون ارتباط زمرة النترو قوياً ومن الصعب تبديلها بزمرة أخرى.
مركبات النترو العطرية ArNO2 فعّالة كيمياوياً، فهي قابلة للإرجاع - سواء بفعل الهدروجين بوجود وسيط (Ni) أم بفعل تفاعل كيمياوي Fe+HCl)) − إلى أمينات أولية Ar−NH2. ويعدّ إرجاع النترو بنزن الطريقة العملية الوحيدة لتحضير الأنيلين C6H5NH2، ومع ذلك يمكن أن يعاني النترو بنزن إرجاعات جزئية تعطي مركبات وسطية قبل الأنيلين وهذه المركبات هي:
تتطلب مركبات النترو العضوية الدقة في اختيار شروط تفاعلها، فهي تتفكك مباشرة بالحرارة عند درجات الحرارة العالية وعند وجود كمية فائضة من حمض الآزوت المركز، وبوجود حمض الكبريت المدخن فإنه من الممكن أن تحصل نترجة لاحقة لناتج نترجـة مركب التـولوين فيتشكل ثـلاثي نترو تولوين (TNT) صيغته ، وهو مركب منفجر يُستخدم في صناعة الأسلحة مثل القنابل اليدوية.
التواجد
الاستخدامات
تتلخص الاستعمالات الصناعية الرئيسية لنترو الألكانات - عدا إنتاج الهدروكسيل أمين NH2OH - في استعمالها محلات في صناعة اللدائن، وهي مواد وسطية في انتاج مبيدات الحشرات وعوامل الاستحلاب والمنظفات وذابّات الحشرات والمتفجرات والمواد الصيدلانية.
التسمم
تأثيره على صحة الإنسان
العديد من مركبات النترو متفجرات عنيفة، وخاصة المواد عديدة النترو ونترو الأمينات التي لا يمكن تداولها إلا بمراقبة جدية من الكيميائيين ذوي الخبرة.
الكلوروبكرين Cl3CNO2 مُسيل شديد للدموع ومُخرِّش للرئة وقد استعمل في القنابل المسيلة للدموع.
التسمم البحري

Domestic animal feed
Symptoms of nitrate poisoning in domestic animals include increased heart rate and respiration; in advanced cases blood and tissue may turn a blue or brown color. Feed can be tested for nitrate; treatment consists of supplementing or substituting existing supplies with lower nitrate material. Safe levels of nitrate for various types of livestock are as follows:[2]
| Category | %NO3 | %NO3–N | %KNO3 | Effects |
|---|---|---|---|---|
| 1 | <0.5 | <0.12 | <0.81 | Generally safe for beef cattle and sheep |
| 2 | 0.5–1.0 | 0.12–0.23 | 0.81–1.63 | Caution: some subclinical symptoms may appear in pregnant horses, sheep and beef cattle |
| 3 | 1.0 | 0.23 | 1.63 | High nitrate problems: death losses and abortions can occur in beef cattle and sheep |
| 4 | <1.23 | <0.28 | <2.00 | Maximum safe level for horses. Do not feed high nitrate forages to pregnant mares |
The values above are on a dry (moisture-free) basis.
Salts and covalent derivatives
Nitrate formation with elements of the periodic table.
| أملاح وأسترات أيون النترات | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HNO3 | He | ||||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO3)4− | RONO2 | NO3− NH4NO3 |
O | FNO3 | Ne | ||||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)3 | Co(NO3)2, Co(NO3)3 |
Ni(NO3)2 | Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | Br | Kr | ||
| RbNO3 | Sr(NO3)2 | Y | Zr(NO3)4 | Nb | Mo | Tc | Ru | Rh | Pd(NO3)2 | AgNO3 | Cd(NO3)2 | In | Sn | Sb | Te | I | XeFNO3 | ||
| CsNO3 | Ba(NO3)2 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg2(NO3)2, Hg(NO3)2 |
Tl(NO3)3 | Pb(NO3)2 | Bi(NO3)3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |||
| ↓ | |||||||||||||||||||
| La | Ce(NO3)x | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Th | Pa | UO2(NO3)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||
انظر أيضا
المراجع
- ^ أسامة ضبيط، صلاح يحياوي. "المشتقات النترية". الموسوعة العربية. Retrieved 2012-09-01.
- ^ "Nitrate Risk in Forage Crops - Frequently Asked Questions". Agriculture and Rural Development. Government of Alberta. Retrieved October 30, 2013.
مراجع للإستزادة
- موسى الناظر، عادل جرار، كيمياء المركبات العضوية (المنظمة العربية للتربية والثقافة والعلوم، تونس 1987).
- لڤيساليسLEVISALLES وكاسترو CASTRO، الكيمياء العضوية العامة والوظائف البسيطة، ترجمة وفائي حقي وزملائه (المطبعة الجديدة، دمشق 1891-2891)
- صلاح يحياوي، الكيمياء العضوية المفتوحة (مطبعة جامعة دمشق، 1967- 1968).
- PAULA YURKANIS BRUICE, Organic Chemistry (Prentice Hall, Pearson Education Inc. 2004).