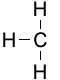ألكيل
الألكيل Alkyl هو جذر وحيد التكافؤ يحتوى على كربون وهيدروجين فقط, مرتبين في شكل سلسلة. وتكون الألكيلات سلسلة متجانسة ولها المعادلة العامة CnH2n+1. والامثلة للألكيلات تتضمن "الميثيل", CH3 (مشتق من الميثان)، و"البيوتيل" C4H9 (مشتق من البيوتان). ولا تتواجد الألكيلات بمفردها ولكن تتواجد كجزء من سلسلة كربونية متفرعة أكبر لجزيء عضوي. وفى حالة تواجد الألكيلات بمفرده فإنها تكون على شكل جذر حر وتكون نشيطة للغاية.
بناء الألكيلات
بناء الألكيلات هو نفس بناء الألكان المقابل الذى له سلسلة مستقيمة, ولكن أقل منه بذرة هيدروجين. فمثلا, الشكا القادم يمثل الميثيل وهو أصغر الألكيلات:
الألكيلات من الجذور نظرا لأن ثلاثة إلكترونات فقط من إلكترونات التكافؤ الأربعة يتم إستخدامها في الروابط في ذرة من ذرات الكربون.
وحيث أنها جذور، فإن الألكيلات تتواجد كجزء من جزيئات أكبر. ويتم تمثيل الجذور في المعادلات العماة بالرمز المختصر Rوهذا موضح في المعادلة العامة للإستر في الشكل القادم:
وفى عديد من الحالات تمثل R الألكيل، بالرغم من أنها يمكن أن تمثل أى جذر.
تفاعلات الألكيلات
الألكيلات الغير مرتبطة تكون جذور حرة, وبالتالى لا تتواجد إلا كمركبات وسيطة لحظية أثناء التفاعلات, وسرعان ما ترتبط بأى شيء لتفقد الإلكترون الغير مزدوج.
ومثال لتكون الألكيلات اللحظي هو عملية الكلورة. فهذا التفاعل يتضمن وجود جذور حرة من الكلور, تتكون من الإنحلال الضوئي, وتتفاعل مع الجزيء العضوي, وغالبا ما يكون ألكان. وترتبط الجذور الحرة للكلور مع الهيدروجين من الألكان لتكوين حمض الهيدروكلوريك, وتترك الألكان في حالة جذر حر, يرتبط بالكلور لتكوين النواتج, كلورو ألكان. وهذا التفاعل نشيط للغاية ويمكن أن يسبب إنفجارات إذا لم يتم أخذ الإحتياطات اللازمة.
تسمية الألكيلات
تسمية الألكيلات يشابه تسمية الألكانات. ولكن تكون اللاحقة "-يل". والبادئة تكون معتمدة على عدد ذرات الكربون الموجودة في الجزيء. وهذا يتم بنفس النظام المتبع في الألكانات, كما بالجدول القادم (مأخوذ من تسمية IUPAC):
| عدد ذرات الكربون | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| البادئة | Meth | Eth | Prop | But | Pent | Hex | Hept | Oct | Non | Dec | Undec | Dodec |
فمثلا, الثلاث ألكيلات الأولى تسمى ميثيل, إيثيل, بروبيل.
وهذه الأسماء تستخدم لتسمية السلاسل المتفرعة, فمثلا, 3-ميثيل بينتان:
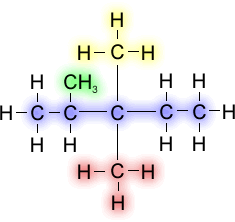
فبناء 3-ميثل بينتان يتكون من جزئين. الأول هو أطول سلسلة مستقيمة من ذرات الكربون, 5 ذرات كربون بدون روابط غير مشبعة, وعلى هذا تسمى بينتان. الجزء الثاني هو مجموعة الألكيل, الميثيل. ويتم إدراج أسماء مجموعات الألكيل قبل أى أى شيء أخر. ونظرا لأنه من الممكن أن يكون مكان الألكيل على أى ذرة من ذرات الكربون فإن ترتيب إرتبطاط الألكيل في السلسة يتم ذكره قبل إسم الألكيل ليصبح 3-ميثيل بيناتن.
وفى حالة تواجد أكثر من مجموعة ألكيل متماثلة, فإن الإسم يصبح مختلف قليلا فمثلا, 3,3,2-ترايميثيل بينتان.
وفى هذا المثال يوجد ثلاث مجموعات ألكيل متشابهة مرتبطة لذرات الكربون رقم 2, 3, 3. وبالتالي يتم ذكر أماكن إتصال مجموعات الألكيل بالسلسلة, والكلمة "تراي" لتوضيح أن هناك ثلاث مجموعات ألكيل متشابهة. وفى حالة أن مجموعة الميثيل المرتيطة باكربون رقم 2 كانت مجموعة إيثيل, فيكون الإسم 2-إيثيل-3,3-دايميثيل بينتان. وهنا يجب ملاحظة أنه في حالة تواجد مجموعات ألكيل مختلفة يتم كتابتها طبقا للترتيب الأبجدي.
شاهد أيضا
المصادر
- ويكيبيديا الإنجليزية.