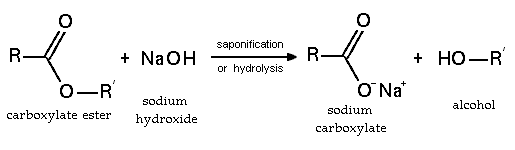
هيدروكسيد الصوديوم

| |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Sodium hydroxide
| |
| أسماء أخرى
Lye, الصودا الكاوية
| |
| المُعرِّفات | |
| رقم CAS | |
| ECHA InfoCard | 100.013.805 |
| E number | E524 (acidity regulators, ...) |
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | NaOH |
| كتلة مولية | 39.9971 g/mol |
| المظهر | صلب أبيض |
| الكثافة | 2.1 g/سم³, صلب |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 111 g/100 ml (20°س) |
| القاعدية (pKb) | -2.43 |
| المخاطر | |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | غير قابل للاشتعال. |
| مركبات ذا علاقة | |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
هيدروكسيد الصوديوم إنگليزية: Sodium hydroxide هو مركب قاعدي قوي له الصيغة الكيميائية (NaOH). يعرف أيضاً بالصودا الكاوية من المركبات الشائعة للصوديوم مركب كربونات الصوديوم (Na2 CO3) والمعروف بملح الصودا، وصودا الغسيل، وكربونات الصوديوم التجارية. ويكون هذا المركب على شكل بلورات أو مسحوق أبيض. وهو ذو خاصية قلوية قوية، ولذلك فهو يبطل مفعول الأحماض بأن يعادلها. وتستخدم كربونات الصوديوم في صناعة الزجاج والصابون والورق، كما تستخدم أيضًا كمطهر ومنظف، وفي إزالة عسر الماء (تخفيف الماء).
وهناك مركب بيكربونات الصوديوم (NaH CO3) وهو نوع شائع من الصودا، يستخدم في الطعام وصناعة الأدوية، ويعرف بصودا الخبز (بيكربونات الصودا). ويحتوي مسحوق الخبز البكنج بودر على بيكربونات الصوديوم التي تعمل كخميرة، حيث إنها تتسبب في انتفاخ الخبز والمُعَجنات أثناء الخبز. ويحتوي مسحوق سيدلز أيضًا على بيكربونات الصوديوم. ويستخدم الناس مسحوق سيدلز لتخفيف أحماض المعدة.
ويستخدم بكثرة في الصناعات الكيميائية وحرير الرايون والورق والصابون. ويستخدم هذا المركب أيضًا في عملية إنتاج الألومنيوم وتكرير البترول.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التحضير
قديما كان بحضر من معالجة رماد الصودا الناتج من طريقة لابلانك بهيدروكسيد الكالسيوم
وذلك اعنمادا على أن كربونات الكالسيوم غير منحلة في محلول الصودا الكاوية. إلا أن هذه الطريقة لم تعد تستخدم منذ عام 1962. الطريقة المعتمدة حاليا للإنتاج تتم من خلال التحليل الكهربائي لمحلول مركز من كلوريد الصوديوم قي الماء حيث يتشكل غاز الكلور على الأنود (المصعد) في حين يتشكل كل من غاز الهيدروجين و هيدروكسيد الصوديوم على الكاثود (المهبط). المعادلة الإجمالية للتفاعل:
يجب الفصل بين الكلور وهيدروكسيد الصوديوم الناتجين من عملية التحليل الكهربائي للحصول على كل منهما، ويتم ذلك باستخدام إحدى أنواع خلايا التحليل التالية
- خلية الزئبق
وهي أقدم الخلايا المستخدمة ويكون الأنود فيها إما من الغرافيت أو من التيتانيوم، في حين يكون الكاثود عبارة عن حوض من الزئبق. يعطي التحليل الكهربائي ملغمة زئبق-صوديوم التي لا تتفكك بوجود المحلول الملحي المركز، في حين يتم تفكيكها بحوض مائي آخر منفصل حسب المعادلة
إلا أنه ما يؤخذ على هذه الطريقة استعمالها للزئبق السام، مما أدى إلى تراجعها مقارنة مع غيرها.
- الخلية الحجابية
يستخدم في هذا النوع من الخلايا حجاب (diaphragm) من الأسبستوس يفصل بين الأنود والكاثود، مما يسمح بالهجرة الكهربائية للشوارد (الأيونات) لكنه يقلل من انتشار النواتج. يكون الأنود من الگرافيت أما الكاثود من حديد الصب. يجب أن تتم عملية استبدال مستمر للحجب بشكل منتظم.
- الخلية الغشائية

ويستخدم فيها غشاء نصف نفوذ يفصل بين الأنود والكاثود. يتم التحكم بالهجرة المعاكسة للأيونات من خلال معدل تدفق السائل خلال الغشاء، والذي يتم من خلال تحكم دقيق لمستوى السائل في الحجرات. الأغشية المستخدمة عبارة عن بوليمرات مثل النافيون.
التفاعلات
إذا أرسلنا غاز الكلور في دورق يحوي محلول الصود الكاوي لمدة كافية حصلنا على مزيج من ملحين هما كلوريد الصوديوم و تحت كلوريت الصوديوم NaOCl وفق المعادلتين :
- HCl + NaOH = NaCl +H2O
- HOCL +NaOH = NaOCl +H2O
الخصائص الكيميائية
عموماً، معادلات التعادل مثل تلك تتمثل بمعادلة واحدة أيونية خالصة بسيطة:
الاستعمالات
Sodium hydroxide is the principal strong base used in the chemical industry. In bulk it is most often handled as an aqueous solution, since solutions are cheaper and easier to handle. It is used to drive chemical reactions and also for the neutralization of acidic materials. It can be used also as a neutralizing agent in petroleum refining. It is also used for heavy duty and industrial cleaning.
- انتاج الألومينا
- انتاج الصابون
- الحفر بحثاً عن النفط
- انتاج الوقود
- صناعة لب الورق
- الديزل الحيوي
- الحفر على الألومنيوم
- عامل تنظيف
- ترميم نوافذ الزجاج المرصص
- مقشر الدهانات
- هضم الأنسجة
- اعداد الطعام
- الاستخدامات المنزلية
- الاستخدام في التحليل الكيميائي
السلامة

Solid sodium hydroxide or solutions of sodium hydroxide will cause chemical burns, permanent injury or scarring if it contacts unprotected human or animal tissue. It will cause blindness if it contacts with the eye. Protective equipment such as rubber gloves, safety clothing and eye protection should always be used when handling the material or its solutions.
Dissolution of sodium hydroxide is highly exothermic, and the resulting heat may cause heat burns or ignite flammables.
انظر أيضاً
وصلات خارجية
- International Chemical Safety Card 0360
- NIOSH Pocket Guide to Chemical Hazards
- European Chemicals Bureau
- Chlorine Online - Facts about Chlorine, Sodium Hydroxide (Caustic Soda) is an important co-product of Chlorine
- The Chlorine Institute, Inc. website
- Sodium hydroxide products of Bayer MaterialScience in North America
- Titration of acids with sodium hydroxide – freeware for data analysis, simulation of curves and pH calculation
المصادر
مراجع عامة
- International Chemical Safety Card 0360
- Euro Chlor-How is chlorine made? Chlorine Online
- NIOSH Pocket Guide to Chemical Hazards
- CDC – Sodium Hydroxide – NIOSH Workplace Safety and Health Topic
- Production by brine electrolysis
- Data sheets
- Titration of acids with sodium hydroxide; freeware for data analysis, simulation of curves and pH calculation
- Caustic soda production in continuous causticising plant by lime soda process
- ECHA InfoCard ID from Wikidata
- E number from Wikidata
- Chemical articles with unknown parameter in Chembox
- Articles containing unverified chemical infoboxes
- Short description is different from Wikidata
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- هندسة كيماوية
- Cleaning products
- مواد مذوبة
- مركبات الصوديوم
- كيماويات منزلية
- مركبات غير عضوية
- هيدروكسيدات
- مجففات
- مضافات غذائية بأرقام أوروپية
- منظمات حموضة الطعام