موليبدات الصوديوم

| |
| |
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Sodium molybdate
| |
| أسماء أخرى
Disodium molybdate
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.683 |
| رقم EC |
|
PubChem CID
|
|
| رقم RTECS |
|
| UNII |
|
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | Na2MoO4 |
| كتلة مولية | 205.92 g/mol (anhydrous) 241.95 g/mol (dihydrate) |
| المظهر | White powder |
| الكثافة | 3.78 g/cm3, solid |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | 84 g/100 ml (100 °C) |
| معامل الانكسار (nD) | 1.714 |
| المخاطر | |
| صفحة بيانات السلامة | External MSDS |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | Non-flammable |
| الجرعة أو التركيز القاتل (LD, LC): | |
LD50 (الجرعة الوسطى)
|
4000 mg/kg (rat, oral)[1] |
LC50 (التركيز الأوسط)
|
>2080 mg/m3 (rat, 4 hr)[1] |
| مركبات ذا علاقة | |
أنيونات أخرى
|
كرومات الصوديوم تنگستات الصوديوم |
كاتيونات أخرى
|
موليبدات الأمونيوم |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
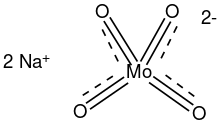
موليبدات الصوديوم مركب كيميائي له الصيغة Na2MoO4 ، ويكون على شكل بلورات بيضاء. كما يوجد على شكل ثنائي هيدرات Na2MoO4.2H2O.
الخواص
- مركب موليبدات الصوديوم منحل في الماء.
- يتفاعل مع بورهيدريد الصوديوم ليعطي أكسيد للموليبدنوم يكون للفلز فيه حالة أكسدة أدنى [2]:
- Na2MoO4 + NaBH4 + 2H2O → NaBO2 + MoO2 + 2NaOH+ 3H2
التحضير
يحضر مركب موليبدات الصوديوم من تفاعل حل أكسيد الموليبدنوم السداسي في هيدروكسيد الصوديوم ما بين 50 - 70 °س، ثم بإجراء عملية تبلور للمحلول الناتج [3]
- MoO3 + 2NaOH → Na2MoO4·2H2O
الاستخدامات
- يستخدم في الكيمياء التحليلية للكشف عن أشباه القلويات، وأيضاً للتمييز بين الأنتيموان والقصدير.
- يستخدم في الصناعة ضمن مجال مضادات التآكل.
The agriculture industry uses 500 tons per year as a fertilizer. In particular, its use has been suggested for treatment of whiptail in broccoli and cauliflower in molybdenum-deficient soils.[4][5] However, care must be taken because at a level of 0.3 ppm sodium molybdate can cause copper deficiencies in animals, particularly cattle.[3]
It is used in industry for corrosion inhibition, as it is a non-oxidizing anodic inhibitor.[3] The addition of sodium molybdate significantly reduces the nitrite requirement of fluids inhibited with nitrite-amine, and improves the corrosion protection of carboxylate salt fluids.[6] In industrial water treatment applications where galvanic corrosion is a potential due to bimetallic construction, the application of sodium molybdate is preferred over sodium nitrite. Sodium molybdate has the advantage in that the dosing of lower ppm's of molybdate allow for lower conductivity of the circulating water. Sodium molybdate at levels of 50-100 ppm offer the same levels of corrosion inhibition as sodium nitrite at levels of 800+ ppm. By utilizing lower concentrations of sodium molybdate, conductivity is kept at a minimum and thus galvanic corrosion potentials are decreased.[7]
التفاعلات
When treated with sodium borohydride, molybdate is reduced to molybdenum(IV) oxide:[8]
- Na2MoO4 + NaBH4 + 2H2O → NaBO2 + MoO2 + 2NaOH + 3H2
Sodium molybdate reacts with the acids of dithiophosphates:[3]
- Na2MoO4 + قالب:Overset → [MoO2(S2P(OR)2)2]
which further reacts to form [MoO3(S2P(OR)2)4].
البنية
In aqueous solution, sodium molybdate features dissociated sodium ions and tetrahedral molybdate (MoO42-), which adopts a sulfate-like structure. The solid dihydrate material has a complex structure typical for alkali metal salts of oxyanions. The MoO42- subunits are tetrahedral with Mo-O distances near 178 pm.[3][9]
السلامة
Sodium molybdate supports the biosynthesis of molybdoenzymes, which are found in all higher forms of life.[10] The LC50 for freshwater fish ranges from 60 to 7630 mg/L. The toxicity of soluble molybdate to marine organisms has also been reported.[11]
المراجع
- ^ أ ب "Molybdenum (soluble compounds, as Mo)". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Chi Fo Tsang and Arumugam Manthiram. Journal of Materials Chemistry 1997. 7(6). 1003–1006.
- ^ أ ب ت ث ج Braithwaite, E.R.; Haber, J. Molybdenum: An outline of its Chemistry and Uses. 1994. Elsevier Science B.V. Amsterdam, The Netherlands. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "Braithwaite" معرف أكثر من مرة بمحتويات مختلفة. - ^ Plant, W. (1950). "Use of Lime and Sodium Molybdate for the Control of 'Whiptail' in Broccoli". Nature. 165 (4196): 533. Bibcode:1950Natur.165..533P. doi:10.1038/165533b0. S2CID 4213274.
- ^ Davies, E. B. (1945). "A Case of Molybdenum Deficiency in New Zealand". Nature. 156 (3961): 392. Bibcode:1945Natur.156..392D. doi:10.1038/156392b0. S2CID 4071159.
- ^ Vukasovich, Mark S. Lubrication Engineering 1980. 36(12). 708-12.
- ^ M. Houser, Corrosion Control Services, Inc., Introduction Handbook
- ^ Tsang, Chi Fo; Manthiram, Arumugam (1997). "Synthesis of lower-valent molybdenum oxides in aqueous solutions by reducing Na2MoO4 with NaBH4". Journal of Materials Chemistry (in الإنجليزية). 7 (6): 1003–1006. doi:10.1039/A606389F. ISSN 1364-5501.
- ^ Matsumoto, Kazuko; Kobayashi, Akiko; Sasaki, Yukiyoshi (1975). "The Crystal Structure of Sodium Molybdate Dihydrate, Na2MoO4·2H2O". Bulletin of the Chemical Society of Japan. 48 (3): 1009–1013. doi:10.1246/bcsj.48.1009.
- ^ "Linus Pauling Institute page on molybdenum". 23 April 2014.
- ^ Heijerick, D.G.; Regoli, L.; Stubblefield, W. (2012). "The chronic toxicity of molybdate to marine organisms. I. Generating reliable effects data". Science of the Total Environment. 430: 260–269. Bibcode:2012ScTEn.430..260H. doi:10.1016/j.scitotenv.2012.03.045. PMID 22663766.
المصادر
- موسوعة رومب الكيميائية Römpp Lexikon Chemie, Georg Thieme Verlag
- [1]
وصلات خارجية
| Sodium molybdate
]].- Articles with changed EBI identifier
- Articles with changed ChemSpider identifier
- ECHA InfoCard ID from Wikidata
- Chemical articles with unknown parameter in Chembox
- Articles containing unverified chemical infoboxes
- Short description is different from Wikidata
- موليبدات
- مركبات الصوديوم
- معادن غذائية
- مركبات غير عضوية
- Corrosion inhibitors

