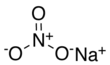
نترات الصوديوم

| |||
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
Sodium nitrate
| |||
| أسماء أخرى
Peru saltpeter
Soda niter cubic niter | |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.686 | ||
| رقم EC |
| ||
| E number | E251 (preservatives) | ||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
| UN number | 1498 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | NaNO3 | ||
| كتلة مولية | 84.9947 g/mol | ||
| المظهر | White powder or colorless crystals | ||
| الرائحة | sweet | ||
| الكثافة | 2.257 g/cm3, solid | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | 73 g/100 g water (0 °C) 91.2 g/100 g water (25 °C)[1][2] 180 g/100 g water (100 °C) | ||
| قابلية الذوبان | very soluble in ammonia, hydrazine soluble in alcohol slightly soluble in pyridine insoluble in acetone | ||
| القابلية المغناطيسية | −25.6·10−6 cm3/mol | ||
| معامل الانكسار (nD) | 1.587 (trigonal) 1.336 (rhombohedral) | ||
| اللزوجة | 2.85 cP (317 °C) | ||
| البنية | |||
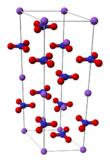
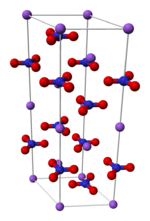
| البنية البلورية | trigonal and rhombohedral | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
−467 kJ/mol[3] | ||
| Standard molar entropy S |
116 J/(mol K)[3] | ||
| سعة الحرارة النوعية، C | 93.05 J/(mol K) | ||
| المخاطر | |||
| خطر رئيسي | Harmful (Xn) Oxidant (O) | ||
| صفحة بيانات السلامة | ICSC 0185 | ||
| ن.م.ع. مخطط تصويري |  
| ||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | Non-flammable | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
3236 mg/kg | ||
| مركبات ذا علاقة | |||
أنيونات أخرى
|
Sodium nitrite | ||
كاتيونات أخرى
|
Lithium nitrate Potassium nitrate Rubidium nitrate Caesium nitrate | ||
مركـّبات ذات علاقة
|
Sodium sulfate Sodium chloride | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
نترات الصوديوم Sodium nitrate هي مركب كيميائي صيغته NaNO 3. هذا الملح لنترات فلز قلوي يُعرف أيضاً باسم ملح تشيلى Chile saltpeter (رواسب كبيرة استُخرجت تاريخياً في تشيلى)[4][5] لتمييزه عن النتر المعتاد، نترات الپوتاسيوم. كما تـُعرَف الصيغة المعدنية بإسم نيتراتين أو نتراتيت nitratite أو نتر الصودا.
نترات الصوديوم تكون صلبة بيضاء قابلة جداً للذوبان في الماء. إنها مصدر متاح بسهولة لأنيون النترات (NO3−)، المفيد في العديد من التفاعلات التي تُجرى على مستويات صناعية لانتاج الأسمدة، الألعاب النارية وقنابل الدخان، والزجاج والخزف المينا وحفظ الأغذية (خصوصاً اللحوم)، ودافع صاروخي صلب. ويُستخرَج على نطاق واسع لتلك الأغراض.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص
- تتسيل بلورات نترات الصوديوم نتيجة التماس مع الهواء الرطب، وتنحل بشكل جيد جداً بالماء (حوالي 100 غ / 100 مل ماء)، وذلك مع ملاحظة انخفاض درجة حرارة المحلول. محاليل نترات الصوديوم في الماء معتدلة.
- يتفكك مركب نترات الصوديوم بالتسخين بدءاً من 380°س إلى نتريت الصوديوم ثم إلى بيروكسيد الصوديوم، وأخيراً إلى أكسيد الصوديوم.
التحضير
يتواجد نترات الصوديوم في الطبيعة على شكل ملح بيتر تشيلي. صناعياً يحضر من تعديل حمض النيتريك الناتج من أكسدة الأمونيا، وذلك بكربونات الصوديوم حسب المعادلة
الاستخدامات
- يدخل في صناعة أعواد الثقاب والألعاب النارية والمواد المتفجرة.
- يستخدم في صناعة الأسمدة.
- يستخدم في الصناعات الغذائية تحت الرقم E 251، وذلك في مجال حفظ اللحوم، بالإضافة إلى استخدامه في تحضير الجبن وحفظ الأسماك.
انظر أيضاً
- War of the Pacific, also known as the "Saltpeter War"
المصادر
Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
قراءات أخرى
- Barnum, Dennis (2003). "Some History of Nitrates". Journal of Chemical Education. 80: 1393–. doi:10.1021/ed080p1393.
وصلات خارجية
- ATSDR — Case Studies in Environmental Medicine - Nitrate/Nitrite Toxicity U.S. Department of Health and Human Services (public domain)
- FAO/WHO report
- ^ Haynes, William M. (2016-06-22). CRC Handbook of Chemistry and Physics. CRC Press. ISBN 978-1-4987-5429-3.
- ^ "Sodium nitrate". PubChem. Retrieved 11 June 2021.
- ^ أ ب Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 978-0-618-94690-7.
- ^ "The Nitrate Towns of Chile". Atlas Obscura (in الإنجليزية). Retrieved 27 May 2019.
- ^ Mutic, Anja (26 October 2012). "The ghost towns of northern Chile". Washington Post (in الإنجليزية). Retrieved 27 May 2019.