ثلاثي الكربون
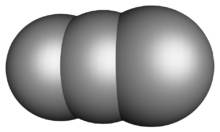
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Tricarbon
| |
| اسم أيوپاك النظامي
1λ2,3λ2-propadiene | |
| أسماء أخرى
Triatomic carbon[بحاجة لمصدر]
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
PubChem CID
|
|
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | C3 |
| كتلة مولية | 36.03 g mol-1 |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
820.06 kJ mol−1 |
| Standard molar entropy S |
237.27 J K−1 mol−1 |
| مركبات ذا علاقة | |
carbon molecules ذات العلاقة
|
Diatomic carbon |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
ثلاثي الكربون إنگليزية: Tricarbon أو سيكلوپروپ-تراي-ئين Cycloprop-tri-ene هو أحد ترايمرات الكربون وله الصيغة الجزيئية C3. ويتكون من 3 ذرات كربون في شكل حلقي متعادل كهربياً، وكل ذرات الكربون مرتبطة بروابط ثنائية مع الأخرين. It is a colourless gas that only persists in dilution or solution as an adduct. It is one of the simplest unsaturated carbenes. Tricarbon can be found in interstellar space and can be produced in the laboratory by a process called laser ablation.
التواجد الطبيعي
Tricarbon is a small carbon cluster first spectroscopically observed in the early 20th century in the tail of a comet by William Huggins and subsequently identified in stellar atmospheres. Small carbon clusters like tricarbon and dicarbon are regarded as soot precursors and are implicated in the formation of certain industrial diamonds and in the formation of fullerenes.
C3 has also been identified as a transient species in various combustion reactions.[1]
الخصائص
الخصائص الكيميائية
The chemical properties of C3 was investigated in the 1960s by Professor Emeritus Philip S. Skell of Pennsylvania State University, who showed that certain reactions of carbon vapor indicated its generation, such as the reaction with isobutylene to produce 1,1,1',1'-tetramethyl-bis-ethanoallene.[2]
الخصائص الفيزيائية
The ground state molecular geometry of tricarbon has been identified as linear via its characteristic symmetric and antisymmetric stretching and bending vibrational modes and bears bond lengths of 129 to 130 picometer corresponding to those of alkenes. The ionization potential is determined experimentally at 11 to 13.5 electronvolts.[3] In contrast to the linear tricarbon molecule, the C+3 cation is bent.
التسمية
The systematic names 1λ2,3λ2-propadiene, and μ-carbidodicarbon, valid IUPAC names, are constructed according to the substitutive and additive nomenclatures, respectively.
In appropriate contexts, tricarbon can be viewed as propadiene with four hydrogen atoms removed, or as propane with eight hydrogen atoms removed; and as such, propadienediylidene or propanetetraylidene, respectively, may be used as a context-specific systematic names, according to substitutive nomenclature. By default, these names pay no regard to the radicality of the tricarbon molecule. In even more specific context, these can also name the non-radical singlet state, whereas the diradical state is named propadienediylylidene, or propanediyldiylidene, and the tetraradical state is named propedienetetrayl or propanetetraylylidene.[2]
ثلاثي الكربون هو أصغر جزيئات ترايين ولكنه غير مستقر نظرا لوجود إعاقة فراغية كبيرة. ثلاثي الكربون تم بحثه بمعرفة فيليپ س. سكل، في جامعة ولاية پنسلڤانيا عقد 1960. وتم إكتشافه في الفراغ بين النجوم.
انظر أيضا
المراجع
- ^ Gaydon, Alfred G.; Wolfhard, Hans G. (1979). "Detection of intermediate products". Flames: their structure, radiation and temperature (4th rev. ed.). London: Chapman and Hall. ISBN 0-412-15390-4.
- ^ أ ب Skell, P. S.; Wescott, L. D. (1963). "Chemical Properties of C 3 , a Dicarbene". Journal of the American Chemical Society (in الإنجليزية). 85 (7): 1023. doi:10.1021/ja00890a059. ISSN 0002-7863.
- ^ Nicolas, Christophe; et al. (2006). "Vacuum Ultraviolet Photoionization of C3". Journal of the American Chemical Society. 128 (1): 220–226. doi:10.1021/ja055430+. PMID 16390150.
للاستزادة
- Gaydon, Alfred G.; Wolfhard, Hans G. (1979). Flames: their structure, radiation and temperature (4th rev. ed.). London: Chapman and Hall. ISBN 0-412-15390-4.
- Hinkle, Kenneth W.; Keady, John J.; Bernath, Peter F. (1988). "Detection of C3 in the Circumstellar Shell of IRC+10216". Science. 241 (4871): 1319–1322. Bibcode:1988Sci...241.1319H. doi:10.1126/science.241.4871.1319. PMID 17828935. S2CID 40349500.
المصادر
- ويكيبيديا الإنجليزية.