ثاني أكسيد النيتروجين
|
| |||
 (NO 2) converts to the colorless dinitrogen tetroxide (N 2O 4) at low temperatures and reverts to NO 2 at higher temperatures.
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
Nitrogen dioxide
| |||
| أسماء أخرى
Nitrogen(IV) oxide,[1] Deutoxide of nitrogen
| |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.030.234 | ||
| رقم EC |
| ||
| مرجع Gmelin | 976 | ||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
| UN number | 1067 | ||
CompTox Dashboard (EPA)
|
|||
| الخصائص | |||
| الصيغة الجزيئية | NO•2 | ||
| كتلة مولية | 46.006 g/mol[2] | ||
| المظهر | Brown gas[2] | ||
| الرائحة | Chlorine like | ||
| الكثافة | 1.880 g/L[2] | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | Hydrolyses | ||
| قابلية الذوبان | soluble in CCl 4, nitric acid,[3] chloroform | ||
| ضغط البخار | 98.80 kPa (at 20 °C) | ||
| القابلية المغناطيسية | +150.0·10−6 cm3/mol[4] | ||
| معامل الانكسار (nD) | 1.449 (at 20 °C) | ||
| البنية | |||
| الشكل الجزيئي | Bent | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
+33.2 kJ/mol | ||
| Standard molar entropy S |
240.1 J/(mol·K) | ||
| سعة الحرارة النوعية، C | 37.2 J/(mol·K) | ||
| المخاطر | |||
| خطر رئيسي | Poison, oxidizer | ||
| صفحة بيانات السلامة | ICSC 0930 | ||
| ن.م.ع. مخطط تصويري |     
| ||
| ن.م.ع. كلمة الاشارة | Danger | ||
| H270, H314, H330 | |||
| P220, P260, P280, P284, P305+P351+P338, P310 | |||
| NFPA 704 (معيـَّن النار) | |||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LC50 (التركيز الأوسط)
|
30 ppm (guinea pig, 1 h) 315 ppm (rabbit, 15 min) 68 ppm (rat, 4 h) 138 ppm (rat, 30 min) 1000 ppm (mouse, 10 min)[6] | ||
LCLo (المنشورة الأقل)
|
64 ppm (dog, 8 h) 64 ppm (monkey, 8 h)[6] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
C 5 ppm (9 mg/m3)[5] | ||
REL (الموصى به)
|
ST 1 ppm (1.8 mg/m3)[5] | ||
IDLH (خطر عاجل)
|
20 ppm[5] | ||
| مركبات ذا علاقة | |||
nitrogen oxides ذات العلاقة
|
Dinitrogen pentoxide Dinitrogen tetroxide | ||
مركـّبات ذات علاقة
|
Chlorine dioxide Carbon dioxide | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
ثاني أكسيد النيتروجين Nitrogen dioxide هو مركب كيميائي بالصيغة NO 2. زهو أحد أكاسيد النيتروجين المتعددة. NO 2 هو وسيط في التخليق الصناعي لحمض النيتريك، ملايين الأطنان منه تـُنتج كل سنة للاستخدام أساساً في انتاج الأسمدة. وفي درجات الحرارة الأعلى، فإنه يكون غاز بني-محمِر.[7] ثاني أكسيد النيتروجين هو مغناطيسي مساير، بجزيئات ملتوية تحتوى C2v تماثل جماعي نقطي.
الخصائص
ثاني أكسيد النيتروجين هو غاز بني محمِرّ فوق درجة حرارة 21.2° س برائحة لاذعة نفاذة، ويصبح سائلاً بنياً مصفراً تحت درجة حرارة 21.2° س، ويتحول إلى رابع أكسيد ثنائي النيتروجين (N 2O 4) عديم اللون تحت -11.2° C.[5]
طول الرابطة بين ذرة النيتروجين وذرة الأكسجين هو 119.7 پم. هذا الطول للرابطة يتسق مع رتبة رابطة بين واحد واثنين.
على العكس من الأوزون، O3، الحالة الإلكترونية القاعية لثاني أكسيد النيتروجين هي حالة ثنائية، إذ أن النيتروجين له إلكترون واحد غير مقرون،[8] مما يقلل تأثير ألفا بالمقارنة مع النتريت ويخلق تفاعل ربط ضعيف مع الأزواج الوحيدة من الأكسجين. الإلكترون المنفرد في NO 2 يعني أيضاً أن هذا المركب هو جذر حر، ولذلك فالصيغة لثاني أكسيد النتروجين كثيراً ما تـُكتـَب كالتالي •NO 2.
اللون البني المحمِرّ هو نتيجة الامتصاص التفضيلي للضوء في المنطقة الزرقاء من الطيف (400 – 500 نم)، على الرغم من أن الامتصاص يمتد في جميع أنحاء المرئي (بأطوال موجية أقصر) وإلى الأشعة تحت الحمراء (بأطوال موجية أطول). امتصاص الضوء عند أطوال موجية أقصر من حوالي 400 نم يسفر عن تحلل ضوئي (ليشكـِّل NO + O، أكسجين ذري)؛ في الغلاف الجوي إضافة ذرة O إلى O2 يسفر عنه تشكل الأوزون.
التحضير والتفاعلات
ثاني أكسيد النيتروجين عادة ما ينتج من أكسدة أكسيد النيتريك بالأكسجين في الهواء:[9]
- 2 NO + O 2 → 2 NO 2
يتشكل ثنائي أكسيد النيتروجين في معظم عمليات الاحتراق باستخدام الهواء كمادة مؤكسدة. عند درجات الحرارة المرتفعة يرتبط النيتروجين مع الأكسجين ليشكلا أكسيد النيتريك:
- O 2 + N 2 → 2 NO
في المعمل، يمكن تحضير ثاني أكسيد النيتروجين في إجراء من خطوتين حيث يتم تجفيف أكسيد النيتريك لإنتاج خماسي أكسيد ثنائي النتروجين، الذي يخضع لاحقاً للتحلل الحراري:
- 2 HNO 3 → N 2O 5 + H 2O
- 2 N 2O 5 → 4 NO 2 + O 2
كما ينتج ثاني أكسيد النيتروجين عن التحلل الحراري لبعض نترات الفلزات:
- 2 Pb(NO 3) 2 → 2 PbO + 4 NO 2 + O 2
بدلاً من ذلك، يتم اختزال حمض النيتريك المركز بالمعادن (مثل النحاس).
- 4 HNO 3 + Cu → Cu(NO 3) 2 + 2 NO 2 + 2 H 2O
أو في النهاية بإضافة حمض النيتريك المركز على القصدير، وينتج أكسيد القصدير الرباعي المميه كناتج ثانوي.
- 4 HNO3 + Sn → H2O + H2SnO3 + 4 NO2
التفاعلات الرئيسية
الخصائص الحرارية الأساسية
يتواجد ثاني أكسيد النيتروجين بطريقة متوازنة مع غاز رابع أكسيد ثنائي النيتروجين عديم اللون (N 2O 4):
- 2 NO 2
 N 2O 4
N 2O 4
- 2 NO 2 → 2 NO + O 2
كمؤكسد
يشير ضعف رابطة ثاني أكسيد النيتروجين إلى كونه مؤكسد جيد. نتيجة لذلك، يحترق، وفي بعض الأحيان بشكل متفجر، مع العديد من المركبات مثل الهيدروكربونات.
التحلل المائي
يتحلل ثاني أكسيد النيتروجين مائياً لينتج أكسيد النيتريك وأكسيد النيتروز:
- 2 NO 2 (N 2O 4) + H 2O → HNO 2 + HNO 3
تشكله من تحلل حمض النتريك
يتحلل حمض النيتريك ببطء لثاني أكسيد النيتروجين بواسطة التفاعل العام التالي:
- 4 HNO 3 → 4 NO 2 + 2 H 2O + O 2
يمنح ثاني أكسيد النيتروجين المتشكل اللون الأصفر المميز الذي غالباً ما يظهره هذا الحمض.
تحوله إلى نترات
يستخدم ثاني أكسيد النيتروجين لتحضير نيترات الفلزية اللامائية من الأكاسيد:[9]
- MO + 3 NO 2 → M(NO 3) 2 + NO
تحوله إلى نتريت
تعطي أيوديات الألكايل والفلزات النيترات المقابلة:
- 2 CH 3I + 2 NO 2 → 2 CH 3NO 2 + I 2
- TiI 4 + 4 NO 2 → Ti(NO 2) 4 + 2 I 2
علم البيئة
يتواجد ثاني أكسيد النيتروجين في البيئة بأسباب طبيعية، ومنها دخوله من الستراتوسفير، التنفس البكتيري، البراكين، والإضاءة. تجعل هذه المصادر ثاني أكسيد النيتروجين غاز نذر في الغلاف الجوي للأرض، حيث يلعب دوراً في امتصاص ضوء الشمس وتنظيم كيمياء التروپوسفير, وخاصة في تحديد تركيزات الأوزون.[10]
الاستخدامات
يستخدم ثاني أكسيد النيتروجين كمادة وسيطة في تصنيع حمض النيتريك، وكعامل نترتة في تصنيع المتفجرات الكيميائية، وكمثبط بلمرة للأكريليتات، وكعامل لتبييض الدقيق،[11] وكعامل لتنقية درجة حرارة الغرف.[12] كما يستخدم كمادة مؤكسدة في وقود الصواريخ، على سبيل المثال في حمض نيتريك الدخاني الأحمر؛ يستخدم في صواريخ تيتان، ولإطلاق مشروع جمني، وفي الدفع المناور لمكوك الفضاء وفي المسبارات الفضائية غير المأهولة المرسلة إلى مختلف الكواكب.[13]
تحضيره اصطناعياً والتعرض له
بصفة عامة، تعتبر محركات الاحتراق الداخلي التي تحرق الوقود الأحفوري من أبرز مصادر ثاني أكسيد النيتروجين.[7] قد ينتج ثاني أكسيد النيتروجين في الأماكن المفتوحة نتيجة حركة مرور المركبات.[14]
في الأماكن المغلقة، ينشأ التعرض لثاني أكسيد النيتروجين من أدخنة السجائر،[15] البوتان وسخانات الكيروسين والمواقد.[16]
كما يتعرض العاملون في المجال الصناعي لثاني أكسيد النيتروجين وهم عرضة للإصابة لأمراض الرئة المهنية، وقد وضع المعهد الوطني للسلامة والصحة المهنية مجموعة قيود للتعرض ومعايير للسلامة.[5] كاد رواد الفضاء في مشروع اختبار أپولو-سويوز أن يلقوا مصرعهم عندما تسرب ثاني أكسيد النيتروجين عرضياً داخل القمرة.[13] قد يتعرض المزارعون لثاني أكسيد النيتروجين الناتج عن تحلل الحبوب في الصوامع؛ قد يؤدي التعرض المزمن تلف الرئة في حالة تسمى "داء عمال الصوامع".[17][18]
تاريخياً، كان ثاني أكسيد النيتروجين ينتج أيضاً بواسطة الاختبارات النووية في الغلاف الجوي، والذي كان مسئولاً عن اللون الأحمر-البرتقالي لسحب عيش الغراب.[19]
السمية
ينتشر ثاني أكسيد النيتروجين الغازي في سائل البطانة الظهارية للظهارة التنفسية وينحل، ويتفاعل كيميائةي مع مضادات الأكسدة والجزيئات الدهنية في سائل البطانة الظهارية؛ الآثار الصحية لثاني أكسيد النيتروجين ناجمة عن منتجات التفاعل أو مستقلباتها، وهي أنواع النيتروجين التفاعلية وأنواع الأكسجين التفاعلية التي يمكنها أن تسبب ضيق القصبة الهوائية bronchoconstriction، الالتهاب، انخفاض الاستجابة المناعية، وقد يكون لها تأثير على القلب.[20]
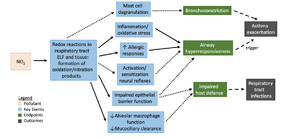

من المحتمل أن ينشأ الضرر الحاد الناجم عن التعرض لثاني أكسيد النيتروجين من الإعدادات المهنية فقط. قد يسبب التعرض المباشر للجلد تهيجاً وحروقاً. وعندما تكون تركيزات ثاني أكسيد النيتروجين الغازي عالية للغاية تسبب ضيقاً فورياً: قد تسبب 200-200 ppm تهيجاً متوسطاً للأنف والحلق، وقد تسبب 250-500 ppm الوذمات، مما يؤدي إلى الإصابة بالالتهاب الشعبي أو الرئوي، وتؤدي المستويات الأعلى من 1000 ppm إلى الوفاة نتيجة الاختناق بسوائل الرئة. وقت التعرض، لا توجد أعراض غالباً بخلاف السعال العابر أو التعب أو الغثيان، لكن على مدار ساعات يتسبب الالتهاب الرئوي في حدوث وذمة الرئة.[21][22]
بالنسبة لتعرض الجلد أو العين، تُإسل المنطقة المصابة بمحلول ملحي. وعند استنشاق ثاني أكسيد النيتروجين، يتم إعطاء الأكسجين، موسوعات الشعب، وإذا ظهرت علامات متهيموگلوبينية الدم، وهي حالة تظهر عندما تؤثر المركبات القائمة على النيتروجين على هيموگلوبين خلايا الدم الحمراء، يمكن إعطاء أزرق المثيلين.[23][24]
يُصنف ثاني أكسيد النيتروجين كمادة شديدة الخطورة في الولايات المتحدة بموجب المادة 302 من قانون التخطيط للطوارئ وحق المعرفة المجتمعي (42 U.S.C. 11002)، وهي مادة تخضع لمتطلبات الإبلاغ الصارمة من قبل المنشآت التي تنتجها أو تخزنها أو تستخدمها بكميات كبيرة.[25]
الآثار الصحية للتعرض لثاني أكسيد النيتروجين
للعامة، يؤدي التعرض المزمن لثاني أكسيد النيتروجين إلى تأثيرات على الجهاز التنفسي ومنها التهاب المسارات الهوائية لدى الأشخاص الأصحاء وزيادة الأعراض التنفسية للمصابين بالربو. يكون ثاني أكسيد النيتروجين الأوزون الذي يتسبب في تهيج العين ويزيد من تفاقم أمراض الجهاز التنفسي، مما يؤدي إلى زيادة الزيارات لأقسام الطوارئ ودخول المستشفيات بسبب مشاكل الجهاز التنفسي، وخاصة الربو.[26]
جرى فحص آثار السمية على الصحة باستخدام الاستبيانات والمقابلات الشخصية في محاولة لفهم العلاقة بين ثاني أكسيد النيتروجين والربو. إن تأثير ملوثات الهواء الداخلية على الصحة هاماً لأن غالبية الأشخاص في العالم يقضون أكثر من 80% من وقتهم في الأماكن المغلقة.[27] يعتمد مقدار الزمن الذي يقضى في الأماكن المغلقة على عوامل عدة تشمل المنطقة الجغرافية، أنشطة العمل، والنوع، وعوامل أخرى متعددة. بالإضافة إلى ذلك، نظراً لتحسن مواد العزل في المنازل، يمكن أن يؤدي ذلك إلى زيادة الاحتفاظ بملوثات الهواء الداخلية، مثل ثاني أكسيد النيتروجين.[27] فيما يتعلق بالمنطقة الجغرافية، تراوحت نسبة انتشار الربو من 2 إلى 20% مع عدم وجود إشارة واضحة إلى السبب وراء هذا التفاوت.[27] قد يكون هذا نتيجة "فرضية النظافة" أو "أسلوب الحياة الغربي" الذي يستوعب مفاهيم المنازل المعزولة جيداً وعدد السكان الأقل.[27] رصدت دراسة أخرى العلاقة بين التعرض للنيتروجين في المنزل وأعراض الجهاز التنفسي ووجدت نسبة احتمالات ذات دلالة إحصائية 2.23 (95% CI: 1.06 ،4.72) بين أولئك الذين لديهم تشخيص طبي للربو والتعرض لموقد الغاز.[28]
هناك مصدر رئيسي للتعرض الداخلي لثاني أكسيد النيتروجين وهو استخدام مواقد الغاز للطهي أو التدفئة بالمنازل. وفقاً لتعداد عام 2000، تستخدم أكثر من نصف الأسر الأمريكية مواقد الغاز[29] وتكون مستويات التعرض الداخلي لثاني أكسيد النيتروجين في المنازل، في المتوسط، أكبر ثلاثة أضعاف على الأقل مع مواقد مقارنة بالمواقد الكهربائية وتزيد المستويات مع وجود أكثر من أسرة بالمنزل. يكون التعرض لثاني أكسيد النيتروجين ضاراً بشكل خاص بالنسبة للأطفال المصابين بالربو. أظهرت الأبحاث أن الأطفال المصابين بالربو الذين يعيشون في منازل بها مواقد تعمل بالغاز هم أكر تعرضاً للإصابة بأعراض تنفسية مثل الأزيز والسعال وضيق الصدر.[28][30] بالإضافة إلى ذلك، ارتبط استخدام موقد الغاز مع انخفاض وظائف الرئة لدى الفتيات المصابات بالربو، على الرغم من عدم وجود هذا الارتباط في الأولاد.[31] قد تقلل التهوية عند تشغيل مواقد الغاز من خطر أعراض الجهاز التنفسي لدى الأطفال المصابين بالربو.
في دراسة جماعية أثجريت على أقليات من الأطفال ذوي الأصول الأفريقية-الأمريكية في بالتيمور لتحديد ما إذا كانت هناك علاقة بين ثاني أكسيد النيتروجين والربو بين الأطفال الذين تتراوح أعمارهم بين 2 و6 سنوات، مع وجود تشخيص طبي حالي للربو، وزيارة واحدة للطبيب تتعلق بالربو، كانت العائلات ذات الوضع الاجتماعي والاقتصادي المنخفض أكثر عرضة لوجود مواقد غاز في منازلهم. وخلصت الدراسة إلى أن المستويات الأعلى من ثاني أكسيد النيتروجين داخل المنزل ترتبط بمستوى أكبر من أعراض الجهاز التنفسي بين مجتمع الدراسة. يوضح هذا أيضاً أن سمية ثاني أكسيد النيتروجين خطرة على الأطفال.[32]
الآثار البيئية
تفاعل ثاني أكسيد النيتروجين وأكاسيد النيتروجين الأخرى مع الماء، الأكسجين والكيماويات الأخرى في الغلاف الجوي قد يؤدي إلى تشكل أمطار حمضية التي من شأنها أن تضر بالأنظمة البيئية الحساسة مثل البحيرات والغابات.[33] قد تؤدي المستويات المرتفعة من ثاني أكسيد النيتروجين إلى الإضرار بالغطاء النباتي، انخفاض نمو وحجم الحاصلات الزراعية.[34]
تجنب سمية ثاني أكسيد النيتروجين
أثناء استخدام موقد الغاز، يُنصح أيضاً بالتهوية. تظهر الدراسات أنه في المنازل التي تحتوي على مواقد غاز، إذا تم تهوية المكان أثناء استخدام مواقد الغاز، فإن الأطفال لديهم احتمالات أقل للربو والأزيز والتهاب الشعب الهوائية مقارنة بالأطفال في المنازل التي لم تستخدم التهوية أبداً.[35] إذا كان التهوية غير ممكنة، فقد يكون استبدال مواقد الغاز بموقد كهربائي خياراً آخر. يمكن أن يؤدي استبدال مواقد الغاز بمواقد كهربائية إلى تقليل التعرض لغاز ثاني أكسيد النيتروجين الداخلي وتحسين وظيفة الجهاز التنفسي للأطفال المصابين بالربو. من المهم الحفاظ على مواقد الغاز والسخانات في حالة جيدة حتى لا تسبب تلوثاً إضافياً بثاني أكسيد النيتروجين. يتطلب الكود الدولي للمساكن لعام 2015 استخدام أجهزة التهوية لجميع المواقد ووضع المعايير للمباني السكنية. ويتطلب هذا أن تحتوي جميع شفاطات المطابخ على فتحة تهوية في الخارج. يمكن أيضاً تجنب التعرض لثاني أكسيد النيتروجين بتجنب تدخين السجائر وعدم إبطاء سرعة السيارة كلما أمكن ذلك.[36]
القيود البيئية
وضع الوكالة الأمريكية لحماية البيئة مستويات التعرض البيئي لثاني أكسيد النيتروجين عند 100 ppb، بمتوسط أكثر من ساعة واحدة، و53 ppb للمتوسط السنوي.[7] اعتباراً من فبراير 2016، كانت جميع الأراضي الأمريكية قد امتثلت لهذه القيود وتتراوح التركيزات بين 10-20 ppb، ويقاس المتوسط السنوي المحيطي لتركيزات ثاني أكسيد النيتروجين، كما يتم قياسه في الشاشات على مستوى المنطقة، وقد انخفض بأكثر من 40% منذ عام 1980.[30]
انظر أيضاً
المصادر
- ^ "nitrogen dioxide (CHEBI:33101)". Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute. 13 January 2008. Main. Archived from the original on 4 March 2016. Retrieved 4 October 2011.
- ^ أ ب ت Haynes, 4.79.
- ^ Mendiara, S. N.; Sagedahl, A.; Perissinotti, L. J. (2001). "An electron paramagnetic resonance study of nitrogen dioxide dissolved in water, carbon tetrachloride and some organic compounds". Applied Magnetic Resonance. 20 (1–2): 275–287. doi:10.1007/BF03162326.
- ^ Haynes, 4.134.
- ^ أ ب ت ث ج NIOSH Pocket Guide to Chemical Hazards 0454
- ^ أ ب "Nitrogen dioxide". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ أ ب ت قالب:EPA content
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 455. ISBN 978-0-08-037941-8.
- ^ أ ب Holleman, A. F.; Wiberg, E. (2001) Inorganic Chemistry. Academic Press: San Diego. ISBN 0-12-352651-5.
- ^ WHO Air Quality Guidelines – Second Edition. Chapter 7.1 Nitrogen Dioxide.
- ^ Subcommittee on Emergency and Continuous Exposure Guidance Levels for Selected Submarine Contaminants; Committee on Toxicology; Board on Environmental Studies and Toxicology; Division on Earth and Life Studies; National Research Council. Chapter 12: Nitrogen Dioxide in Emergency and Continuous Exposure Guidance Levels for Selected Submarine Contaminants. National Academies Press, 2007. ISBN 978-0-309-09225-8
- ^ "Mechanism Overview, June 2012" (PDF). noxilizer.com. Noxilizer, Inc. Archived from the original (PDF) on 12 April 2016. Retrieved 2 July 2013.
- ^ أ ب Cotton, Simon (21 March 2013) Nitrogen dioxide. RSC Chemistry World.
- ^ "Air quality guidelines – global update 2005". WHO. Retrieved 2016-10-19.
- ^ US Dept. of Health and Human Services, Public Health Service, Agency for Toxic Substances and Disease Registry, Division of Toxicology. April 2002 ATSDR Nitrous Oxides.
- ^ "The Impact of Unvented Gas Heating Appliances on Indoor Nitrogen Dioxide Levels in 'TIGHT' Homes" (PDF). ahrinet.org. 2013-03-21.
- ^ Chan-Yeung, M.; Ashley, M. J.; Grzybowski, S. (1978). "Grain dust and the lungs". Canadian Medical Association Journal. 118 (10): 1271–4. PMC 1818652. PMID 348288.
- ^ Gurney, J. W.; Unger, J. M.; Dorby, C. A.; Mitby, J. K.; von Essen, S. G. (1991). "Agricultural disorders of the lung". Radiographics. 11 (4): 625–34. doi:10.1148/radiographics.11.4.1887117. PMID 1887117.
- ^ Effects of Nuclear Explosions. Nuclearweaponarchive.org. Retrieved on 2010-02-08.
- ^ أ ب U.S. EPA. Integrated Science Assessment for Oxides of Nitrogen – Health Criteria (2016 Final Report). U.S. Environmental Protection Agency, Washington, DC, EPA/600/R-15/068, 2016. Federal Register Notice Jan 28, 2016 Free download available at Report page at EPA website.
- ^ Toxnet Nitrogen dioxide: Human Health Effects Page accessed March 28, 2016.
- ^ CDC NIOSH International Chemical Safety Cards (ICSC): Nitrogen Dioxide Page last reviewed: July 22, 2015; Page last updated: July 1, 2014.
- ^ Agency for Toxic Substances and Disease Registry via the CDC Medical Management Guidelines for Nitrogen Oxides Page last reviewed: October 21, 2014; Page last updated: October 21, 2014
- ^ University of Kansas Hospital, Poison Control Center Poison Facts: Medium Chemicals: Nitrogen Dioxide Archived 2016-04-11 at the Wayback Machine page accessed March 28, 2016
- ^ "40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities" (PDF) (July 1, 2008 ed.). Government Printing Office. Archived from the original (PDF) on February 25, 2012. Retrieved October 29, 2011.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةEPAHealth - ^ أ ب ت ث Heinrich, Joachim (2011-01-01). "Influence of indoor factors in dwellings on the development of childhood asthma". International Journal of Hygiene and Environmental Health. 214 (1): 1–25. doi:10.1016/j.ijheh.2010.08.009. PMID 20851050.
- ^ أ ب Garrett, Maria H.; Hooper, Martin A.; Hooper, Beverley M.; Abramson, Michael J. (1998-09-01). "Respiratory Symptoms in Children and Indoor Exposure to Nitrogen Dioxide and Gas Stoves". American Journal of Respiratory and Critical Care Medicine. 158 (3): 891–895. doi:10.1164/ajrccm.158.3.9701084. PMID 9731022.
- ^ "Historical Census of Housing Tables -House Heating Fuel". www.census.gov. Retrieved 2016-10-19.
- ^ أ ب قالب:EPA content
- ^ Chapman, Robert S.; Hadden, Wilbur C.; Perlin, Susan A. (2003-07-15). "Influences of asthma and household environment on lung function in children and adolescents: the third national health and nutrition examination survey". American Journal of Epidemiology. 158 (2): 175–189. doi:10.1093/aje/kwg129. PMID 12851231.
- ^ Hansel, Nadia N.; Breysse, Patrick N.; McCormack, Meredith C.; Matsui, Elizabeth C.; Curtin-Brosnan, Jean; Williams, D’Ann L.; Moore, Jennifer L.; Cuhran, Jennifer L.; Diette, Gregory B. (2016-10-19). "A Longitudinal Study of Indoor Nitrogen Dioxide Levels and Respiratory Symptoms in Inner-City Children with Asthma". Environmental Health Perspectives. 116 (10): 1428–1432. doi:10.1289/ehp.11349. PMC 2569107. PMID 18941590.
- ^ US EPA, OAR (2016-07-06). "Basic Information about NO2". US EPA (in الإنجليزية). Retrieved 2020-07-03.
- ^ Queensland;, c=AU; o=The State of. "Nitrogen oxides | Air pollutants". www.qld.gov.au (in الإنجليزية). Retrieved 2020-07-03.
{{cite web}}: CS1 maint: extra punctuation (link) CS1 maint: multiple names: authors list (link) - ^ Kile, Molly L.; Coker, Eric S.; Smit, Ellen; Sudakin, Daniel; Molitor, John; Harding, Anna K. (2014-09-02). "A cross-sectional study of the association between ventilation of gas stoves and chronic respiratory illness in U.S. children enrolled in NHANESIII". Environmental Health. 13: 71. doi:10.1186/1476-069X-13-71. PMC 4175218. PMID 25182545.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ "Healthy Child Healthy World". Healthy Child Healthy World. Archived from the original on 2016-10-11. Retrieved 2016-10-19.
المراجع
- Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
وصلات خارجية
- International Chemical Safety Card 0930
- National Pollutant Inventory – Oxides of nitrogen fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- WHO-Europe reports: Health Aspects of Air Pollution (2003) (PDF) and "Answer to follow-up questions from CAFE (2004) (PDF)
- Nitrogen Dioxide Air Pollution
- Nitrogen dioxide pollution in the world (image)
- A review of the acute and long term impacts of exposure to nitrogen dioxide in the United Kingdom IOM Research Report TM/04/03
- CS1 maint: unflagged free DOI
- Short description matches Wikidata
- Articles with hatnote templates targeting a nonexistent page
- Missing redirects
- ECHA InfoCard ID from Wikidata
- Articles with changed FDA identifier
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Short description is different from Wikidata
- مبيضات
- أكاسيد
- مركبات النيتروجين غير العضوية
- ملوثات الهواء الخطرة
- ضباب دخاني
- جذور حرة
- مواد مضافة غذائية
- Gases with color
- مركبات النيتروجين-الأكسجين