پروكسيد الصوديوم

| |
| |

| |
| الأسماء | |
|---|---|
| أسماء أخرى
ثاني أكسيد الصوديوم الثنائي
Flocool Solozone ثاني پروكسيد الصوديوم | |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
| رقم EC |
|
PubChem CID
|
|
| رقم RTECS |
|
| UN number | 1504 |
| |
| الخصائص | |
| الصيغة الجزيئية | Na2O2 |
| كتلة مولية | 77.98 g/mol |
| المظهر | yellow to white powder |
| الكثافة | 2.805 g/cm3 |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | يتفاعل بعنف |
| قابلية الذوبان | قابل للذوبان في القواعد غير قابل للذوبان في القواعد يتفاعل مع إيثانول |
| القابلية المغناطيسية | −28.10·10−6 cm3/mol |
| البنية | |
| البنية البلورية | hexagonal |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
−515 kJ·mol−1[1] |
| Standard molar entropy S |
95 J/(mol·K)[1] |
| سعة الحرارة النوعية، C | 89.37 J/(mol·K) |
| المخاطر | |
| صفحة بيانات السلامة | External MSDS |
تبويب الاتحاد الاوروپي (DSD)
|
 O O
|
| توصيف المخاطر | R8, R35 |
| تحذيرات وقائية | (S1/2), قالب:S8, S27, S39, S45 |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | Non-flammable |
| مركبات ذا علاقة | |
كاتيونات أخرى
|
پروكسيد الليثيوم پروكسيد الپوتاسيوم پروكسيد الروبيديوم پروكسيد السيزيوم |
| أكسيد الصوديوم سوپر أكسيد الصوديوم | |
مركـّبات ذات علاقة
|
هيدروكسيد الصوديوم پروكسيد الهيدروجين |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
پروكسيد الصوديوم Sodium peroxide هو مركب غير عضوي صيغته Na2O2. هذه المادة الصلبة المصفرّة هي ناتج من صوديوم مُشعـَل في أكسجين مفرط.[3] وهي قاعدية قوية. وهذا الپروكسيد الفلزي يتواجد في العديد من الهيدرات و الپيروكسيهيدرات بما فيهم Na2O2·2H2O2·4H2O, Na2O2·2H2O, Na2O2·2H2O2، و Na2O2·8H2O.[4] الهيدرات الثـُمانية، التي يمكن ببساطة تحضيرها، ولونها أبيض، بالتناقض مع المادة اللامائية.[5]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخصائص
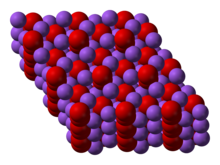
يتبلور پروكسيد الصوديوم بتماثل سداسي الأضلع.[6] Upon heating, the hexagonal form undergoes a transition into a phase of unknown symmetry at 512 °C.[7] وبمزيد من التسخين فوق نقطة الغليان 657 °س، يتحلل المركب إلى Na2O, releasing O2.[8]
- 2 Na2O2 → 2 Na2O + O2
التحضير
الهيدرات الثـُمانية is produced by treating sodium hydroxide with hydrogen peroxide.[5]
Sodium peroxide can be prepared on a large scale by the reaction of metallic sodium with oxygen at 130–200 °C, a process that generates sodium oxide, which in a separate stage absorbs oxygen:[7][9]
- 4 Na + O2 → 2 Na2O
- 2 Na2O + O2 → 2 Na2O2
كما يمكن انتاجه بتمرير غاز الأوزون فوق يوديد الصوديوم الصلب داخل أنبوب من الپلاتين أو الپلاديوم. فالأوزون يؤكسد الصوديوم ليشكل پروكسيد الصوديوم. اليود can be sublimed بالتسخين الهادئ. الپلاتين أو الپلاديوم يحفزان التفاعل ولا يهاجمهما پروكسيد الصوديوم.
الاستخدامات
پروكسيد الصوديوم يتحلل مائياً ليعطي هيدروكسيد الصوديوم وپروكسيد الهيدروجين حسب التفاعل:[9]
- Na2O2 + 2 H2O → 2 NaOH + H2O2
پروكسيد الصوديوم كان يُستخدم في شطف لب الخشب لانتاج الورق والأنسجة. وحالياً فإنه يُستخدم بشكل رئيسي في العمليات المعملية المتخصصة، مثل استخلاص المعادن من المواد الخام المختلفة. وقد يُسمى پروكسيد الصوديوم بالأسماء التجارية Solozone[7] and Flocool.[8] في تحضيرات الكيمياء، يُستخدم پروكسيد الصوديوم كعامل مؤكسد. كما يُستخدم كمصدر للأكسجين بجعله يتفاعل مع ثاني أكسيد الكربون لانتاج الأكسجين وكربونات الصوديوم؛ ولذلك فإنه مفيد بشكل خاص في معدات الغطس والغواصات ، إلخ. پروكسيد الليثيوم له استخدامات مماثلة.
2Na2O2 + 2CO2 → 2Na2CO3 + O2
المراجع
- ^ أ ب Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A23. ISBN 0-618-94690-X.
- ^ http://www.nmsu.edu/safety/programs/chem_safety/NFPA-ratingS-Z.htm
- ^ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. p. 98. ISBN 978-0-08-022057-4.
- ^ Harald Jakob, Stefan Leininger, Thomas Lehmann, Sylvia Jacobi, Sven Gutewort "Peroxo Compounds, Inorganic" Ullmann's Encyclopedia of Industrial Chemistry, 2007, Wiley-VCH, Weinheim. doi:10.1002/14356007.a19_177.pub2.
- ^ أ ب "Potassium Sodium Peroxide 8-Hydrate". Inorg. Synth. 3: 1–4. 1950. doi:10.1002/9780470132340.ch1.
{{cite journal}}: Cite uses deprecated parameter|authors=(help) - ^ Tallman, R. L.; Margrave, J. L.; Bailey, S. W. (1957). "The Crystal Structure Of Sodium Peroxide". J. Am. Chem. Soc. 79 (11): 2979–80. doi:10.1021/ja01568a087.
- ^ أ ب ت Macintyre, J. E., ed. Dictionary of Inorganic Compounds, Chapman & Hall: 1992.
- ^ أ ب Lewis, R. J. Sax's Dangerous Properties of Industrial Materials, 10th ed., John Wiley & Sons, Inc.: 2000.
- ^ أ ب E. Dönges "Lithium and Sodium Peroxides" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 979.
