أكسيد النحاس الأحادي

| |
| |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Copper(I) oxide
| |
| أسماء أخرى | |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.013.883 |
| رقم EC |
|
PubChem CID
|
|
| رقم RTECS |
|
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | Cu2O |
| كتلة مولية | 143.09 g/mol |
| المظهر | brownish-red solid |
| الكثافة | 6.0 g/cm3 |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | Insoluble |
| قابلية الذوبان في acid | Soluble |
| الفجوة الحزمية | 2.137 eV |
| البنية | |
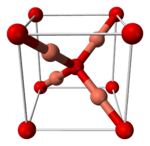
| البنية البلورية | cubic |
| المخاطر | |
تبويب الاتحاد الاوروپي (DSD)
|
Harmful (Xn) Dangerous for the environment (N) |
| توصيف المخاطر | R22, R50/53 |
| تحذيرات وقائية | (S2), S22, S60, قالب:61 |
| NFPA 704 (معيـَّن النار) | |
| مركبات ذا علاقة | |
أنيونات أخرى
|
كبريتيد النحاس الأحادي ثاني كبريتيد النحاس سيلينيد النحاس الأحادي |
كاتيونات أخرى
|
ثاني أكسيد النحاس أحادي أكسيد الفضة ثاني أكسيد النيكل أكسيد الزنك |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
أكسيد النحاس الأحادي Copper(I) oxide هو مركب كيميائي له الصيغة Cu2O ، ويكون على شكل مسحوق بلوري ذي لون أحمر إلى بني وذلك حسب طريقة التحضير وكبر حجم البلورات. وهو مكون في بعض الدهانات المقاومة للحشف الحيوي. The compound can appear either yellow or red, depending on the size of the particles.[1] يتواجد أكسيد النحاس الأحادي بشكل معدن كوپريت مائل للحمرة.
التحضير
يحضر مركب أكسيد النحاس الأحادي من أثر القلوي على محاليل أملاح النحاس الأحادي حسب المعادلة العامة:
- 2Cu + + 2OH - → [2CuOH] → 2Cu2O ↓ + H2O
Copper(I) oxide may be produced by several methods.[2] Most straightforwardly, it arises via the oxidation of copper metal:
- 4 Cu + O2 → 2 Cu2O
Additives such as water and acids affect the rate of this process as well as the further oxidation to copper(II) oxides. It is also produced commercially by reduction of copper(II) solutions with sulfur dioxide.
التفاعلات
Aqueous cuprous chloride solutions react with base to give the same material. In all cases, the color is highly sensitive to the procedural details.

Formation of copper(I) oxide is the basis of the Fehling's test and Benedict's test for reducing sugars. These sugars reduce an alkaline solution of a copper(II) salt, giving a bright red precipitate of Cu2O.
It forms on silver-plated copper parts exposed to moisture when the silver layer is porous or damaged. This kind of corrosion is known as red plague.
Little evidence exists for copper(I) hydroxide CuOH, which is expected to rapidly undergo dehydration. A similar situation applies to the hydroxides of gold(I) and silver(I).
الخواص
- حالة أكسدة النحاس في هذا المركب +1 كما يشير الاسم.
- مركب أكسيد النحاس الأحادي غير منحل عملياً في الماء، لكنه ينحل في محلول الأمونياك. ينحل أيضاً في حمض هيدروكلوريك مشكلاً كلوريد النحاس الأحادي.
- يتأكسد أكسيد النحاس الأحادي بفعل أكسجين الهواء الرطب إلى هيدروكسيد النحاس الثنائي حسب المعادلة:
- Cu2O + 1/2 O2 + 2H2O → 2Cu(OH)2
في حين أنه يكون مقاوما لفعل الأكسدة في الهواء الجاف.
- بتفاعله مع حمض النتريك أو حمض الكبريتيك يشكل أكسيد النحاس الأحادي الملح الموافق للنحاس الثنائي، وينتج لدينا النحاس الفلزي حسب المعادلة:
- Cu2O + 2HNO3 → Cu(NO3)2 + Cu + H2O
الاستخدامات
- يستخدم في الكيمياء التحليلية من أجل الكشف عن السكر باختبار فهلنگ، حيث يقوم السكر باختزال النحاس الثنائي إلى أحادي، حيث أن وجود أيونات النحاس الأحادي في الأوساط القلوية يؤدي إلى ترسب أكسيد النحاس الأحمر كما تشير طريقة التحضير.
- يستخدم كخضاب أحمر في صناعة الزجاج والسيراميك.
Cuprous oxide is commonly used as a pigment, a fungicide, and an antifouling agent for marine paints. Rectifier diodes based on this material have been used industrially as early as 1924, long before silicon became the standard. Copper(I) oxide is also responsible for the pink color in a positive Benedict's test.
In December 2021, Toshiba announced the creation of a transparent cuprous oxide (Cu2O) thin-film solar cell. The cell achieved an 8.4% energy conversion efficiency, the highest efficiency ever reported for any cell of this type as of 2021. The cells could be used for high-altitude platform station applications and electric vehicles.[3]
مركبات مماثلة
An example of natural copper(I,II) oxide is the mineral paramelaconite, Cu4O3 or CuI2CuII2O3.[4][5]
المصادر
- Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
- [1]
وصلات خارجية
| Copper(I) oxide
]].- National Pollutant Inventory: Copper and compounds fact sheet
- Chemical Land21 Product Information page
- Make a solar cell in your kitchen
- A Flat Panel Solar Battery
- Cu2O project page
- ^ N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- ^ H. Wayne Richardson "Copper Compounds in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a07_567
- ^ Bellini, Emiliano (2021-12-22). "Toshiba claims 8.4% efficiency for transparent cuprous oxide solar cell". pv magazine. Retrieved 2021-12-22.
- ^ "Paramelaconite".
- ^ "List of Minerals". 21 March 2011.
