أميد الليثيوم

| |
 | |
| الأسماء | |
|---|---|
| اسم أيوپاك
Lithium amide
| |
| أسماء أخرى
Lithium azanide
Lithamide | |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.029.062 |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | H2LiN |
| كتلة مولية | 22.96 g mol-1 |
| المظهر | white solid |
| الكثافة | 1.178 g/cm3 |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | يتفاعل |
| قابلية الذوبان | قابل للذوبان قليلاً في الإيثانول لا يذوب في الأمونيا |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
-182 kJ/mol |
| المخاطر | |
| NFPA 704 (معيـَّن النار) | |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
Lithium amide or lithium azanide is an inorganic compound with the chemical formula LiNH
2. It is a white solid with a tetragonal crystal structure.[1] Lithium amide can be made by treating lithium metal with liquid ammonia:[2]
- 2 Li + 2 NH
3 → 2 LiNH
2 + H
2
أميدات الليثيوم الأخرى
The conjugate bases of amines are known as amides. Thus, a lithium amide may also refer to any compound in the class of the lithium salt of an amine. These compounds have the general form LiNR
2, with the chemical lithium amide itself as the parent structure. Common lithium amides include lithium diisopropylamide (LDA), lithium tetramethylpiperidide (LiTMP), and lithium hexamethyldisilazide (LiHMDS). They are produced by the reaction of Li metal with the appropriate amine:
- 2 Li + 2 R
2NH → 2 LiNR
2 + H
2
Lithium amides are very reactive compounds. Specifically, they are strong bases.
Examples
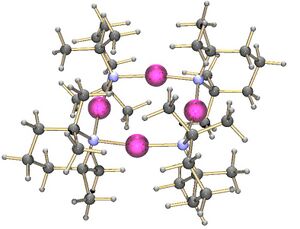
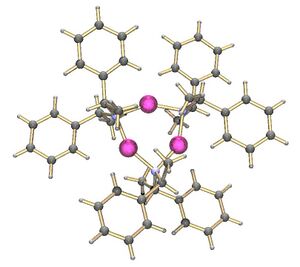
Lithium tetramethylpiperidide has been crystallised as a tetramer.[3] On the other hand, the lithium derivative of bis(1-phenylethyl)amine crystallises as a trimer:[4]
It is also possible to make mixed oligomers of metal alkoxides and amides.[5] These are related to the superbases which are mixtures of metal alkoxides and alkyls. The cyclic oligomers form when the nitrogen of the amide forms a sigma bond to a lithium while the nitrogen lone pair binds to another metal centre.
Other organolithium compounds (such as BuLi) are generally considered to exist in and function via high-order, aggregated species.
انظر أيضاً
المراجع
- ^ David, William I. F.; Jones, Martin O.; Gregory, Duncan H.; Jewell, Catherine M.; Johnson, Simon R.; Walton, Allan; Edwards, Peter P. (2007-02-01). "A Mechanism for Non-stoichiometry in the Lithium Amide/Lithium Imide Hydrogen Storage Reaction". Journal of the American Chemical Society. 129 (6): 1594–1601. doi:10.1021/ja066016s. ISSN 0002-7863.
- ^ P. W. Schenk (1963). "Lithium amide". In G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry, 2nd Ed. Vol. 1. NY,NY: Academic Press. p. 454.
- ^ M.F. Lappert; M.J. Slade; A. Singh; J.L. Atwood; R.D. Rogers; R. Shakir (1983). "Structure and reactivity of sterically hindered lithium amides and their diethyl etherates: crystal and molecular structures of [Li{N(SiMe3)2}(OEt2)]2 and tetrakis(2,2,6,6-tetramethylpiperidinatolithium)". Journal of the American Chemical Society. 105 (2): 302–304. doi:10.1021/ja00340a031.
- ^ D.R. Armstrong; K.W. Henderson; A.R. Kennedy; W.J. Kerr; F.S. Mair; J.H. Moir; P.H. Moran; R. Snaith (1999). "Structural studies of the chiral lithium amides [{PhC(H)Me}2NLi] and [PhCH2{PhC(H)Me}NLi·THF] derived from α-methylbenzylamine". Dalton Transactions: 4063–4068. doi:10.1039/A904725E.
- ^ K.W. Henderson, D.S. Walther & P.G. Williard (1995). "Identification of a Unimetal Complex of Bases by 6Li NMR Spectroscopy and Single-Crystal Analysis". Journal of the American Chemical Society. 117 (33): 8680–8681. doi:10.1021/ja00138a030.
- Merck Index, 11th Edition, 5398.