أول أكسيد الكبريت
|
| |||
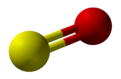
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
أول أكسيد الكبريت[بحاجة لمصدر]
| |||
| اسم أيوپاك النظامي
Oxidosulfur[1] | |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| مرجع بايلستاين | 7577656 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| مرجع Gmelin | 666 | ||
| عناوين مواضيع طبية MeSH | |||
PubChem CID
|
|||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | SO | ||
| كتلة مولية | 48.064 g mol−1 | ||
| المظهر | غاز عديم اللون | ||
| قابلية الذوبان في الماء | يتفاعل | ||
| log P | 0.155 | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
5.01 ك.ج مول−1 | ||
| Standard molar entropy S |
221.94 ك.ج−1 مول−1 | ||
| مركبات ذا علاقة | |||
مركـّبات ذات علاقة
|
Triplet oxygen | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
أول أكسيد الكبريت Sulfur monoxide، هو مركب غير عضوي صيغته SO. ويوجد فقط في الحالة الغازية المخففة. عند تكثيفه أو تركيزه، يتحول إلى S2O2 (ثاني أكسيد الكبريت). تم اكتشافه في الفضاء ولكن نادرًا ما يتم مصادفته في حالته الطبيعية.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
البنية والتركيب
يحتوي أول أكسيد الكبريت على حالة أرضية ثلاثية مشابهة لـ O2، أي أن كل جزيء يحتوي على إلكترونين غير مزاوجين.[2] تمتد رابطة S−O بطول 148.1 pm التي تشبه الرابطة الموجودة في [[منخفض أكاسيد الكبريت] (أي S8O، S−O = 148 pm) لكنها أطول من رابطة S−O في S2O (146 pm)، SO2 (143.1 pm) وSO3 (142 pm).[2]
التحضير والتفاعلات
تحضير أول أكسيد الكبريت ككاشف في التخليق العضوي يتركز حول استخدام المركبات "الطاردة" لأول أكسيد الكبريت. وتشمل الأمثلة انحلال جزيء أكسيد-1 الثيران البسيط نسبياً:[3] بالإضافة لأمثلة أكثر تعقيداً، مثل أكسيد ثلاثي الكبريت، C10H6S3O،[4]
- C2H4OS → C2H4 + SO
التواجد
الكيمياء العضوية
معايير السلامة
ثاني أكسيد الكبريت الثنائي

المصادر
- ^ "sulfur monoxide (CHEBI:45822)". Chemical Entities of Biological Interest. UK: European Bioinformatics Institute.
- ^ أ ب Greenwood, N. N. (1997). Chemistry of the Elements (2nd Edition ed.). Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
{{cite book}}:|edition=has extra text (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ Sulfur Monoxide Chemistry. The Nature of SO from Thiirane Oxide and the Mechanism of Its Reaction with Dienes Chao P., Lemal D. M. Journal of the American Chemical Society 95,3: (1973) 920 DOI:10.1021/ja00784a049
- ^ A novel recyclable sulfur monoxide transfer reagent. Grainger RS, Procopio A, Steed JW. Org Lett. 2001 3(22), 3565-8.