كولسترول
| |
| |
| |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Cholest-5-en-3β-ol
| |
| اسم أيوپاك المفضل
(1R,3aS,3bS,7S,9aR,9bS,11aR)-9a,11a-Dimethyl-1-[(2R)-6-methylheptan-2-yl]-2,3,3a,3b,4,6,7,8,9,9a,9b,10,11,11a-tetradecahydro-1H-cyclopenta[a]phenanthren-7-ol | |
| أسماء أخرى
الكولسترين، كحول الكولسترول[1]
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.000.321 |
| KEGG | |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
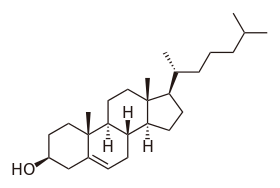
| الصيغة الجزيئية | C27H46O |
| كتلة مولية | 386.65 g/mol |
| المظهر | مسحوق بلوري أبيض[2] |
| الكثافة | 1.052 گ/سم3 |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 0.095 ملگ/ل (30 °س)[1] |
| قابلية الذوبان | قابل للذوبان في الأسيتون، البنزين، الكلوروفورم، الإيثانول، الإيثر، الهكسان، ميريستات الإيزوپروپيل، الميثانول |
| القابلية المغناطيسية | -284.2·10−6 سم3/مول |
| المخاطر | |
| نقطة الوميض | 209.3 ±12.4 °س |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
| أنواع الدهون في الغذاء |
|---|
| انظر أيضاً |
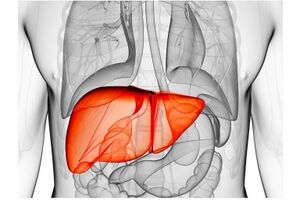
الكولسترول (إنگليزية: Cholestrol)، هو أي فئة من الجزيئات العضوية المحددة المسماة بالدهون. وهو نوع من الدهون يسمى السترول (أو السترويد المعدل.[3][1] يُخلق الكولسترول حيوياً بواسطة جميع الخلايا الحيوانية وهومكون هيكلي أساسي في الأغشية الحيوانية الحيوانية. عند عزله كيميائياً، يأخذ الشكل الصلب البلوري المائل للصفرة.
كما يعمل الكولسترول كمركب طليعي للتخليق الحيوي للهرمونات السترويدية، العصارة المرارية[4] وڤيتامين د. الكولسترول هو سترول أساسي تخلقه جميع الحيوانات. في الفقاريات، تنتج الخلايا الكبدية معظم الكولسترول في الدم. وهو غير موجود بين بدائيات النوى (البكتيريا والعتائق)، على الرغم من وجود بعض الاستثناءات، مثل "الميكروپلازما"، التي يتطلب نموها وجود الكولسترول.[5]
كان فرانسوا پوليتيه دو لا سال هو أول من تعرف على الكولسترول بشكله الصلب في الحصوات المرارية عام 1769. إلا أنه لم يُطلق عليه اسماً حتى عام 1815 عندما أطلق عليه الكيميائي ميشيل أوجين شڤرول اسم مركب "الكولسترين".[6][7]
التسمية
كلمة كولسترول مشتقة من اليونانية القديمةchole- 'عصارة المرارة' وstereos 'صلبة'، تليها اللاحقة الكيميائية -ol في إشارة إلى الكحول.
الفسيولوجيا
يعتبر الكولسترول ضروريًا لجميع أنواع الحياة الحيوانية، حيث تستطيع كل خلية تصنيعه من خلال عملية معقدة تتكون من 37 خطوة. يبدأ هذا بالمڤالونات أو مسار اختزال HMG-CoA، وهو الهدف من الستاتينات، والذي يشمل الخطوات الثمانية عشر الأولى. يتبع ذلك 19 خطوة إضافية لتحويل اللانوسترول الناتج إلى كولسترول.
يقوم الذكر البشري الذي يزن 68 كجم بتصنيع حوالي 1 جرام (1000 ملجم) من الكولسترول يوميًا، ويحتوي جسمه على حوالي 35 جم، معظمها موجود داخل أغشية الخلايا. المدخول الغذائي اليومي المعتاد من الكولسترول للرجل في الولايات المتحدة هو 307 ملجم.[8]
معظم الكوليسترول الذي يتم تناوله مؤستر، مما يؤدي إلى امتصاص القناة الهضمية له. يعوض الجسم أيضًا عن امتصاص الكولسترول المبتلع عن طريق تقليل تكوين الكولسترول الخاص به.[9]
لهذه الأسباب، فإن الكولسترول الموجود في الطعام، بعد سبع إلى عشر ساعات من تناوله، له تأثير ضئيل، إن وجد، على تركيزات الكولسترول في الدم.[10] ومع ذلك، خلال الساعات السبع الأولى بعد تناول الكولسترول، حيث يتم توزيع الدهون الممتصة في جميع أنحاء الجسم داخل المياه خارج الخلية بواسطة مختلف الپروتينات الدهنية (الذي ينقل جميع الدهون في الماء خارج الخلايا)، تزداد التركيزات.[11]
تصنع النباتات الكولسترول بكميات صغيرة للغاية.[12] لكنها تنتج كميات أكبر من الفايتوستيرول (الستيرول النباتي)، مواد متشابهة كيميائيًا يمكن أن تتنافس مع الكولسترول لإعادة الامتصاص في الأمعاء، مما يؤدي إلى تقليل إعادة امتصاص الكولسترول.[13] عندما تمتص خلايا بطانة الأمعاء الفايتوستيرول، بدلاً من الكولسترول، فإنها عادةً ما تفرز جزيئات فايتوستيرول مرة أخرى إلى الجهاز الهضمي، وهي آلية وقائية هامة. يتراوح تناول الفايتوستيرول الطبيعي، والذي يشمل الستيرول والستانول النباتي بين -200-300 ملگ/يومياً اعتمادًا على عادات الأكل.[14] هناك وجبات نباتية تجريبية مصممة خصيصاً وتنتج ما يزيد عن 700 ملگ/يومياً.[15]
الوظيفة
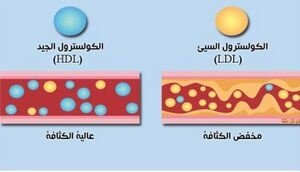
يصنع جسم الإنسان أغلب كميات الكولسترول التي يحتاجه فيما توفر التغذية الباقي، ويُنتج بشكل رئيسي في الكبد والأمعاء وينقل في پلازما الدم بواسطة جسيمات البروتينات الدهنية. تقوم الپروتينات الدهنية منخفضة الكثافة (LDL) بحمل الكولسترول من الكبد إلى باقي أعضاء الجسم فيما تقوم الپروتينات الدهنية مرتفع الكثافة (HDL) بإرجاعه لتقويضه.
يفترض حالياً أن إرتفاع نسبة الكولسترول في الدم، والذي يمكن أن ينتج عن عوامل غذائية ووراثية، هو السبب الرئيسي في أمراض تصلب الشرايين. تساهم هذه الظاهرة في خطر الإصابة بإحتشاء قلبي (ذبحة صدرية) أو السكتة الدماغية نتيجة لتكون خثرة دموية. وتلعب الپروتينات الدهنية منخفضة الكثافة (LDL) دورا رئيسيا في تصلب الشرايين حيث أن إرتفاعها عن حد معين يسمى في الأوساط السريرية بإرتفاع "الكولسترول الضار". فيما يمثل إرتفاع نسبة الپروتينات الدهنية مرتفع الكثافة (HDL) درجة من الحماية ضد هذه الأمراض، لذلك يقال أنها "الكولسترول المفيد".
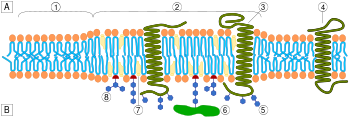
الأغشية
يؤلف الكوليسترول حوالي 30% من جميع الأغشية الخلوية الحيونية. وهو طلوب لبناء الأغشية والحفاظ عليها وتعديل سيولة الغشاء على مدى درجات الحرارة الفسيولوجية. تتفاعل مجموعة هيدروكسيل لكل جزيء كولسترول مع جزيئات الماء المحيطة بالغشاء، كما تفعل الرؤوس القطبية لأغضية الدهون الفسفورية والسفينجولية، بينما تُضمن سلسلة الستيرويد والهيدروكربون الضخمة في الغشاء، جنبًا إلى جنب مع سلسلة الأحماض الدهنية غير القطبية من الدهون الأخرى. من خلال التفاعل مع سلاسل الأحماض الدهنية الفسفورية، يزيد الكولسترول من تغليف الغشاء، مما يغير سيولة الغشاء[16] ويحافظ على سلامة الغشاء بحيث لا تحتاج الخلايا الحيوانية لبناء جدران خلوية (مثل النباتات ومعظم الجراثيم). يظل الغشاء مستقرًا ومتينًا دون أن يكون صلبًا، مما يسمح للخلايا الحيوانية بتغيير شكلها وتحرك الحيوانات.
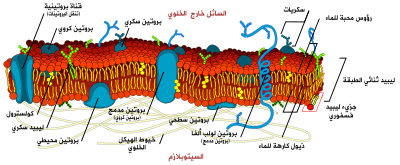
يساهم هيكل الكولسترول رباعي الحلقة في سيولة غشاء الخلية، حيث أن الجزيء في شكل "متحول" يجعل الكل باستثناء السلسلة الجانبية للكولسترول صلبة ومستوية.[17]
في هذا الدور الهيكلي، يقلل الكولسترول أيضًا من نفاذية غشاء الپلازما إلى مواد محايدة،[18] أيونات الهيدروجين وأيونات الصوديوم.[19]
عرض الركيزة
ينظم الكولسترول عملية عرض الركيزة الحيوية والإنزيمات التي تستخدم عرض الركيزة كآلية لتنشيطها. (PLD2) هو مثال واضح لإنزيم يُنشط عن طريق عرض الركيزة.[20]
يكون الإنزيم palmitoylated مما يتسبب في انتقال الإنزيم إلى المجالات الدهنية المعتمدة على الكولسترول والتي تسمى أحيانًا "أطواف الدهون". ركيزة الفوسفولايپيز د هي فسفاتيدايلكولين (PC) وتكون غير مشبعة وذات وفرة منخفضة في أطواف الدهون. يستقر الفسفاتيدايلكولين في المنطقة المضطربة للخلية جنبًا إلى جنب مع فوسفاتيديلينوسيتول 4،5-بيسفوسفات (PIP2) وهي دهون متعددة غير مشبعة. PLD2 له نطاق ارتباط يسمى PIP2. عندما يزداد تركيز PIP2 في الغشاء، يترك PLD2 النطاقات المعتمدة على الكولسترول ويرتبط بـ PIP2 حيث يكتسب بعد ذلك الوصول إلى الفسفاتيدايلكولين الخاص به الركيزة ويبدأ التحفيز بناءً على عرض الركيزة.

التأشير
يرتبط الكولسترول أيضاً بعمليات إرسال الإشارات الخلوية، مما يساعد في تكوين الطوافات الدهنية في غشاء الپلازما، مما يجعل پروتينات المستقبل قريبة جدًا من التركيزات العالية لجزيئات المرسل الثاني.[21]
في الطبقات المتعددة، يمكن للكولسترول والدهون الفوسفورية، وكلاهما من العوازل الكهربائية، تسهيل سرعة انتقال النبضات الكهربائية على طول الأنسجة العصبية. بالنسبة للعديد من ألياف الخلايا العصبية، يوفر غمد المايلين الغني بالكولسترول لأنه مشتق من طبقات مضغوطة من خلية شوان أو أغشية الخلايا قليلة التغصن، مما يوفر عزلًا لتوصيل النبضات بكفاءة أكبر.[22] إزالة المايلين (فقدان المايلين) يُعتقد أنه جزء من أساس التصلب المتعدد.
يرتبط الكولسترول بعدد من القنوات الأيونية ويؤثر على بواباتها مثل [[مستقبلات الأستايلكولين النيكوتينية]]، GABAA receptor، وقناة أيون الپوتاسيوم الداخلي المعدل.[23] كما ينشط الكولسترول ألفا-المستقبل المرتبط بالإستروجين (ERRα)، وقد يكون ربيطة داخلية المنشأ للمستقبل.[24][25] يمكن تفسير الطبيعة النشطة التأسيسية للمستقبلات من خلال حقيقة أن الكولسترول موجود في كل مكان في الجسم.[25] تثبيط تأشير ERRα عن طريق خفض إنتاج الكولسترول، تحدد باعتباره الوسيط الرئيسي لتأثيرات الستاتين والبايفوسفونيت على العظام والعضلات وخلايا الدم البيضاء.[24][25] على أساس هذه النتائج، اقترح أنه يجب التخلص من ERRα وتصنيفه كمستقبل للكولسترول.[24][25]
الطلائع الكيميائية
داخل الخلايا، يعتبر الكولسترول أيضًا جزيء طليعي للعديد من المسارات الكيميائية الحيوية. على سبيل المثال هو الجزيء الطليعي لتخليق ڤيتامين د في استقلاب الكالسيوم وجميع الهرمونات الستيرويدية، بما في ذلك هرمونات الكورتيزول والألدوستيرون في الغدة الكظرية وكذلك الهرمونات الجنسية الپروجسترون والإستروجين و التستوستيرون ومشتقاتها.[4][26]
البشرة
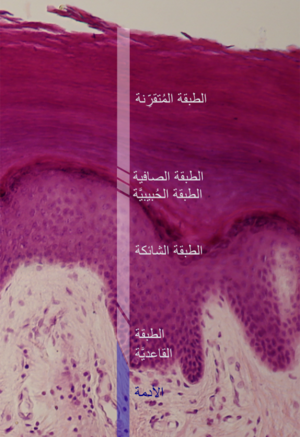
الطبقة القرنية هي الطبقة الخارجية من البشرة.[27][28] وهي تتألف من خلايا قرنية متباينة في نهايتها تتواجد داخل مصفوفة دهنية، مثل "الطوب والملاط".[27][28]
جنبا إلى جنب مع السيراميد والأحماض الدهنية الحرة، يشكل الكولسترول ملاطاً دهنياً، وهو حاجز غير منفذ للماء يمنع فقدان الماء التبخيري. كقاعدة عامة، تتكون مصفوفة دهون البشرة من خليط متساوي المولي من السيراميد (حوالي 50% من الوزن)، والكولسترول (حوالي 25% من الوزن)، والأحماض الدهنية الحرة (~ 15% من الوزن)، مع وجود كميات أصغر من الدهون الأخرى أيضاً.[27][28]
تصل كبريتات الكولسترول إلى أعلى تركيزاتها في الطبقة الحبيبية للبشرة. ثم يقللSteroid sulfate sulfatase تركيزه في الطبقة القرنية، أي الطبقة الخارجية من البشرة.[29] تختلف الوفرة النسبية لكبريتات الكولسترول في البشرة باختلاف مواقع الجسم حيث يكون كعب القدم أقل تركيزاً.[28]
الاستقلاب
الكوليسترول هي مادة معاد تدويرها في الجسم. يفرز الكبد الكولسترول في السوائل الصفراوية، والتي تُخزن بعد ذلك في المرارة، والتي تفرزها لاحقاً في شكل غير إستيري مضاف (عبر الصفراء) في الجهاز الهضمي. عادة، يُمتص حوالي 50% من الكولسترول المفرز عن طريق الأمعاء الدقيقة مرة أخرى في مجرى الدم.[30]
التخليق الحيوي والتنظيم
التخليق الحيوي
جميع الخلايا الحيوانية (هناك استثناءات داخل اللافقاريات) تصنع الكولسترول، لكل من بنية الغشاء والاستخدامات الأخرى، مع معدلات إنتاج نسبية تختلف حسب نوع الخلية ووظيفة العضو. يحدث حوالي 80% من إجمالي إنتاج الكولسترول اليومي في الكبد والأمعاء؛[31] تشمل المواقع الأخرى ذات معدلات التخليق الأعلى المخ والغدة الكظرية والأعضاء التناسلية.
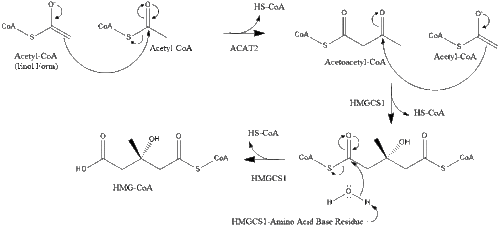
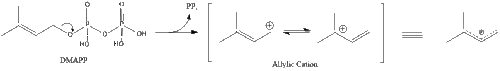
يبدأ التخليق داخل الجسم بمسار المڤالونات حيث يتكثف جزيئين من أستيل كوا لتكوين أسيتوأسيتيل-كوا. يتبع ذلك تكثيف ثانٍ بين أستيل كوا و أسيتوأستيل-كوا لتشكيل 3-hydroxy-3-methylglutaryl CoA (HMG-CoA).[32]
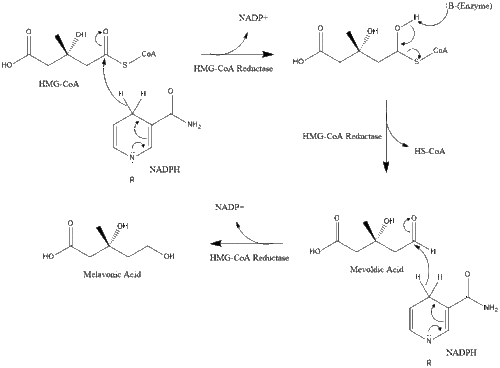
ثم يختزل هذا الجزيء إلى مڤالونات بواسطة الإنزيم HMG-CoA reductase. إن إنتاج المڤالونات هو خطوة غير قابلة للانعكاس لتحديد المعدل في تخليق الكولسترول وهو موقع عمل الستاتينات (فئة من العقاقير الخافضة للكولسترول).
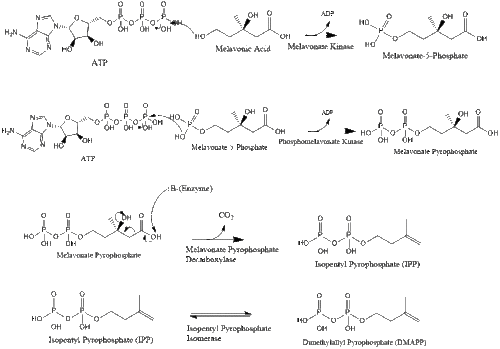
تُحول المڤالونات في النهاية إلى فوسفات الأيزوپنتيل (IPP) من خلال خطوتين من الفسفرة وخطوة نزع الكربوكسيل تتطلب ATP.]]
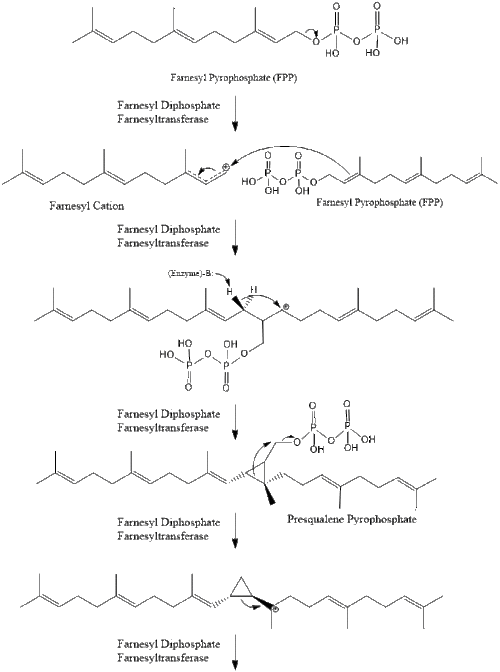
تتكثف ثلاثة جزيئات من پيروفوسفات الأيزوپنتنيل لتكوين پيروفوسفات الفارنسيل من خلال عمل geranyl transferase.
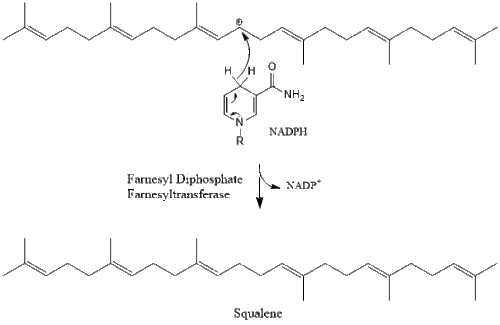
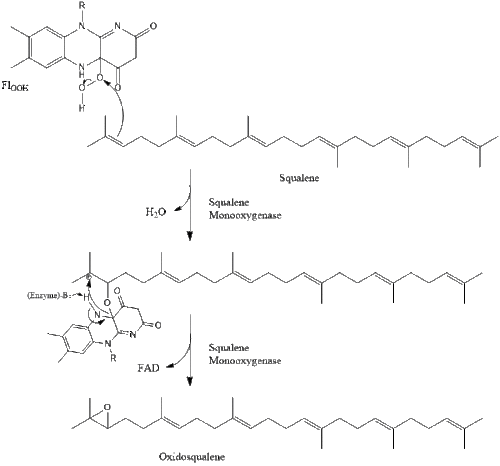
ثم يتكثف جزيئين من پيروفوسفات الفارنسيل لتشكيل السكوالين من خلال عمل سينثاز السكوالين في الشبكة الإندوپلازمية.[32]
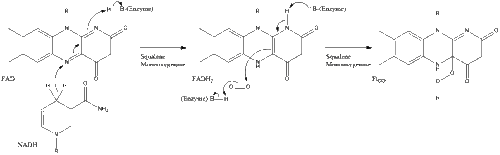
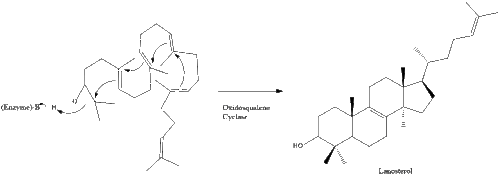
ثم يتحلل السكوالين إلى سيكلاز أوكسيدوسكوالين لتشكيل اللانوسترول.
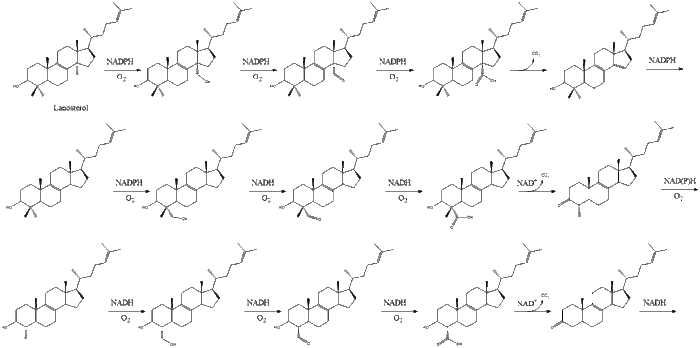
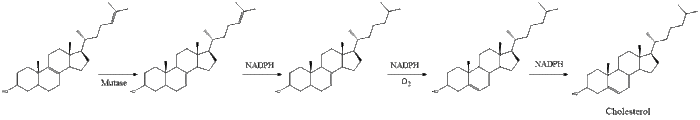
أخيراً، يتحول اللانوسترول إلى كولسترول عبر أي من المسارين، مسار بلوخ، أو مسار كاندوتش-رسل.[33][34][35][36][37]
تحتوي الخطوات التسعة عشر الأخيرة للكولسترول على NADPH وأكسجين للمساعدة في أكسدة مجموعة الميثيل لإزالة الكربون، وطفرة لتحريك مجموعات ألكين، وNADH للمساعدة في تقليل الكيتونات.
عام 1964 تقاسم كونراد بلوخ وفيودور لينن جائزة نوبل في الطب عام 1964 لاكتشافاتهم المتعلقة ببعض آليات وطرق تنظيم الكولسترول واستقلاب الأحماض الدهنية.[38]
تنظيم تخليق الكولسترول
يُنظم التخليق الحيوي للكوليسترول بشكل مباشر عن طريق مستويات الكولسترول الموجودة على الرغم من أن آليات الاستتباب المتضمنة لا تُفهم إلا جزئيًا. يؤدي تناول كميات أكبر من الطعام إلى انخفاض صافٍ في الإنتاج الداخلي للكولسترول، في حين أن تناول كميات أقل من الطعام له تأثير معاكس. الآلية التنظيمية الرئيسية هي استشعار الكولسترول داخل الخلايا في الشبكة الإندوپلازمية بواسطة پروتين SREBP (الپروتين الرابط لعنصر الستيرول التنظيمي 1 و2).[39]
في وجود الكولسترول، يرتبط SREBP بپروتينين آخرين: SCAP (پروتين تنشيط الانقسام SREBP) وINSIG-1. عندما تنخفض مستويات الكولسترول، ينفصل INSIG-1 عن مركب SREBP-SCAP، مما يسمح للمركب بالانتقال إلى جهاز گولجي. هنا ينقسم SREBP بواسطة S1P وS2P (موقع 1 پروتياز وموقع 2 پروتياز) ، وهما إنزيمان يتم تنشيطهما بواسطة SCAP عندما تكون مستويات الكولسترول منخفضة.
ثم ينتل SREBP المنقسم إلى النواة ويعمل كعامل نسخ لربطه بالعنصر التنظيمي للستيرول (SRE) والذي يحفز نسخ العديد من الجينات. من بينها مستقبلات الپروتين الدهني منخفض الكثافة (LDL وHMG-CoA reductase. يقوم مستقبل LDL بإزالة الپروتين الدهني منخفض الكثافة المنتشر من مجرى الدم، بينما يؤدي اختزال HMG-CoA reductase إلى زيادة الإنتاج الداخلي للكولسترول.[40]
في السبعينيات، وضع د. مايكل براون وجوسف گولدستين، جزء كبير من مسار هذه الإشارات. عام 1985، حصلا على جائزة نوبل للطب من أجل عملهم هذا. يُظهر عملهم اللاحق كيف ينظم مسار SREBP التعبير عن العديد من الجينات التي تتحكم في تكوين الدهون والتمثيل الغذائي وتخصيص وقود الجسم.
يمكن أيضًا إيقاف تخليق الكولسترول عندما تكون مستويات الكولسترول مرتفعة. يحتوي HMG-CoA reductase على مجال عصاري خلوي (مسؤول عن وظيفته التحفيزية) ومجال غشائي. يستشعر المجال الغشائي إشارات تدهوره. تؤدي زيادة تركيزات الكولسترول (والستيرولات الأخرى) إلى حدوث تغيير في حالة قلة القلة في هذا المجال، مما يجعلها أكثر عرضة للتدمير بواسطة الپروتيزوم. يمكن أيضًا تقليل نشاط هذا الإنزيم عن طريق الفسفرة بواسطة پروتين الكيناز المنشط-بـAMP. نظرًا لأن هذا الكيناز يتم تنشيطه بواسطة AMP، والذي ينتج عند تحلل ATP، فإنه يتبع ذلك توقف تخليق الكولسترول عندما تكون مستويات ATP منخفضة.[41]
نقل الپلازما وتنظيم الامتصاص
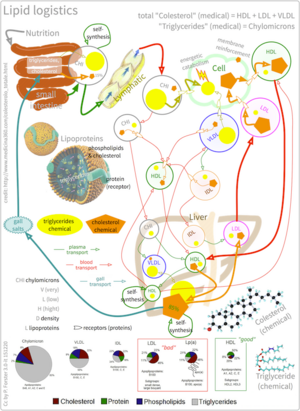
كجزيء منعزل، يكون الكولسترول قليل الذوبان في الماء، أو محب للماء. لهذا السبب، فإنه يذوب في الدم بتركيزات صغيرة للغاية. لكي يُنقل بشكل فعال، بدلاً من تعبئة الكولسترول داخل جزيئات الپروتينات دهنية المعقدة، يشكلجزئيات قرصية مع پروتينات ودهون خارجية مزدوج الألفة، والتي تكون أسطحها الخارجية قابلة للذوبان في الماء ومن الداخل قابلة للذوبان في الدهون. هذا يسمح لها بالنتقال عبر الدم عن طريق الاستحلاب. يُنقل الكولسترول الغير مرتبط، كونه محب للماء، على سطح أحادي الطبقة لجزيئات الپروتين الدهني مع الدهون الفوسفورية والپروتينات. من ناحية أخرى، تُنقل إسترات الكولسترول المرتبطة بالأحماض الدهنية داخل النواة الدهنية الكارهة للماء للپروتين الدهني، جنبًا إلى جنب مع الدهون الثلاثية.[42]
هناك عدة أنواع من الپروتينات الدهنية في الدم. مرتبة من حيث الكثافة، هي الكيلوميكرونات، الپروتين الدهني وضعي الكثافة (VLDL)، الپروتين الدهني متوسط الكثافة (IDL)، الپروتين الدهني منخفض الكثافة (LDL) والپروتين الدهني مرتفع الكثافة (HDL). تجعل نسب الپروتين/الدهون المنخفضة الپروتينات الدهنيةأقل كثافة. الكولسترول داخل الپروتينات الدهنية المختلفة متطابق، على الرغم من أن بعضه يحمل على شكل كحول "حر" أصلي (مجموعة الكولسترول-OH التي تواجه الماء المحيط بالجزيئات)، بينما يحمل البعض الآخر على شكل إسترات الأسايل الدهنية، والمعروفة أيضًا باسم إسترات الكولسترول، داخل الجزيئات.[42]
تنظم جزيئات الپروتين الدهني بواسطة صميم الپروتين الدهني المعقد، عادةً 80-100 پروتين مختلف لكل جسيم، والذي يمكن التعرف عليه وربطه بمستقبلات محددة على أغشية الخلايا، وتوجيه حمولته الدهنية إلى خلايا وأنسجة معينة تستوعب حاليًا جزيئات نقل الدهون هذه. تعمل هذه المستقبلات السطحية كتوقيعات جزيئية فريدة، والتي تساعد بعد ذلك في تحديد توزيع الدهون في جميع أنحاء الجسم.[42]
تحتوي الكيلوميكرونات، وهي جزيئات نقل الكولسترول الأقل كثافة، على صميم الپروتين الدهني بي-48، وصميم الپروتين الدهني سي، وصميم الپروتين الشحمي إي (الناقل الرئيسي للكولسترول في المخ) [43] في قشرتها. تحمل الكيلوميكرونات الدهون من الأمعاء إلى العضلات والأنسجة الأخرى التي تحتاج إلى الأحماض الدهنية لإنتاج الطاقة أو الدهون. يبقى الكولسترول غير المستخدم في المزيد من بقايا الكيلومكرونات الغنية بالكوليسترول، ويمتص من هنا إلى مجرى الدم عن طريق الكبد.[42]
تُنتج جزيئات الپروتينات الدهنية وضعي الكثافة بواسطة الكبد عن طريق ثلاثي الگليسرول والكولسترول الذي لم يستخدم في تخليق الأحماض الصفراوية. تحتوي هذه الجزيئات على صميم الپروتين الدهني بي100 وصميم الپروتين الدهني إي في غلافها، ويمكن أن تتحلل بواسطة ليپاز الپروتين الدهني على جدار الشريان إلى پروتين دهني متوسط الكثافة. يسمح هذا الانقسام في جدار الشرايين بامتصاص ثلاثي الگليسرول ويزيد من تركيز الكولسترول المنتشر. بعد ذلك تستهلك جزيئات الپروتين الدهني متوسط الكثافة في عمليتين: يستقلب النصف بواسطة HTGL ويمتص بواسطة مستقبل الپروتين الدهني منخفض الكثافة على أسطح خلايا الكبد، بينما يستمر النصف الآخر في فقد ثلاثي الگليسرول في مجرى الدم حتى تصبح جزيئات الپروتين الدهني منخفض الكثافة محملة بالكولسترول.[42]
جزيئات الپروتين الدهني منخفض الكثافة هي الناقلات الرئيسية للكولسترول في الدم. يحتوي كل واحد منها على ما يقرب من 1500 جزيء من إستر الكولسترول. تحتوي أغشية جزيء الپروتين الدهني منخفض الكثافة على جزيء واحد فقط من صميم الپروتين الدهني بي100، الذي يُعرف بواسطة مستقبلات الپروتين الدهني منخفض الكثافة في الأنسجة المحيطية. عند ربط صميم الپروتين الدهني بي100، تتركز العديد من مستقبلات الپروتين الدهني منخفض الكثافة في الفجوات المطلية بپروتين الكلاثرين. يشكل كل من الپروتين الدهني منخفض الكثافة ومستقبلاته حويصلات داخل الخلية عبر الالتقام الخلوي. تندمج هذه الحويصلات بعد ذلك مع الليزوسوم، حيث يحلل إنزيم ليباز حمض الليزوسوم إسترات الكولسترول. يمكن بعد ذلك استخدام الكولسترول في التخليق الحيوي للأغشية أو إستراته وتخزينه داخل الخلية، حتى لا يتداخل مع أغشية الخلية.[42]
تستخدم مستقبلات الپروتين الدهني منخفض الكثافة أثناء امتصاص الكولسترول، ويُنظم تركيبها بواسطة SREBP، وهو نفس الپروتين الذي يتحكم في تكوين الكولسترول "من جديد"، وفقًا لوجوده داخل الخلية. الخلية التي تحتوي على نسبة وفيرة من الكولسترول سيمنع تكوين مستقبلات الپروتين الدهني منخفض الكثافة بها، وذلك لمنع امتصاص الكولسترول الجديد في جزيئات الپروتين الدهني منخفض الكثافة. على العكس من ذلك، يستمر تصنيع مستقبلات الپروتين الدهني منخفض الكثافة عندما تكون الخلية لديها نقص في الكولسترول.[42]
عندما تصبح هذه العملية غير منظمة، تبدأ جزيئات الپروتين الدهني منخفض الكثافة بدون مستقبلات في الظهور في الدم. تتأكسد جزيئات الپروتين الدهني منخفض الكثافة هذه وتتناولها خلايا الدم البيضاء، التي تصبح محتقنة وتشكل خلايا رغوية. غالبًا ما تنحصر هذه الخلايا الرغوية في جدران الأوعية الدموية وتساهم في تكوين لويحة تصلب الشرايين. تؤثر الاختلافات في استتباب الكولسترول على تطور تصلب الشرايين المبكر (سماكة بطانة الشريان السباتي).[44] هذه اللويحات هي الأسباب الرئيسية للنوبات القلبية والسكتات الدماغية وغيرها من المشاكل الطبية الخطيرة، مما يؤدي إلى ارتباط ما يسمى بكولسترول الپروتين الدهني منخفض الكثافة (في الواقع الپروتين الدهني) بالكولسترول "الضار".[41]
يُعتقد أن جزيئات الپروتين الدهني مرتفع الكثافة تنقل الكولسترول مرة أخرى إلى الكبد، إما للإفراز أو للأنسجة الأخرى التي تصنع الهرمونات، في عملية تُعرف باسم نقل الكولسترول العكسي (RCT).[45] ترتبط الأعداد الكبيرة لجزيئات الپروتين الدهني مرتفع الكثافة بنتائج صحية أفضل،[46] في حين يرتبط انخفاض عدد جزيئات الپروتين الدهني مرتفع الكثافة بتطور تصلب الشرايين.[47]
الاستقلاب وإعادة التدوير والإفراز
الكولسترول معرض للأكسدة ويشكل بسهولة مشتقات مؤكسجة تسمى الأوكسيستيرولات. يمكن أن تتشكل ثلاث آليات مختلفة: الأكسدة التلقائية، والأكسدة الثانوية للپروكسدة الدهنية، وأكسدة إنزيم استقلاب الكوليترول. نشأ اهتمام كبير بالأوكسيستيرولستيرول عندما ثبت أنها تمارس إجراءات مثبطة على التخليق الحيوي للكولسترول.[48]
أصبحت هذه النتيجة معروفة باسم "فرضية الأوكسيستيرول". تشمل الأدوار الإضافية للأوكسيستيرول في الفسيولوجيا البشرية مشاركتها في التخليق الحيوي لحمض الصفراء، وتعمل كأشكال نقل للكولسترول، وتنظيم نسخ الجينات.[49]
في التجارب الكيميائية الحيوية، تستخدم أشكال الكولسترول الموسومة إشعاعيًا، مثل الكولسترول الثلاثي. تخضع هذه المشتقات للتحلل عند التخزين ومن الضروري تنقية الكولسترول قبل الاستخدام. يمكن تنقية الكولسترول باستخدام أعمدة Sephadex LH-20 الصغيرة.[50]
يؤكسد الكبد الكولسترول في مجموعة متنوعة من الأحماض الصفراوية.[51] هذه العصارات بدورها، تكون مترافقة مع الگلايسين، التوراين، حمض الگلوكورونيك، أو الكبريتات. يُفرز خليط من الأحماض الصفراوية المقترنة وغير المقترنة، جنبًا إلى جنب مع الكوليسترول نفسه ، من الكبد إلى العصارة الصفراوية. يُمتص عادة ما يقرب من 95% من الأحماض الصفراوية من الأمعاء، ويفقد الباقي في البراز.[52]
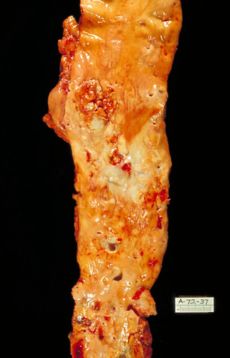
يشكل إفراز الأحماض الصفراوية وإعادة امتصاصها أساس الدورة المعوية الكبدية، وهو أمر ضروري لهضم وامتصاص الدهون الغذائية. في ظل ظروف معينة، عندما يزداد تركيزه، كما في المرارة، يتبلور الكولسترول ويكون المكون الرئيسي لمعظم حصوات المرارة (الليسيثين والبيليروبين تحدث أيضًا حصوات المرارة، لكن أقل تواتراً).[53] يومياً يدخل ما يصل إلى 1 جرام من الكولسترول إلى القولون. ينشأ هذا الكولسترول من النظام الغذائي والصفراء وخلايا الأمعاء المتقشرة، ويمكن أن يستقلب بواسطة بكتيريا القولون. يتحول الكولسترول بشكل أساسي إلى كوپروستانول وهو ستيرول غير قابل للامتصاص يُفرز في البراز.[بحاجة لمصدر]
على الرغم من أن الكولسترول عبارة عن ستيرويد مرتبط بشكل عام بالثدييات، فإن "المتفطرة السلية"، العامل الممرض البشري، قادرة على تحليل هذا الجزيء تمامًا ويحتوي على عدد كبير من الجينات التي ينظمها وجودها.[54] هناك العديد من هذه الجينات المنظمة للكوليسترول وهي متماثلة لجينات الأحماض الدهنية أكسدة-بيتا، لكنها تطورت بطريقة تربط ركائز الستيرويد الكبيرة مثل الكولسترول.[55][56]
الأغذية التي تحتوي على الكولسترول

الدهون الحيوانية عبارة عن خليط معقد من الدهون الثلاثية (ثلاثي الگليسريد)، بكميات أقل من كل من الدهون الفسفورية وجزيئات الكولسترول التي تتكون منها جميع أغشية الخلايا الحيوانية (والبشرية). نظرًا لأن جميع الخلايا الحيوانية تصنع الكولسترول، فإن جميع الأطعمة الحيوانية تحتوي على الكولسترول بكميات متفاوتة.[57] تشمل المصادر الغذائية الرئيسية للكولسترول اللحوم الحمراء، صفار البيض والبيض بالكامل (المح والبياض)، الكبد، الكلية، حوصلات الطيور، زيت السمك والزبدة.[58] كما يحتوي حليب الثدي البشري على كميات كبيرة من الكولسترول.[59]
تُخلق الخلايا النباتية الكولسترول كمركب طليعي لمركبات أخرى، مثل الفيتوستيرولات والقلوانيات السكرية الستيرويدية، مع بقاء الكولسترول في الأطعمة النباتية بكميات قليلة فقط أو غائب.[58][60]
تحتوي بعض الأطعمة النباتية، مثل الأڤوكادو وبذور الكتان والفول السوداني، على الفيتوسترولات، التي تتنافس مع الكولسترول على الامتصاص في الأمعاء، وتقلل من امتصاص كل من الكولسترول الغذائي والكولسترول الصفراوي.[61]
يحتوي النظام الغذائي النموذجي على قرابة 0.2 جرام من الفيتوسترولات، وهو ما لا يكفي ليكون له تأثير كبير على منع امتصاص الكولسترول. يمكن الحصول على المزيد من الفيتوسترولات باستخدام الأغذية الوظيفية أو المكملات الغذائية تحتوي على الفيتوسترولات والتي من المعروف أن لها القدرة على خفض مستويات كولسترول-الپروتين الدهني منخفض الكثافة (الكولسترول الضار).[62]
الإرشادات والتوصيات الطبية
عام 2015، أوصت اللجنة الاستشارية للمبادئ التوجيهية الغذائية (DGAC) التابعة لوزارة الزراعة الأمريكية أن يأكل الأمريكيون أقل قدر ممكن من الكولسترول الغذائي، لأن معظم الأطعمة الغنية بالكولسترول غنية أيضًا بالدهون المشبعة وبالتالي قد يزيد من خطر الإصابة بالأمراض القلبية الوعائية.[63][64]
أوصى تقرير صدر عام 2013 عن جمعية القلب الأمريكية والكلية الأمريكية لأمراض القلب بالتركيز على الأنماط الغذائية الصحية بدلاً من حدود الكولسترول المحددة، حيث يصعب على الأطباء والمستهلكين تنفيذها. يوصون بحمية داش وحمية البحر المتوسط ، اللذان يحتويان على نسبة منخفضة من الكولسترول.[65] توصي مراجعة أجرتها جمعية القلب الأمريكية عام 2017 باستبدال الدهون المشبعة بالدهون المتعددة غير المشبعة لتقليل خطر الإصابة بالأمراض القلبية الوعائية.[66]
أوصت بعض الإرشادات التكميلية بجرعات من الفيتوستيرول في نطاق 1.6-3.0 جرام يومياً (Health Canada ،EFSA ،ATP III ،FDA). أظهر التحليل الشمولي الأخير انخفاضًا بنسبة 12% في كولسترول الپروتين الدهني منخفض الكثافة بجرعة متوسطة تبلغ 2.1 جرامًا يومياً.[67] ومع ذلك، فقد تم التشكيك أيضاً في فوائد النظام الغذائي المضاف إليه الفيتوستيرول.[68]
الأهمية السريرية
فرط كولسترول الدم
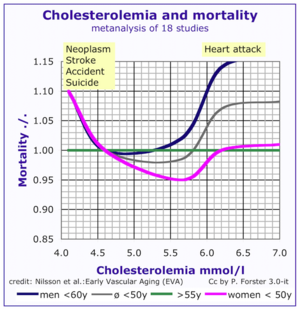
بحسب فرضية الدهون، تؤدي المستويات المرتفعة من الكولسترول في الدم إلى تصلب الشرايين مما قد يزيد من خطر الإصابة بالنوبة القلبية والسكتة الدماغية ومرض الشريان المحيطي. نظرًا لأن ارتفاع مستوى الپروتين الدهني منخفض الكثافة في الدم - وخاصة تركيزاتته الأعلى وحجم الجزيئات الأصغر - يساهم في هذه العملية أكثر من محتوى الكولسترول في جزيئات الپروتين الدهني مرتفع الكثافة،[69] عادة ما تسمى جزئيات الپروتينات الدهنية منخفضة الكثافة |بالكولسترول الضار. التركيزات المرتفعة للپروتين الدهني مرتفع الكثافة الوظيفي، التي يمكنها إزالة الكولسترول من الخلايا والشرايين المتصلبة، وتوفر حماية لها، يشار لها عادة باسم "الكولسترول النافع". تُحدد هذه التوازنات في الغالب وراثياً، لكن يمكن تغييرها حسب تكوين الجسم، الأدوية، والنظام الغذائي،[70] وعوامل أخرى.[71] أظهرت دراسة أجريت عام 2007 أن مستويات الكولسترول الإجمالية في الدم لها تأثير متسارع على الأمراض القلب الوعائية وإجمالي معدلات الوفاة، مع ارتباط أكثر وضوحًا لدى الأشخاص الأصغر سنًا. نظرًا لأن الأمراض القلب الوعائية نادرة نسبيًا بين الحالات الأصغر سنًا، فإن تأثير ارتفاع الكولسترول على الصحة يكون أكبر لدى كبار السن.[72]
ترتبط المستويات المرتفعة من أجزاء الپروتين الدهني، LDL ،IDL وVLDL، بدلاً من مستوى الكولسترول الكلي، بمدى تقدم تصلب الشرايين.[73]
على العكس من ذلك، يمكن أن يكون إجمالي الكولسترول ضمن الحدود الطبيعية، ومع ذلك يتكون أساسًا من جزيئات LDL الصغيرة وجزيئات HDL الصغيرة، وفي ظل هذه الظروف تكون معدلات تقدم تصلب الشرايين مرتفعة. وجد التحليل "اللاحق" للدراسات المستقبلية IDEAL ودراسات EPIC وجود ارتباط بين المستويات المرتفعة من كولسترول HDL (المعدل لصميم الپروتين A-I والپروتين الدهني B) وزيادة خطر الإصابة بالأمراض القلبية الوعائية، مما يلقي بظلال من الشك على الدور الوقائي للكولسترول بالنسبة للقلب".[74][75]
يمكن أن يكون لدى واحد من كل 250 فردًا طفرة جينية لمستقبلات الكولسترول الضار والتي تسبب لهم فرط كولسترول الدم العائلي.[76] يمكن أن يشمل ارتفاع الكولسترول الوراثي أيضًا على طفرات جينية في جين PCSK9 وجين الپروتين الدهني ب.[77]
يتم التعامل مع مستويات الكولسترول المرتفعة باتباع نظام غذائي صارم يتكون من وجبات تحتوي دهون مشبعة منخفضة، والأطعمة الخالية من الدهون غير المشبعة، والأطعمة منخفضة الكولسترول،[78][79] هذا بالإضافة إلى العلاج بأحد بالعقاقير الخافضة لدهون الدم، مثل الستاتين، الفايبرات، مثبطات امتصاص الكولسترول، العلاج بالأجسام المضادة أحادية النسيلة (مثبطات PCSK9)، ومشتقات حمض النيكوتينيك أو حمض الصفراء.[80]
هناك العديد من الدلائل الإرشادية الدولية حول علاج فرط كولسترول الدم.[81]
أكدت التجارب البشرية التي تستخدم مثبطات HMG-CoA reductase، المعروفة باسم الستاتينات، بشكل متكرر أن تغيير أنماط نقل الپروتينات الدهنية من الأنماط غير الصحية إلى الأنماط الصحية يقلل بشكل كبير من معدلات الإصابة بالأمراض القلبية الوعائية حتى بالنسبة للأشخاص الذين يعانون من قيم الكولسترول تعتبر منخفضة بالنسبة للبالغين.[82] أظهرت الدراسات أن خفض مستويات كولسترول الپروتين الدهني منخفض الكثافة بنحو 38.7 ملگ/د.ل. باستخدام الستاتين يمكن أن يقلل من مخاطر الإصابة بالأمراض القلبية الوعائية والسكتة الدماغية بنحو 21%.[83] وجدت الدراسات أيضًا أن العقاقير المخفضة للكولسترول تقلل من تطور تصلب الشرايين الدموية.[84]
نتيجة لذلك، قد يستفيد الأشخاص الذين لديهم تاريخ من الأمراض القلبية العائية من الستاتينات بغض النظر عن مستويات الكولسترول لديهم (إجمالي الكولسترول أقل من 5.0 م.مول/لتر)،[85] وفي الرجال الذين لا يعانون من الأمراض القلبية الوعائية، هناك فائدة من خفض مستويات الكولسترول المرتفعة بشكل غير طبيعي ("الوقاية الأولية").[86] طُبقت الوقاية الأولية عند النساء في الأصل فقط من خلال توسيع نتائج الدراسات التي أجريت على الرجال،[87] منذ ذلك الحين، لدى النساء، لم تظهر أي من تجارب الستاتين التي أجريت قبل عام 2007 انخفاضًا كبيرًا في معدل الوفيات الإجمالي أو في نقاط النهاية القلبية الوعائية.[88]
أظهرت التحليلات الشمولية انخفاضًا كبيرًا في الوفيات الناجمة عن جميع الأسباب والوفيات القلبية الوعائية، دون تغايرية كبيرة حسب الجنس.[89]
| المستوى | التفسير | |
|---|---|---|
| ملگ/د.ل | م.مول/ل | |
| < 200 | < 5.2 | المستوى المرغوب فيه (خطر منخفض) |
| 200–240 | 5.2–6.2 | ما قبل الخطر المرتفع |
| > 240 | > 6.2 | الخطر المرتفع |
يشير تقرير عام 1987 الصادر عن البرنامج الوطني لتعليم الكولسترول، أن لجان علاج البالغين تقترح أن مستوى الكولسترول الكلي في الدم يجب أن يكون: < 200 ملگ/د.ل. للكولسترول الدم الطبيعي 200–239 ملگ/د.ل. للكولسترول ما قبل المرتفع> 240 ملگ/د.ل. للكولسترول المرتفع.[90]
تقدم جمعية القلب الأمريكية مجموعة مماثلة من الإرشادات لمستويات الكولسترول الكلية (الصيام) في الدم وخطر الإصابة بأمراض القلب:[91]
تعتبر الستاتينات فعالة في خفض كولسترول الپروتين الدهني منخفض الكثافة وتستخدم على نطاق واسع في الوقاية الأولية لدى الأشخاص المعرضين لخطر الإصابة بالأمراض القلبية الوعائية، وكذلك في الوقاية الثانوية لأولئك الذين أصيبوا بأمراض قلبية وعائية.[92]
تحدد طرق الاختبار الأكثر حداثة كولسترول الپروتين الدهني منخفض الكثافة ("السيئ") وكولسترول الپروتين الدهني مرتفع الكثافة ("الجيد") بشكل منفصل، مما يسمح بتحليل الكولسترول بشكل أكثر دقة. يعتبر مستوى الپروتين الدهني منخفض الكثافة المرغوب فيه أقل من 100 ملگ/د.ل. (2.6 م.مول/ل)،[93][94] على الرغم من أن الحد الأعلى الأحدث هو 70 ملگ/د.ل. (1.8 م.مول/ل) يمكن أن يؤخذ في الاعتبار عند الأفراد المعرضين لمخاطر عالية بناءً على بعض التجارب المذكورة أعلاه. يُعتقد أن نسبة الكولسترول الكلي إلى كولسترول الپروتين الدهني مرتفع الكثافة - وهو مقياس مفيد آخر - أقل بكثير من 5:1 أكثر صحة.

يُعرف الكولسترول الكلي على أنه مجموع HDL و LDL و VLDL. عادةً ما يقاس إجمالي HDL والدهون الثلاثية فقط. لأسباب تتعلق بالتكلفة، يُقدر VLDL عادةً بخمس الدهون الثلاثية ويُقدر LDL باستخدام صيغة فرايدڤالدد (أو المتغير): LDL المقدّر = [الكوليسترول الكلي] - [HDL الكلي] - [VLDL المقدرة]. تستخدم قياسات LDL المباشرة عندما تتجاوز الدهون الثلاثية 400 ملگ/د.ل. يحتوي VLDL و LDL المقدّران على خطأ أكبر عندما تكون الدهون الثلاثية أعلى من 400 ملگ/د.ل.[95]
في دراسة فرامنگام للقلب، أدت كل زيادة بمقدار 10 ملگ/د.ل (0.6 م.مول/ل) في إجمالي مستويات الكولسترول إلى زيادة معدل الوفيات الإجمالي لمدة 30 عامًا بنسبة 5% ومعدل الوفيات من الأمراض القلبية الوعائية بمقدار 9%. في حين أن الأشخاص الذين تزيد أعمارهم عن 50 عامًا لديهم زيادة بنسبة 11% في معدل الوفيات الإجمالي وزيادة بنسبة 14% في معدل الوفيات الناجمة عن الأمراض القلبية الوعائية لكل 1 ملگ/د.ل (0.06 م.مول/ل) إجمالي الانخفاض السنوي لمستويات الكولسترول.[96]
ظهر هذا التأثير أيضًا لدى الرجال من جميع الأعمار والنساء فوق سن الخمسين في برنامج ڤورارلبرگ لمراقبة وتعزيز الصحة. كانت هذه المجموعات أكثر عرضة للوفاة من السرطان وأمراض الكبد والأمراض العقلية مع انخفاض الكولسترول الكلي للغاية، من 186 ملگ/د.ل (10.3 م.مول/ل) وأقل. تشير هذه النتيجة إلى أن تأثير انخفاض الكولسترول يحدث حتى بين المستجيبين الأصغر سنًا، وهو ما يتعارض مع التقييم السابق بين مجموعات من كبار السن بأن هذه علامة على الضعف الذي يحدث مع تقدم العمر.[97]
نقص كولسترول الدم
يُطلق على المستويات المنخفضة بشكل غير طبيعي من الكولسترول اسم "نقص كولسترول الدم". البحث في أسباب هذه الحالة محدود نسبيًا، لكن بعض الدراسات تقترح ارتباطها بالاكتئاب والسرطان ونزيف المخ. بشكل عام، يبدو أن مستويات الكولسترول المنخفضة هي نتيجة وليس سببًا لمرض أساسي.[72] هناك خلل وراثي في تخليق الكولسترول يسبب متلازمة سميث-لملي-أوپيتز، والذي يرتبط غالبًا بانخفاض مستويات الكولسترول في الپلازما. فرط نشاط الغدة الدرقية، أو أي اضطراب آخر في الغدد الصماء يؤدي إلى زيادة تنظيم مستقبلات الپروتين الدهني منخفض الكثافة، قد يؤدي إلى نقص كولسترول الدم.[98]
اختبار الكولسترول

توصي جمعية القلب الأمريكية باختبار الكولسترول كل 4-6 سنوات للأشخاص الذين تبلغ أعمارهم 20 عامًا أو أكثر.[99] تشير مجموعة منفصلة من إرشادات جمعية القلب الأمريكية الصادرة عام 2013 إلى أن الأشخاص الذين يتناولون علاجات الستاتين يجب أن يجروا اختبار الكولسترول كل 4-12 أسبوع بعد الجرعة الأولى ثم كل 3-12 شهر بعد ذلك.[100][101] بالنسبة للرجال الذين تتراوح أعمارهم بين 45 و65 عامًا والنساء الذين تتراوح أعمارهن بين 55 و65 عامًا، يجب إجراء اختبار الكوليسترول كل عام إلى عامين، وبالنسبة لكبار السن الذين تزيد أعمارهم عن 65 عامًا، يجب إجراء اختبار سنوي.[100]
بعد صيام 12 ساعة، يقوم أخصائي الرعاية الصحية بأخذ عينة دم من وريد الذراع لقياس يتم أخذ عينة دم بعد 12 ساعة من الصوم من قبل أخصائي الرعاية الصحية من ذراع الوريد لقياس ملف الدهون لاختبار:
أ- الكولسترول الكلي
ب- كولسترول الپروتين الدهني مرتفع الكثافة
ج- كولسترول الپروتين الدهني منخفض الكثافة
د- الدهون الثلاثية.[100][102] يمكن التعبير عن النتائج "محسوباً"، مما يشير إلى حساب إجمالي الكوليسترول، الپروتين الدهني مرتفع الكثافة، والدهون الثلاثية.[102]
يجرى اختبار الكولسترول لتحديد المستويات "الطبيعية" أو "المرغوبة" إذا كان لدى الشخص نسبة كولسترول كلية تبلغ 5.2 م.مول/ل أو أقل (200 ملگ/د.ل)، وقيمة الپروتين الدهني مرتفع الكثافة أكبر من 1 م.مول/ل أو أقل (40 ملگ/د.ل، "الأعلى"، أفضل)، ومستوى الدهون الثلاثية أقل من 1.7 م.مول/ل (150 ملگ/د.ل).[100][102] يتم تقييم نسبة الكولسترول في الدم لدى الأشخاص الذين يعانون من نمط الحياة الغير صحي أو الشيخوخة أو عوامل الخطر القلبية الوعائية، مثل داء السكري، [[ارتفاع ضغط الدم]، وتاريخ عائلي للإصابة بأمراض الشرايين التاجية، أو الذبحة الصدرية، في مراحل مختلفة.[100]
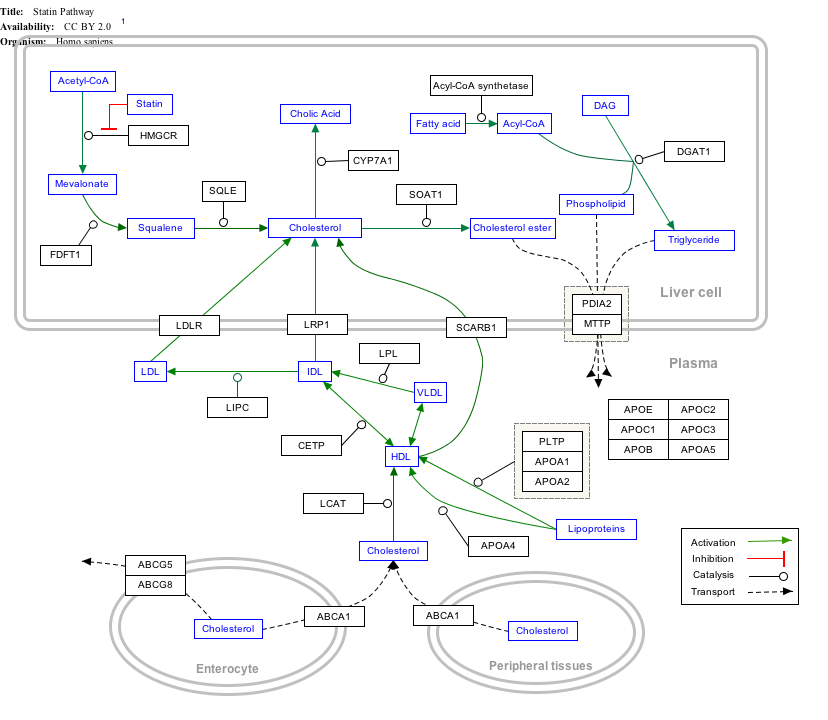
خريطة مسار تفاعلية
Click on genes, proteins and metabolites below to link to respective articles. [§ 1]
- ^ The interactive pathway map can be edited at WikiPathways: "Statin_Pathway_WP430".
البلورات السائلة الكولسترولية
من المعروف أن بعض مشتقات الكولسترول (من بين دهون الكولسترول البسيطة الأخرى) تولد الخط البلوري السائل "طور الكوليسترول". المرحلة الصفراوية هي، في الواقع، طور سائل متماكب، ويتغير لونها عندما تتغير درجة حرارتها. وهذا يجعل مشتقات الكولسترول مفيدة للإشارة إلى درجة الحرارة في مقياس حرارة شاشة البلور السائل وفي الدهانات الحساسة لدرجة الحرارة.[بحاجة لمصدر]
المتزامرات الفراغية
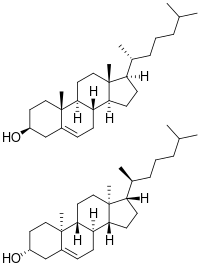
للكولسترول 256 متزامر فراغي التي تنشأ من المتمركزات الفراغية الثمانية، على الرغم من أن اثنين فقط من المتزامرات الفراغية لهما أهمية كيميائية حيوية (nat-cholesterol الكوليسترول الطبيعي، وent-cholesterol الكولسترول المتماثل)،[103][104] والكولسترول الوحيد الذي يتواجد بصورة طبيعية هو الكولسترول الطبيعي.
أبحاث حديثة
في 12 يوليو 2022، خضع متطوع في نيوزيلندا ليكون أول شخص يخضع لعملية تعديل الدنا من أجل خفض نسبة الكوليسترول في الدم، وهي خطوة قد تنذر باستخدام واسع للتكنولوجيا لمنع النوبات القلبية. تضمنت التجربة، وهي جزء من تجربة سريرية أجرتها شركة التكنولوجيا الحيوية الأمريكية ڤرڤ، حقن نسخة من أداة تعديل الجينات كريسپر من أجل تعديل حرف واحد من الدنا في خلايا كبد المريض. [105]
وفقًا للشركة، يجب أن يكون هذا التعديل الصغير بما يكفي لخفض مستويات الكوليسترول الضار لدى الشخص بشكل دائم، وهو الجزيء الدهني الذي يتسبب في انسداد الشرايين وتصلبها بمرور الوقت. كان المريض النيوزلندي معرضًا لخطر وراثي لارتفاع الكوليسترول وكان يعاني بالفعل من أمراض القلب. ومع ذلك، تعتقد الشركة أنه يمكن استخدام نفس التقنية في النهاية مع ملايين الأشخاص للوقاية من أمراض القلب والأوعية الدموية.
يقول سيكار كاثيريسان، باحث الجينات الذي أسس ڤرڤ منذ ثلاث سنوات وهو الرئيس التنفيذي للشركة: "إذا نجح هذا وكان آمنًا، فهذا هو الرد على النوبة القلبية - هذا هو العلاج". مرت 10 سنوات منذ أن طور العلماء تقنية كريسپر، وهي تقنية لإجراء تغييرات مستهدفة على الحمض النووي في الخلايا، ولكن حتى الآن لم يتم تجربة هذه الطريقة إلا على الأشخاص الذين يعانون من أمراض نادرة مثل فقر الدم المنجلي، وفقط كجزء من التجارب الاستكشافية.
إذا نجحت تجربة ڤرڤ، فقد تشير إلى استخدام أوسع بكثير لتعديل الجينات لمنع الحالات الشائعة. يعاني عدد كبير من سكان العالم من نسبة ارتفاع الپروتين الدهني منخفض الكثافة (LDL)، لكن لا يستطيع الكثير من الأشخاص السيطرة عليه. في جميع أنحاء العالم، يموت عدد أكبر من الأشخاص بسبب أمراض القلب والأوعية الدموية الناتجة عن تصلب الشرايين أكثر من أي شيء آخر.
يقول إريك توپول، أخصائي أمراض القلب والباحث في شركة سكريپس للأبحاث: "من بين جميع عمليات تعديل الجينوم المختلفة سريرياً، يمكن أن يكون لهذا التعديل تأثير عميق بسبب عدد الأشخاص الذين يمكن أن يستفيدوا".
يعتقد بعض الأطباء أن خفض مستوى الپروتين الدهني منخفض الكثافة بشدة، وإبقائه منخفضًا طوال الحياة، يمكن أن يمنع الأشخاص بشكل أساسي من الموت بسبب أمراض القلب والأوعية الدموية. هذه هي وجهة نظر يوجين براونوالد، الطبيب في مستشفى بريگهام في بوسطن والذي يعمل أيضًا مستشارًا لشركة ڤرڤ.
يقول براونوالد: "كلما انخفض مستوى الپروتين الدهني منخفض الكثافة، كان ذلك أفضل". "لا يمكن أن يكون لديك LDL منخفض جدًا. المشكلة هي كيف تثبطه؟ " يمكن أن يساعد اتباع نظام غذائي صارم، مثل النظام الذي تتجنب فيه البيض واللحوم وحتى زيت الزيتون. لكن قلة من الأشخاص تنجح في التمسك به. ثم يأتي دور العقاقير المخفضة للكوليسترول، وهو أكثر الأدوية الموصوفة على نطاق واسع في الولايات المتحدة. يمكن أن تقلل هذه الأدوية LDL لدى الشخص إلى النصف، لكن البعض لا يستطيع التعامل مع الآثار الجانبية، ويجد البعض صعوبة في تناول قرص من الدواء مرة واحدة يومياً.
تتضمن بعض العقاقير الحديثة التي تعتمد على التكنولوجيا الحيوية الحقن مرتين في الشهر، أو حتى مرتين في السنة. هذه الأدوية قوية جدًا، وتكهن براونفالد مؤخرًا بما سيحدث إذا تم إعطاؤها على نطاق واسع كتدخل للصحة العامة، على عكس لقاح الإنفلونزا السنوي. يقول: "أحسبها إذا أعطيتها ابتداءً من سن الثلاثين، ستعيش حتى 100 دون الإصابة بأحد أمراض الشريان التاجي".
ومع ذلك، لم يتم استخدام هذه العقاقير على نطاق واسع حتى الآن. لا تزال باهظة الثمن، ولا تزال غير ملائمة، وشركات التأمين مترددة في الدفع. "لذا فإن تعديل الجينات هو العصا الكبيرة، التي يمكنها القيام بالأمر. يقول براونوالد: "ليس عليك العودة أبدًا". "إنها مشكلة كبيرة جدًا، لأن مرض تصلب الشرايين القلبي الوعائي هو السبب الأكثر شيوعًا للوفاة في العالم الصناعي، وLDL هو السبب الرئيسي."
في نيوزيلندا، حيث تجري تجربة ڤرڤ السريرية، سيعطي الأطباء العلاج الجيني لـ 40 شخصًا لديهم شكل موروث من ارتفاع الكوليسترول يُعرف باسم فرط كوليسترول الدم العائلي، أو FH. يمكن للأشخاص الذين يعانون من FH الحصول على قراءات الكوليسترول ضعف المتوسط، حتى لدى الأطفال. يتعلم الكثيرون أنهم يواجهون مشكلة فقط عندما يصابون بنوبة قلبية، غالبًا في سن مبكرة.
تشير الدراسة أيضًا إلى الاستخدام المبكر لتحرير القاعدة، وهو تعديل جديد لكريسپر تم تطويره لأول مرة عام 2016. على عكس تقنية كريسپر التقليدية، التي تقطع الجين، فإن تحرير القاعدة يستبدل حرفًا واحدًا من الحمض النووي بآخر.
يسمى الجين Verve الذي يتم تعديله بالانزيم PCSK9. لهذا الجين دور كبير في الحفاظ على مستويات LDL وتقول الشركة إن علاجه سيؤدي إلى إيقاف الجين عن طريق إدخال خطأ إملائي من حرف واحد.
قبل تأسيس شركة ڤرڤ، كان كاثيريسان عالِمًا في علم الوراثة يعمل في معهد برود في كامبريدج، ماساتشوستس، باحثًا عن أسباب وراثية لأمراض القلب. أسس شركة ڤرڤ بعد أن أصيب شقيقه سنثيل، بنوبة قلبية. كان يعتقد أن التعديل الأساسي يمكن أن يكون وسيلة لمنع مثل هذه المآسي.
أحد أسباب تقدم تقنية تعديل القواعد في ڤرڤ بسرعة هو أن التكنولوجيا تشبه إلى حد كبير لقاحات مرسال الرنا لڤيروس كوڤيد-19. تمامًا مثل اللقاحات، يتكون العلاج من تعليمات وراثية ملفوفة في جسيم نانوي، والذي ينقل كل شيء إلى خلية.
بينما يوجه اللقاح الخلايا لصنع مكون من ڤيروس سارس-كوڤ-2، فإن الجسيمات في علاج ڤرڤ تحمل توجيهات الحمض النووي الريبي للخلية لتجميع وتوجيه پروتين تعديل القاعدة، والذي يعدل بعد ذلك نسخة تلك الخلية من PCSK9، مقدمًا بذلك خطأ بسيط. في التجارب التي أجريت على القرود، وجد ڤرڤ أن العلاج خفض الكوليسترول الضار بنسبة 60%. استمر التأثير لأكثر من عام في الحيوانات ويمكن أن يكون دائمًا.
قد تنطوي التجربة البشرية على بعض المخاطر. الجسيمات النانوية سامة إلى حد ما، وهناك تقارير عن آثار جانبية، مثل آلام العضلات، لدى الأشخاص الذين يتناولون أدوية أخرى لخفض PCSK9. وبينما يمكن إيقاف العلاج بالأدوية العادية إذا ظهرت مشاكل، فلا توجد حتى الآن خطة للتراجع عن تعديل الجينات بمجرد إجراؤه.
حتى الآن، تكلف العلاجات الجينية القليلة المتوفرة في السوق مئات الآلاف من الدولارات - حتى ما يصل إلى مليوني دولار. ولكن يجب أن تكون منتجات ڤرڤ أرخص بكثير، خاصة إذا تم استخدامها على نطاق واسع. أحد الأسباب هو أنه في حين أن العلاجات الجينية الأخرى تستخدم ڤيروسات مُعدة خصيصًا لنقل الجينات، فإن الجسيمات النانوية تُصنع في عملية كيميائية أكثر عملية لتوسيع نطاقها.
يقول كيران موسونورو، خبير تحرير الجينات في جامعة پنسلڤانيا الذي شارك في تأسيس شركة ڤرڤ: "لقد أدى الوباء والحاجة الناشئة للقاحات إلى قدرة تصنيع واسعة النطاق". ويقول إن هذه القدرة "يمكن إعادة توظيفها بسهولة للعلاج الجيني"، و"بالطبع، القدرة الوفيرة تعني أسعارًا مخفضة".
يقول موسونورو إن الأشخاص يفكرون حتى في "الحقن المعززة" في حالة عدم اكتمال الجولة الأولى من تعديل الجينات، أو من أجل القضاء على جينات الكوليسترول الأخرى وتعميق التأثير على LDL. وهي ضربة حظ لمؤسسي ڤرڤأن السبب الرئيسي للوفاة في العالم هو أيضًا أول مشكلة شائعة يمكن أن يعالجها التعديل الجيني. يقول كاثيريسان، الذي يأخذ ستاتين للحفاظ على انخفاض مستوى الپروتين الدهني منخفض الكثافة لديه، أنه يعتقد أن تعديل الجينات للكوليسترول لديه القدرة على أن يكون علاجًا يطيل الحياة. ويضيف: "السبب الأول للوفيات في العالم هو النوبات القلبية". "إذا كنت ستتناول دواء يجعلك تتجنب نوبة قلبية، فإن الناس سيعيشون لفترة أطول."
معرض الصور
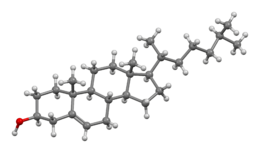
تخليق السترويدات، استخدام الكولسترول كمادة بناء.
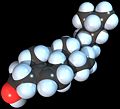
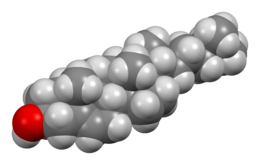
نموذج ملء الفراغ لجزيء الكولسترول.
ترقيم نوية السترويد.
انظر أيضاً
- قوس الشيخوخية "حلقة الكولسترول" في العينين
- مرض قلبي وعائي
- انسداد الكوليسترول
- التخليق الكلي للكولسترول
- فرط كولسترول الدم العائلي
- فرط كولسترول الدم "ارتفاع الكولسترول"
- نقص كولسترول الدم "انخفاض الكولسترول"
- Janus-faced molecule
- قائمة نسب الكوليسترول في الأطعمة
- مرض نيمان-پيك النوع ج
- الكولسترول المؤكسد
- Remnant cholesterol
مرئيات
| ما هو الكوليسترول؟ | |
|---|---|
| كيفية قراءة تحليل الكوليسترول؟ | 0 |
المصادر
- ^ أ ب ت "Cholesterol, 57-88-5". PubChem, National Library of Medicine, US National Institutes of Health. 9 November 2019. Retrieved 14 November 2019.
- ^ "Safety (MSDS) data for cholesterol". Archived from the original on 12 July 2007. Retrieved 2007-10-20.
- ^ MeSH Cholesterol
- ^ أ ب Hanukoglu I (December 1992). "Steroidogenic enzymes: structure, function, and role in regulation of steroid hormone biosynthesis". The Journal of Steroid Biochemistry and Molecular Biology. 43 (8): 779–804. doi:10.1016/0960-0760(92)90307-5. PMID 22217824. S2CID 112729.
- ^ Razin S, Tully JG (May 1970). "Cholesterol requirement of mycoplasmas". Journal of Bacteriology. 102 (2): 306–10. doi:10.1128/JB.102.2.306-310.1970. PMC 247552. PMID 4911537.
- ^ Chevreul (1816) "Recherches chimiques sur les corps gras, et particulièrement sur leurs combinaisons avec les alcalis. Sixième mémoire. Examen des graisses d'homme, de mouton, de boeuf, de jaguar et d'oie" (Chemical researches on fatty substances, and particularly on their combinations o filippos ine kapios with alkalis. Sixth memoir. Study of human, sheep, beef, jaguar and goose fat), Annales de Chimie et de Physique, 2 : 339–372. From page 346 : "Je nommerai cholesterine, de χολη, bile, et στερεος, solide, la substance cristallisée des calculs biliares humains, ... " (I will name cholesterine – from χολη (bile) and στερεος (solid) – the crystalized substance from human gallstones ... )
- ^ Olson RE (February 1998). "Discovery of the lipoproteins, their role in fat transport and their significance as risk factors". The Journal of Nutrition. 128 (2 Suppl): 439S–443S. doi:10.1093/jn/128.2.439S. PMID 9478044.
- ^ "National Health and Nutrition Examination Survey" (PDF). United States Center for Disease Control. Retrieved 2012-01-28.
- ^ Lecerf JM, de Lorgeril M (July 2011). "Dietary cholesterol: from physiology to cardiovascular risk". The British Journal of Nutrition. 106 (1): 6–14. doi:10.1017/S0007114511000237. PMID 21385506.
- ^ Soliman GA (June 2018). "Dietary Cholesterol and the Lack of Evidence in Cardiovascular Disease". Nutrients. 10 (6): 780. doi:10.3390/nu10060780. PMC 6024687. PMID 29914176.
- ^ Dubois C, Armand M, Mekki N, Portugal H, Pauli AM, Bernard PM, et al. (November 1994). "Effects of increasing amounts of dietary cholesterol on postprandial lipemia and lipoproteins in human subjects". Journal of Lipid Research. 35 (11): 1993–2007. doi:10.1016/S0022-2275(20)39946-6. PMID 7868978.
- ^ Behrman EJ, Gopalan V (2005). Scovell WM (ed.). "Cholesterol and Plants". Journal of Chemical Education. 82 (12): 1791. Bibcode:2005JChEd..82.1791B. doi:10.1021/ed082p1791.
- ^ John S, Sorokin AV, Thompson PD (February 2007). "Phytosterols and vascular disease". Current Opinion in Lipidology. 18 (1): 35–40. doi:10.1097/MOL.0b013e328011e9e3. PMID 17218830. S2CID 29213889.
- ^ Jesch ED, Carr TP (June 2017). "Food Ingredients That Inhibit Cholesterol Absorption". Preventive Nutrition and Food Science. 22 (2): 67–80. doi:10.3746/pnf.2017.22.2.67. PMC 5503415. PMID 28702423.
- ^ Agren JJ, Tvrzicka E, Nenonen MT, Helve T, Hänninen O (February 2001). "Divergent changes in serum sterols during a strict uncooked vegan diet in patients with rheumatoid arthritis". The British Journal of Nutrition. 85 (2): 137–9. doi:10.1079/BJN2000234. PMID 11242480.
- ^ Sadava D, Hillis DM, Heller HC, Berenbaum MR (2011). Life: The Science of Biology 9th Edition. San Francisco: Freeman. pp. 105–114. ISBN 978-1-4292-4646-0.
- ^ Ohvo-Rekilä H, Ramstedt B, Leppimäki P, Slotte JP (January 2002). "Cholesterol interactions with phospholipids in membranes". Progress in Lipid Research. 41 (1): 66–97. doi:10.1016/S0163-7827(01)00020-0. PMID 11694269.
- ^ Yeagle PL (October 1991). "Modulation of membrane function by cholesterol". Biochimie. 73 (10): 1303–10. doi:10.1016/0300-9084(91)90093-G. PMID 1664240.
- ^ Haines TH (July 2001). "Do sterols reduce proton and sodium leaks through lipid bilayers?". Progress in Lipid Research. 40 (4): 299–324. doi:10.1016/S0163-7827(01)00009-1. PMID 11412894.
- ^ Petersen EN, Chung HW, Nayebosadri A, Hansen SB (December 2016). "Kinetic disruption of lipid rafts is a mechanosensor for phospholipase D". Nature Communications. 7: 13873. Bibcode:2016NatCo...713873P. doi:10.1038/ncomms13873. PMC 5171650. PMID 27976674.
- ^ Incardona JP, Eaton S (April 2000). "Cholesterol in signal transduction". Current Opinion in Cell Biology. 12 (2): 193–203. doi:10.1016/S0955-0674(99)00076-9. PMID 10712926.
- ^ Pawlina W, Ross MW (2006). Histology: a text and atlas: with correlated cell and molecular biology. Philadelphia: Lippincott Williams & Wilkins. p. 230. ISBN 978-0-7817-5056-1.
- ^ Levitan I, Singh DK, Rosenhouse-Dantsker A (2014). "Cholesterol binding to ion channels". Frontiers in Physiology. 5: 65. doi:10.3389/fphys.2014.00065. PMC 3935357. PMID 24616704.
- ^ أ ب ت Wei W, Schwaid AG, Wang X, Wang X, Chen S, Chu Q, et al. (March 2016). "Ligand Activation of ERRα by Cholesterol Mediates Statin and Bisphosphonate Effects". Cell Metabolism. 23 (3): 479–91. doi:10.1016/j.cmet.2015.12.010. PMC 4785078. PMID 26777690.
- ^ أ ب ت ث Nuclear Receptors in Development and Disease. Elsevier Science. 17 May 2017. pp. 88–. ISBN 978-0-12-802196-5.
- ^ Payne AH, Hales DB (December 2004). "Overview of steroidogenic enzymes in the pathway from cholesterol to active steroid hormones". Endocrine Reviews. 25 (6): 947–70. doi:10.1210/er.2003-0030. PMID 15583024.
- ^ أ ب ت Elias, Peter (2006). Skin barrier. New York: Taylor & Francis. ISBN 9780824758158.
- ^ أ ب ت ث Merleev, AA; Le, ST; Alexanian, C; Toussi, A; Xie, Y; Marusina, AI; Watkins, SM; Patel, F; Billi, AC; Wiedemann, J; Izumiya, Y; Kumar, A; Uppala, R; Kahlenberg, JM; Liu, FT; Adamopoulos, IE; Wang, EA; Ma, C; Cheng, MY; Xiong, H; Kirane, A; Luxardi, G; Andersen, B; Tsoi, LC; Lebrilla, CB; Gudjonsson, JE; Maverakis, E (22 August 2022). "Biogeographic and disease-specific alterations in epidermal lipid composition and single-cell analysis of acral keratinocytes". JCI Insight. 7 (16). doi:10.1172/jci.insight.159762. PMC 9462509. PMID 35900871.
- ^ Elias, PM; Williams, ML; Maloney, ME; Bonifas, JA; Brown, BE; Grayson, S; Epstein EH, Jr (October 1984). "Stratum corneum lipids in disorders of cornification. Steroid sulfatase and cholesterol sulfate in normal desquamation and the pathogenesis of recessive X-linked ichthyosis". The Journal of Clinical Investigation. 74 (4): 1414–21. doi:10.1172/JCI111552. PMC 425309. PMID 6592175.
- ^ Cohn JS, Kamili A, Wat E, Chung RW, Tandy S (February 2010). "Dietary phospholipids and intestinal cholesterol absorption". Nutrients. 2 (2): 116–27. doi:10.3390/nu2020116. PMC 3257636. PMID 22254012.
- ^ "How it's made: Cholesterol production in your body" (in الإنجليزية الأمريكية). Harvard Health Publishing. Retrieved 2018-10-18.
- ^ أ ب "Biosynthesis and Regulation of Cholesterol (with Animation)". PharmaXChange.info. 17 September 2013.
- ^ "Cholesterol metabolism (includes both Bloch and Kandutsch-Russell pathways) (Mus musculus) – WikiPathways". www.wikipathways.org. Retrieved 2 February 2021.
- ^ Singh P, Saxena R, Srinivas G, Pande G, Chattopadhyay A (2013). "Cholesterol biosynthesis and homeostasis in regulation of the cell cycle". PLOS ONE. 8 (3): e58833. Bibcode:2013PLoSO...858833S. doi:10.1371/journal.pone.0058833. PMC 3598952. PMID 23554937.
- ^ "Kandutsch-Russell pathway". pubchem.ncbi.nlm.nih.gov (in الإنجليزية). Retrieved 2 February 2021.
- ^ Berg J (2002). Biochemistry. New York: WH Freeman. ISBN 978-0-7167-3051-4.
- ^ Rhodes CM, Stryer L, Tasker R (1995). Biochemistry (4th ed.). San Francisco: W.H. Freeman. pp. 280, 703. ISBN 978-0-7167-2009-6.
- ^ "The Nobel Prize in Physiology or Medicine, 1964". Nobel Prize, Nobel Media.
- ^ Espenshade PJ, Hughes AL (2007). "Regulation of sterol synthesis in eukaryotes". Annual Review of Genetics. 41: 401–27. doi:10.1146/annurev.genet.41.110306.130315. PMID 17666007.
- ^ Brown MS, Goldstein JL (May 1997). "The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor". Cell. 89 (3): 331–40. doi:10.1016/S0092-8674(00)80213-5. PMID 9150132. S2CID 17882616.
- ^ أ ب Tymoczko JL, Berg T, Stryer L, Berg JM (2002). Biochemistry. San Francisco: W.H. Freeman. pp. 726–727. ISBN 978-0-7167-4955-4.
- ^ أ ب ت ث ج ح خ Patton KT, Thibodeau GA (2010). Anatomy and Physiology (7 ed.). Mosby/Elsevier. ISBN 978-9996057762.
- ^ Mahley RW (July 2016). "Apolipoprotein E: from cardiovascular disease to neurodegenerative disorders". Journal of Molecular Medicine. 94 (7): 739–46. doi:10.1007/s00109-016-1427-y. PMC 4921111. PMID 27277824.
- ^ Weingärtner O, Pinsdorf T, Rogacev KS, Blömer L, Grenner Y, Gräber S, et al. (October 2010). Federici M (ed.). "The relationships of markers of cholesterol homeostasis with carotid intima-media thickness". PLOS ONE. 5 (10): e13467. Bibcode:2010PLoSO...513467W. doi:10.1371/journal.pone.0013467. PMC 2956704. PMID 20976107.
- ^ Lewis GF, Rader DJ (June 2005). "New insights into the regulation of HDL metabolism and reverse cholesterol transport". Circulation Research. 96 (12): 1221–1232. doi:10.1161/01.RES.0000170946.56981.5c. PMID 15976321.
- ^ Gordon DJ, Probstfield JL, Garrison RJ, Neaton JD, Castelli WP, Knoke JD, et al. (January 1989). "High-density lipoprotein cholesterol and cardiovascular disease. Four prospective American studies". Circulation. 79 (1): 8–15. doi:10.1161/01.CIR.79.1.8. PMID 2642759.
- ^ Miller NE, Thelle DS, Forde OH, Mjos OD (May 1977). "The Tromsø heart-study. High-density lipoprotein and coronary heart-disease: a prospective case-control study". Lancet. 1 (8019): 965–968. doi:10.1016/s0140-6736(77)92274-7. PMID 67464. S2CID 140204202.
- ^ Kandutsch AA, Chen HW, Heiniger HJ (August 1978). "Biological activity of some oxygenated sterols". Science. 201 (4355): 498–501. Bibcode:1978Sci...201..498K. doi:10.1126/science.663671. PMID 663671.
- ^ Russell DW (December 2000). "Oxysterol biosynthetic enzymes". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1529 (1–3): 126–35. doi:10.1016/S1388-1981(00)00142-6. PMID 11111082.
- ^ Hanukoglu I, Jefcoate CR (1980). "Pregnenolone separation from cholesterol using Sephadex LH-20 mini-columns". Journal of Chromatography A. 190 (1): 256–262. doi:10.1016/S0021-9673(00)85545-4.
- ^ Javitt NB (December 1994). "Bile acid synthesis from cholesterol: regulatory and auxiliary pathways". FASEB Journal. 8 (15): 1308–11. doi:10.1096/fasebj.8.15.8001744. PMID 8001744. S2CID 20302590.
- ^ Wolkoff AW, Cohen DE (February 2003). "Bile acid regulation of hepatic physiology: I. Hepatocyte transport of bile acids". American Journal of Physiology. Gastrointestinal and Liver Physiology. 284 (2): G175-9. doi:10.1152/ajpgi.00409.2002. PMID 12529265.
- ^ Marschall HU, Einarsson C (June 2007). "Gallstone disease". Journal of Internal Medicine. 261 (6): 529–42. doi:10.1111/j.1365-2796.2007.01783.x. PMID 17547709. S2CID 8609639.
- ^ Wipperman MF, Sampson NS, Thomas ST (2014). "Pathogen roid rage: cholesterol utilization by Mycobacterium tuberculosis". Critical Reviews in Biochemistry and Molecular Biology. 49 (4): 269–93. doi:10.3109/10409238.2014.895700. PMC 4255906. PMID 24611808.
- ^ Thomas ST, Sampson NS (April 2013). "Mycobacterium tuberculosis utilizes a unique heterotetrameric structure for dehydrogenation of the cholesterol side chain". Biochemistry. 52 (17): 2895–904. doi:10.1021/bi4002979. PMC 3726044. PMID 23560677.
- ^ Wipperman MF, Yang M, Thomas ST, Sampson NS (October 2013). "Shrinking the FadE proteome of Mycobacterium tuberculosis: insights into cholesterol metabolism through identification of an α2β2 heterotetrameric acyl coenzyme A dehydrogenase family". Journal of Bacteriology. 195 (19): 4331–41. doi:10.1128/JB.00502-13. PMC 3807453. PMID 23836861.
- ^ Christie WW (2003). Lipid analysis: isolation, separation, identification, and structural analysis of lipids. Ayr, Scotland: Oily Press. ISBN 978-0-9531949-5-7.
- ^ أ ب "Cholesterol content in foods, rank order per 100 g; In: USDA Food Composition Databases". United States Department of Agriculture. 2019. Retrieved 4 March 2019.[dead link]
- ^ Jensen RG, Hagerty MM, McMahon KE (June 1978). "Lipids of human milk and infant formulas: a review". The American Journal of Clinical Nutrition. 31 (6): 990–1016. doi:10.1093/ajcn/31.6.990. PMID 352132.
- ^ Sonawane PD, Pollier J, Panda S, Szymanski J, Massalha H, Yona M, et al. (December 2016). "Plant cholesterol biosynthetic pathway overlaps with phytosterol metabolism". Nature Plants. 3 (1): 16205. doi:10.1038/nplants.2016.205. PMID 28005066. S2CID 5518449.
- ^ De Smet E, Mensink RP, Plat J (July 2012). "Effects of plant sterols and stanols on intestinal cholesterol metabolism: suggested mechanisms from past to present". Molecular Nutrition & Food Research. 56 (7): 1058–72. doi:10.1002/mnfr.201100722. PMID 22623436.
- ^ European Food Safety Authority, Journal (2010). "Scientific opinion on the substantiation of health claims related to plant sterols and plant stanols and maintenance of normal blood cholesterol concentrations".
- ^ Goldman TR (31 March 2016). "Health Policy Brief: Final 2015-20 Dietary Guidelines for Americans". Health Affairs. doi:10.1377/hpb20160331.683121. Retrieved 7 June 2021.
- ^ Soliman GA (June 2018). "Dietary Cholesterol and the Lack of Evidence in Cardiovascular Disease". Nutrients. 10 (6): 780. doi:10.3390/nu10060780. PMC 6024687. PMID 29914176.
- ^ Carson JA, Lichtenstein AH, Anderson CA, Appel LJ, Kris-Etherton PM, Meyer KA, et al. (January 2020). "Dietary Cholesterol and Cardiovascular Risk: A Science Advisory From the American Heart Association". Circulation. 141 (3): e39–e53. doi:10.1161/CIR.0000000000000743. PMID 31838890.
- ^ Sacks FM, Lichtenstein AH, Wu JH, Appel LJ, Creager MA, Kris-Etherton PM, et al. (July 2017). "Dietary Fats and Cardiovascular Disease: A Presidential Advisory From the American Heart Association". Circulation. 136 (3): e1–e23. doi:10.1161/CIR.0000000000000510. PMID 28620111. S2CID 367602.
- ^ Ras RT, Geleijnse JM, Trautwein EA (July 2014). "LDL-cholesterol-lowering effect of plant sterols and stanols across different dose ranges: a meta-analysis of randomised controlled studies". The British Journal of Nutrition. 112 (2): 214–219. doi:10.1017/S0007114514000750. PMC 4071994. PMID 24780090.
- ^ Weingärtner O, Böhm M, Laufs U (February 2009). "Controversial role of plant sterol esters in the management of hypercholesterolaemia". European Heart Journal. 30 (4): 404–409. doi:10.1093/eurheartj/ehn580. PMC 2642922. PMID 19158117.
- ^ Brunzell JD, Davidson M, Furberg CD, Goldberg RB, Howard BV, Stein JH, Witztum JL (April 2008). "Lipoprotein management in patients with cardiometabolic risk: consensus statement from the American Diabetes Association and the American College of Cardiology Foundation". Diabetes Care. 31 (4): 811–22. doi:10.2337/dc08-9018. PMID 18375431.
- ^ Department of Health (UK), NHS Choices, "More evidence for Mediterranean diet". 8 March 2011. Access date: 11 Nov 2015
- ^ Durrington P (August 2003). "Dyslipidaemia". Lancet. 362 (9385): 717–31. doi:10.1016/S0140-6736(03)14234-1. PMID 12957096. S2CID 208792416.
- ^ أ ب Lewington S, Whitlock G, Clarke R, Sherliker P, Emberson J, Halsey J, et al. (December 2007). "Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths". Lancet. 370 (9602): 1829–39. doi:10.1016/S0140-6736(07)61778-4. PMID 18061058. S2CID 54293528.
- ^ "Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) Final Report" (PDF). National Institutes of Health. National Heart, Lung and Blood Institute. 1 September 2002. Retrieved 2008-10-27.
- ^ van der Steeg WA, Holme I, Boekholdt SM, Larsen ML, Lindahl C, Stroes ES, et al. (February 2008). "High-density lipoprotein cholesterol, high-density lipoprotein particle size, and apolipoprotein A-I: significance for cardiovascular risk: the IDEAL and EPIC-Norfolk studies". Journal of the American College of Cardiology. 51 (6): 634–42. doi:10.1016/j.jacc.2007.09.060. PMID 18261682.
- ^ Robinson JG, Wang S, Jacobson TA (November 2012). "Meta-analysis of comparison of effectiveness of lowering apolipoprotein B versus low-density lipoprotein cholesterol and nonhigh-density lipoprotein cholesterol for cardiovascular risk reduction in randomized trials". The American Journal of Cardiology. 110 (10): 1468–76. doi:10.1016/j.amjcard.2012.07.007. PMID 22906895.
- ^ Akioyamen LE, Genest J, Shan SD, Reel RL, Albaum JM, Chu A, Tu JV (September 2017). "Estimating the prevalence of heterozygous familial hypercholesterolaemia: a systematic review and meta-analysis". BMJ Open. 7 (9): e016461. doi:10.1136/bmjopen-2017-016461. PMC 5588988. PMID 28864697.
- ^ "Familial Hypercholesterolemia (FH)". www.heart.org (in الإنجليزية). Retrieved 2019-08-02.
- ^ "How Can I Lower High Cholesterol" (PDF). American Heart Association. Archived from the original (PDF) on 21 December 2015. Retrieved 2011-04-03.
- ^ "Diseases and Conditions. High cholesterol: Olive oil, Foods with added plant sterols or stanols, Other changes to your diet". Mayo Clinic. 2012. Retrieved 11 November 2015.
- ^ قالب:NICE
- ^ Mannu GS, Zaman MJ, Gupta A, Rehman HU, Myint PK (October 2012). "Update on guidelines for management of hypercholesterolemia". Expert Review of Cardiovascular Therapy. 10 (10): 1239–49. doi:10.1586/erc.12.94. PMID 23190064. S2CID 5451203.
- ^ Kizer JR, Madias C, Wilner B, Vaughan CJ, Mushlin AI, Trushin P, et al. (May 2010). "Relation of different measures of low-density lipoprotein cholesterol to risk of coronary artery disease and death in a meta-regression analysis of large-scale trials of statin therapy". The American Journal of Cardiology. 105 (9): 1289–96. doi:10.1016/j.amjcard.2009.12.051. PMC 2917836. PMID 20403481.
- ^ Grundy SM, Stone NJ, Bailey AL, Beam C, Birtcher KK, Blumenthal RS, et al. (June 2019). "2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines". Circulation. 139 (25): e1082–e1143. doi:10.1161/CIR.0000000000000625. PMC 7403606. PMID 30586774.
- ^ Nicholls SJ (August 2008). "Rosuvastatin and progression of atherosclerosis". Expert Review of Cardiovascular Therapy. 6 (7): 925–33. doi:10.1586/14779072.6.7.925. PMID 18666843. S2CID 46419583.
- ^ Heart Protection Study Collaborative Group (July 2002). "MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial". Lancet. 360 (9326): 7–22. doi:10.1016/S0140-6736(02)09327-3. PMID 12114036. S2CID 35836642.
- ^ Shepherd J, Cobbe SM, Ford I, Isles CG, Lorimer AR, MacFarlane PW, et al. (November 1995). "Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group". The New England Journal of Medicine. 333 (20): 1301–7. doi:10.1056/NEJM199511163332001. PMID 7566020.
- ^ Grundy SM (May 2007). "Should women be offered cholesterol lowering drugs to prevent cardiovascular disease? Yes". BMJ. 334 (7601): 982. doi:10.1136/bmj.39202.399942.AD. PMC 1867899. PMID 17494017.
- ^ Kendrick M (May 2007). "Should women be offered cholesterol lowering drugs to prevent cardiovascular disease? No". BMJ. 334 (7601): 983. doi:10.1136/bmj.39202.397488.AD. PMC 1867901. PMID 17494018.
- ^ Brugts JJ, Yetgin T, Hoeks SE, Gotto AM, Shepherd J, Westendorp RG, et al. (June 2009). "The benefits of statins in people without established cardiovascular disease but with cardiovascular risk factors: meta-analysis of randomised controlled trials". BMJ. 338: b2376. doi:10.1136/bmj.b2376. PMC 2714690. PMID 19567909.
- ^ "Report of the National Cholesterol Education Program Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. The Expert Panel". Archives of Internal Medicine. 148 (1): 36–69. January 1988. doi:10.1001/archinte.148.1.36. PMID 3422148.
- ^ "Cholesterol". American Heart Association. 30 April 2017. Retrieved 22 March 2019.
- ^ Alenghat FJ, Davis AM (February 2019). "Management of Blood Cholesterol". JAMA. 321 (8): 800–801. doi:10.1001/jama.2019.0015. PMC 6679800. PMID 30715135.
- ^ "Getting Your Cholesterol Checked". Centers for Disease Control and Prevention.
- ^ "About cholesterol". American Heart Association. 15 April 2021.
- ^ Warnick GR, Knopp RH, Fitzpatrick V, Branson L (January 1990). "Estimating low-density lipoprotein cholesterol by the Friedewald equation is adequate for classifying patients on the basis of nationally recommended cutpoints". Clinical Chemistry. 36 (1): 15–9. doi:10.1093/clinchem/36.1.15. PMID 2297909.
- ^ Anderson KM, Castelli WP, Levy D (24 April 1987). "Cholesterol and mortality. 30 years of follow-up from the Framingham study". JAMA. 257 (16): 2176–80. doi:10.1001/jama.1987.03390160062027. PMID 3560398.
- ^ Ulmer H, Kelleher C, Diem G, Concin H (2004). "Why Eve is not Adam: prospective follow-up in 149650 women and men of cholesterol and other risk factors related to cardiovascular and all-cause mortality". Journal of Women's Health. 13 (1): 41–53. doi:10.1089/154099904322836447. PMID 15006277.
- ^ Rizos CV, Elisaf MS, Liberopoulos EN (24 February 2011). "Effects of thyroid dysfunction on lipid profile". The Open Cardiovascular Medicine Journal. 5 (1): 76–84. doi:10.2174/1874192401105010076. PMC 3109527. PMID 21660244.
- ^ "How To Get Your Cholesterol Tested". American Heart Association. Retrieved 2013-07-10.
- ^ أ ب ت ث ج "Cholesterol test". Mayo Clinic. 15 May 2021. Retrieved 16 March 2022.
- ^ Stone NJ, Robinson J, Goff DC (2013). "Getting a grasp of the Guidelines". American College of Cardiology. Archived from the original on 7 July 2014. Retrieved 2 April 2014.
- ^ أ ب ت "Cholesterol levels". MedlinePlus, National Library of Medicine, US National Institutes of Health. 30 July 2020. Retrieved 16 March 2022.
- ^ Westover EJ, Covey DF, Brockman HL, Brown RE, Pike LJ (December 2003). "Cholesterol depletion results in site-specific increases in epidermal growth factor receptor phosphorylation due to membrane level effects. Studies with cholesterol enantiomers". The Journal of Biological Chemistry. 278 (51): 51125–33. doi:10.1074/jbc.M304332200. PMC 2593805. PMID 14530278.
- ^ Kristiana I, Luu W, Stevenson J, Cartland S, Jessup W, Belani JD, et al. (September 2012). "Cholesterol through the looking glass: ability of its enantiomer also to elicit homeostatic responses". The Journal of Biological Chemistry. 287 (40): 33897–904. doi:10.1074/jbc.M112.360537. PMC 3460484. PMID 22869373.
- ^ "Edits to a cholesterol gene could stop the biggest killer on earth". تكنولوجي رڤيو. 2022-07-12. Retrieved 2022-07-16.
وصلات خارجية
 Media related to كولسترول at Wikimedia Commons
Media related to كولسترول at Wikimedia Commons
- CS1 الإنجليزية الأمريكية-language sources (en-us)
- Articles with dead external links from October 2022
- Short description is different from Wikidata
- ECHA InfoCard ID from Wikidata
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- Articles with hatnote templates targeting a nonexistent page
- Articles with unsourced statements from March 2019
- Articles with unsourced statements from August 2017
- Articles that show a Medicine navs template
- كولستانات
- GABAA receptor positive allosteric modulators
- اضطرابات الدهون
- سترويدات عصبية
- تغذية
- ناهضات المستقبلات
- ستيرولات