أنتيمون
 | ||||||||||||||||||||||||||
| أنتيمون | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| المظهر | رمادي فضي براق | |||||||||||||||||||||||||
| الوزن الذري العياري Ar°(Sb) | ||||||||||||||||||||||||||
| أنتيمون في الجدول الدوري | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| الرقم الذري (Z) | 51 | |||||||||||||||||||||||||
| المجموعة | 15 | |||||||||||||||||||||||||
| الدورة | period 5 | |||||||||||||||||||||||||
| المستوى الفرعي | p-block | |||||||||||||||||||||||||
| التوزيع الإلكتروني | [Kr] 4d10 5s2 5p3 | |||||||||||||||||||||||||
| الإلكترونات بالغلاف | 2, 8, 18, 18, 5 | |||||||||||||||||||||||||
| الخصائص الطبيعية | ||||||||||||||||||||||||||
| الطور at د.ح.ض.ق | solid | |||||||||||||||||||||||||
| نقطة الانصهار | 903.78 K (630.63 °س، 1167.13 °F) | |||||||||||||||||||||||||
| نقطة الغليان | 1908 K (1635 °س، 2975 °ف) | |||||||||||||||||||||||||
| الكثافة حين يكون سائلاً (عند ن.إ.) | 6.53 ج/سم³ | |||||||||||||||||||||||||
| حرارة الانصهار | 19.79 kJ/mol | |||||||||||||||||||||||||
| حرارة التبخر | 193.43 kJ/mol | |||||||||||||||||||||||||
| السعة الحرارية المولية | 25.23 J/(mol·K) | |||||||||||||||||||||||||
ضغط البخار
| ||||||||||||||||||||||||||
| الخصائص الذرية | ||||||||||||||||||||||||||
| الكهرسلبية | مقياس پاولنگ: 2.05 | |||||||||||||||||||||||||
| طاقات التأين |
| |||||||||||||||||||||||||
| نصف القطر الذري | empirical: 140 pm | |||||||||||||||||||||||||
| نصف قطر التكافؤ | 139±5 pm | |||||||||||||||||||||||||
| نصف قطر ڤان در ڤالز | 206 pm | |||||||||||||||||||||||||
| خصائص أخرى | ||||||||||||||||||||||||||
| البنية البلورية | rhombohedral | |||||||||||||||||||||||||
| سرعة الصوت قضيب رفيع | 3420 م/ث (عند 20 °س) | |||||||||||||||||||||||||
| قضيب رفيع | 24.4 W/(m·K) | |||||||||||||||||||||||||
| المقاومة الكهربائية | 417 nΩ⋅m (at 20 °C) | |||||||||||||||||||||||||
| الترتيب المغناطيسي | مغناطيسية معاكسة[1] | |||||||||||||||||||||||||
| القابلية المغناطيسية | −99.0×10−6 cm3/mol[2] | |||||||||||||||||||||||||
| معامل يونگ | 55 GPa | |||||||||||||||||||||||||
| معامل القص | 20 GPa | |||||||||||||||||||||||||
| معاير الحجم | 42 GPa | |||||||||||||||||||||||||
| صلادة موز | 3.0 | |||||||||||||||||||||||||
| صلادة برينل | 294–384 MPa | |||||||||||||||||||||||||
| رقم كاس | 7440-36-0 | |||||||||||||||||||||||||
| التاريخ | ||||||||||||||||||||||||||
| الاكتشاف | الخيميائيون العرب (قبل 815) | |||||||||||||||||||||||||
| الرمز | "Sb": from Latin stibium 'stibnite' | |||||||||||||||||||||||||
| نظائر الأنتيمون | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
أنتيمون Antimony (ويُنطق: 'æntəməʊni) أو الكحل أو "حجر إثمد" هو عنصر كيميائي في الجدول الدوري يرمز له بالرمز Sb (لاتينية: stibium، تعني "علامة") ويحمل الرقم الذري 51. وهو فلز رمادي لامع أو شبه معدني، يوجد في الطبيعة بشكل أساسي على شكل معدن الإستبنيت الكبريتيدي (Sb2S3). كانت مركبات الأنتيمون معروفة منذ العصور القديمة وكانت تُطحن لاستخدامها في الطب ومستحضرات التجميل، وغالباً ما تُعرف بالاسم العربي الكحل.[5] أقدم وصف معروف للمادة شبه الفلزية في الغرب كتبه ڤانوتشيو بيرينگوتشيو عام 1540.
تعد الصين أكبر منتج للأنتيمون ومركباته، حيث يأتي معظم الإنتاج من منجم شيكوانگشان في هونان. الطرق الصناعية لتكرير الأنتيمون من الإستبنيت هي التحميص متبوعاً التفاعل الحراري الكربوني، أو الاختزال المباشر للإستبنيت بالحديد.
التطبيقات الأكثر شيوعاً للأنتيمون الفلزي هي في سبائك تحتوي على الرصاص والقصدير، والتي لها خصائص محسنة في اللحام والرصاص والمحامل الانزلاقية. كما أن الأنتيمون يحسن صلابة ألواح سبائك الرصاص في بطاريات الرصاص-الحمض. ثلاثي أكسيد الأنتيمون هو مادة رئيسية تضاف لمثبطات اللهب المحتوية على الهالوجين. يستخدم الأنتيمون كعامل إشابة في النبائط.
الخصائص


الأنتيمون هو أحد عناصر المجموعة 15 من الجدول الدوري، وهو أحد العناصر التي تسمى مجموعة النتروجين، وتبلغ سالبيته الكهربائية 2.05. ووفقاً للاتجاهات الدورية، فهو أكثر سالبية كهربائياً من القصدير أو البيزموث، وأقل سالبية كهربائية من التلوريوم أو الزرنيخ. يكون الأنتيمون مستقراً في الهواء عند درجة حرارة الغرفة، لكن إذا تم تسخينه، فإنه يتفاعل مع الأكسجين لإنتاج ثالث أكسيد الأنتيمون، Sb2O3.[6]
الأنتيمون هو شبه فلز رمادي لامع فضي اللون، تبلغ درجة صلابته 3 على مقياس موس، وهي درجة لينة للغاية بحيث لا يمكن تمييز الأشياء الصلبة بها. عام 1931 صدرت عملات معدنية من الأنتيمون في مدينة گويژو الصينية؛ وكانت متانتها ضعيفة، وسرعان ما توقف سكها.[7] الأنتيمون مقاوم لهجوم الأحماض.
التآصل المستقر الوحيد للأنتيمون في ظل الظروف القياسية[8] هو الشكل الفلزي، المتقصف، الأبيض الفضي، اللامع.
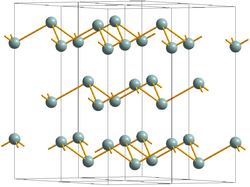
يتبلور الأنتيمون في خلية ثلاثية الزوايا، متماثلة الشكل مع البيزموث والتآاصل الرمادي للزرنيخ، ويتكون عندما يبرد الأنتيمون المنصهر ببطء. يتكون الأنتيمون الأسود غير المتبلور عند التبريد السريع لبخار الأنتيمون، وهو مستقر فقط كغشاء رقيق (سمكه بالنانومتر)؛ وتتحول العينات الأكثر سمكاً تلقائياً إلى الشكل الفلزي.[9] يتأكسد الأنتيمون في الهواء وقد يشتعل تلقائياً. عند 100 درجة مئوية، يتحول تدريجياً إلى الشكل المستقر. المتآصل الأصفر المفترض للأنتيمون، والذي يتولد فقط عن طريق أكسدة الستيبين (SbH3) عند 90 درجة مئوية، ويكون أيضاً غير نقياً وليس متآصلاً حقيقياً؛[10][11] فوق درجات الحرارة الأعلى وفي ضوء المحيط، يتحول إلى المتآصل الأسود الأكثر استقراراً.[12][13][14] يمكن تكوين شكل متفجر من الأنتيمون نادر من التحليل الكهربائي لثلاثي كلوريد الأنتيمون، لكنه يحتوي دائماً على كمية كبيرة من الكلور ولا يعد في الحقيقة متآصلًا للأنتيموان.[10] عند خدشه بأداة حادة، يحدث تفاعل طارد للحرارة وتتصاعد أبخرة بيضاء مع تشكل الأنتيمون الفلزي؛ عند فركه بمدقة في هاون، يحدث انفجار قوي.
يتبنى الأنتيمون العنصري بنية طبقية (الزمرة الفراغية R3m رقم 166) تتكون طبقاتها من حلقات مندمجة ومتموجة مكونة من ستة أعضاء. يشكل الجيران الأقرب والأقرب التالي مجمعاً ثماني السطوح غير منتظم، حيث تكون الذرات الثلاث في كل طبقة مزدوجة أقرب قليلاً من الذرات الثلاث في الطبقة التالية. يؤدي هذا التكديس الوثيق نسبيًا إلى كثافة عالية تبلغ 6.697 جم/سم³، لكن الرابطة الضعيفة بين الطبقات تؤدي إلى انخفاض صلابة وهشاشة الأنتيمون.[6]
النظائر
للأنتيمون نظيرين ثابتين: 121Sb بوفرة طبيعية تبلغ 57.36%، و 123Sb بوفرة طبيعية تبلغ 42.64%. ولديه أيضاً 35 نظيراً مشعاً، أطولها عمراً هو 125Sb بعمر نصف يبلغ 2.75 سنة. بالإضافة إلى ذلك، هناك 29 نظيراً غير مستقلاً. أكثرها استقراراً هو 120m1Sb بعمر نصف يبلغ 5.76 يوماً. النظائر الأخف من النظائر المستقرة هي 123Sb التي تميل إلى الاضمحلال بواسطة اضمحلال|اضحملال β+، والنظائر الأثقل التي تميل إلى الاضحلال بواسطة اضمحلال β−، مع بعض الاستثناءات.[15] الأنتيمون هو أخف العناصر التي لها نظير يضمحل بواسطة اضمحلال ألفا، باستثناء 8Be وغيرها من النويدات الخفيفة ذات انبعاث ألفا المتأخر بيتا.[15]
الوفرة

تقدر وفرة الأنتيمون في قشرة الأرض بنحو 0.2 جزء في المليون،[16] مقارنة بالثاليوم بنسبة 0.5 جزء في المليون، والفضة بنسبة 0.07 جزء في المليون. وهو العنصر الثالث والستين الأكثر وفرة في القشرة الأرضية. وعلى الرغم من أن هذا العنصر ليس وفيراً، إلا أنه يوجد في أكثر من 100 نوع من المعادن.[17] يتوجد الأنتيمون أحياناً بشكل طبيعي (على سبيل المثال في قمة الأنتيمون)، لكن غالباً ما يتوجد في كبريتيد الإستبنيت (Sb2S3) وهو معدن الخام السائد.[16]
المركبات
غالبًا ما تُصنف مركبات الأنتيمون وفقاً لحالة أكسدتها: Sb(III) وSb(V). حالة الأكسدة +5 هي الأكثر شيوعاً.[18]
الأكاسيد والهيدروكسيدات
عندما يحترق الأنتيمون في الهواء يتكون ثالث أكسيد الأنتيمون.[19] في الطور الغازي، يكون جزيء المركب Sb 4O 6، لكنه يتبلمر عند التكثيف.[6] قد يتكون خماسي أكسيد الأنتيمون (Sb 4O 10) فقط عن طريق الأكسدة مع حمض النيتريك المركز.[20]
يكون الأنتيمون أيضاً أكسيداً مختلط التكافؤ؛ وهو رباعي أكسيد الأنتيمون (Sb 2O 4)، الذي يتميز بكل من Sb(III) وSb(V).[20] على عكس أكاسيد الفوسفور والزرنيخ، فإن هذه الأكاسيد متذبذبة، ولا تشكل أحماض أكسدة محددة جيداً، وتتفاعل مع الأحماض لتكوين أملاح الأنتيمون.
حمض الأنتيمون Sb(OH) 3 غير معروف، لكن القاعدة المترافقة أنتيمونيت الصوديوم ([Na 3SbO 3] 4) تتشكل عند اندماج أكسيد الصوديوم وSb 4O 6.[21] تُعرف أيضاً فلزات الأنتيمون الانتقالية.[22] يتواجد حمض الأنتيمونيك فقط في صورة هيدرات HSb(OH) 6، مكوناً الأملاح في صورة أنيون الأنتيمونات Sb(OH)−6. عند تخفيف محلول يحتوي على هذا الأنيون، يحتوي الراسب على أكاسيد مختلطة.[22]
خام الأنتيمون الأكثر أهمية هو الإستبنيت (Sb 2S 3). تشمل معادن الكبريتيد الأخرى الپيرارگيريت (Ag 3SbS 3)، الزينكنيت، الجيمسونيت، والبولانگريت.[23] خماسي كبريتيد الأنتيمون هو مركب غير متكافئ، يتميز بوجود الأنتيمون في حالة الأكسدة +3 وروابط S–S.[24] هناك العديد من الثيوانتيمونيدات المعروفة، مثل [Sb 6S 10]2− و [Sb 8S 13]2− .[25]
الهاليدات
يشكل الأنتيمون سلسلتين من الهاليدات: SbX 3 وSbX 5. هاليدات ثلاثي فلوريد الأنتيمون SbF 3، وثلاثي كلوريد الأنتيمون SbCl 3، وثلاثي بروميد الأنتيمون SbBr 3، وثلاثي يوديد الأنتيمون SbI 3 جميعها مركبات جزيئية ذات بنية جزيئية هرمية ثلاثية الزوايا.
يُحضر ثلاثي فلوريد الأنتيمون SbF 3 من خلال تفاعل ثلاثي أكسيد الأنتيمون Sb 2O 3 مع حمض الهيدروفلوريك HF:[26]
- Sb 2O 3 + 6 HF → 2 SbF 3 + 3 H 2O
وهو أحد احماض لويس ويقبل أيونات الفلورايد بسهولة لتكوين الأنيونات المعقدة SbF−4 وSbF2−5. يعتبر ثلاثي فلوريد الأنتيمون SbF 3 المنصهر موصلاً ضعيفاً للكهرباء. يُحضر ثلاثي كلوريد الأنتيمون SbCl 3 عن طريق إذابة Sb 2S 3 في حمض الهيدروكلوريك:[27]
- Sb 2S 3 + 6 HCl → 2 SbCl 3 + 3 H 2S
لا يتأثر كبريتيد الزرنيخ بسهولة من حمض الهيدروكلوريك، لذا فإن هذه الطريقة توفر طريقاً لتحضير الأنتيمون الخالي من الزرنيخ.
تتمتع هاليدات خماسي فلوريد الأنتيمون SbF 5 وخماسي كلوريد الأنتيمون SbCl 5 الخماسية على ببنية جزيئية ثنائية الهرم ثلاثية الزوايا في الطور الغازي، لكن في الطور السائل، يكون خماسي فلوريد الأنتيمون SbF 5 پوليمر]، بينما يكون خماسي كلوريد الأنتيمون SbCl 5 مونومر.[28] خماسي فلوريد الأنتيمون SbF 5 هو حمض لويس قوي يستخدم في صنع حمض الفلوروأنتيمونيك الفائق ("H2SbF7").
الهاليدات الأكسيدية أكثر شيوعاً في الأنتيمون مقارنة بالزرنيخ والفوسفور. يذوب ثلاثي أكسيد الأنتيمون في حمض مركز لتكوين مركبات هاليدية أكسيدة مثل SbOCl و(SbO) 2SO 4.[29]
الأنتيمونيدات والهيدريدات ومركبات الأنتيمون العضوية
تُوصف المركبات في هذه الفئة عموماً بأنها مشتقات من Sb3−. يشكل الأنتيمون أنتيمونيدات مع الفلزات، مثل أنتيمونيد الإنديوم (InSb) وأنتيمونيد الفضة (Ag 3Sb).[30] إن الأنتيمونيدات الفلزية القلوية والزنكية، مثل Na3Sb وZn3Sb2، أكثر تفاعلية. إن معالجة هذه الأنتيمونيدات مع الحمض تنتج غازاً غير مستقر للغاية الستيبين، SbH 3:[31]
- Sb3− + 3 H+ → SbH 3
يمكن أيضاً إنتاج الستيبين عن طريق معالجة أملاح Sb3+ بكواشف الهيدريد مثل بوروهيدريد الصوديوم. يتحلل الستيبين تلقائياً في درجة حرارة الغرفة. ولأن حرارة تكوين الستيبين موجبة، فهو غير مستقر ثرموديناميكياً وبالتالي لا يتفاعل الأنتيمون مع الهيدروجين مباشرةً.[32]
تُحضر مركبات الأنتيمون العضوية عادةً عن طريق ألكلة هاليدات الأنتيمون باستخدام كواشف گرينيار.[33] هناك مجموعة كبيرة ومتنوعة من المركبات المعروفة بمركزي Sb(III) وSb(V)، بما في ذلك المشتقات الكلورو-العضوية المختلطة والأنيونات والكاتيونات. تشمل الأمثلة الستبين ثلاثي الفينيل (Sb(C6H5)3) والأنتيمون خماسي الفينيل (Sb(C6H5)5).[34]
التاريخ
في مصر قبل الأسرات، كان ثلاثي كبريتيد الأنتيمون Sb2S3 يستخدم ككحل للعين في وقت مبكر يعود إلى حوالي 3100 ق.م، عندما تم اختراع لوحة التجميل.[35]
عُثر على قطعة أثرية، قيل إنها جزء من مزهرية، مصنوعة من الأنتيمون يعود تاريخها إلى حوالي 3000 ق.م. في تيلو، كلدو (جزء من العراق المعاصر)، وعُثر على قطعة نحاسية مطلية بالأنتيمون يعود تاريخها إلى ما بين 2500 ق.م. و2200 ق.م. في مصر.[12] في محاضرة ألقاها هربرت گلادستون عام 1892، علق أوستن قائلاً: "نحن نعرف عن الأنتيمون في الوقت الحاضر فقط أنه فلز شديد الهشاشة والبلورية، والذي يصعب تحويله إلى مزهرية مفيدة، وبالتالي فإن هذا "الاكتشاف" الرائع (القطعة الأثرية المذكورة أعلاه) يجب أن يمثل الفن المفقود في جعل الأنتيمون قابلاً للتشكيل".[36]
لم يكن عالم الآثار البريطاني روجر موري مقتنعاً بأن القطعة الأثرية كانت في الواقع مزهرية، وذكر أن سليمخانوڤ، بعد تحليله لقطعة تيلو (التي نُشرت عام 1975)، "حاول ربط الفلز بالأنتيمون الطبيعي القوقازي" (أي الفلز الأصلي) وأن "قطع الأنتيمون القوقازية هي كلها زخارف شخصية صغيرة".[36] وهذا يضعف الدليل على وجود فن ضائع في "تحويل الأنتيمون إلى مادة قابلة للتشكيل".[36]
وقد وصف العالم الروماني پليني الأكبر عدة طرق لإعداد كبريتيد الأنتيمون لأغراض طبية في أطروحته التاريخ الطبيعي، حوالي عام 77 م.[37] كما قام پليني الأكبر بالتمييز بين الأشكال "الذكورية" و"الأنثوية" من الأنتيمون؛ الشكل الذكري هو على الأرجح الكبريتيد، في حين يُشتبه في أن الشكل الأنثوي، الذي هو أعلى وأثقل وأقل تفتتاً، هو الأنتيمون الفلزي الأصلي.[38]
ذكر عالم الطبيعة اليوناني ديوسقوريدس أن كبريتيد الأنتيمون يمكن تحميصه عن طريق التسخين بتيار من الهواء. ويُعتقد أن هذا يؤدي إلى إنتاج الأنتيمون الفلزي.[37]

وقد تم وصف الأنتيمون بشكل متكرر في المخطوطات الخيميائية، بما في ذلك كتاب خلاصة الكمال لجابر الزائف، الذي كتب حوالي القرن الرابع عشر.[39] لاحقاً قدم عالم الفلزات الإيطالي ڤانوتشيو بيرينگوتشيو وصف لطريقة عزل الأنتيمون في كتابه De la pirotechnia الصادر عام 1540،[40] ليسبق الكتاب الأكثر شهرة الذي كتبه أگريكولا عام 1556، بعنوان "عن الفلزات". وفي هذا السياق، غالباً ما يُنسب إلى أگريكولا اكتشافه للإنتيمون الفلزي بشكل غير صحيح. نُشر كتاب Currus Triumphalis Antimonii (عربة انتصار الأنتيمون)، الذي يصف تحضير الإنتيمون الفلزي، في ألمانيا عام 1604. ويُزعم أنه كتبه راهب بنديكتي، يكتب تحت اسم باسيليوس ڤالنتينوس في القرن الخامس عشر؛ وإذا كان أصلياً، وهو ليس كذلك، فإنه يسبق بيرينگوتشيو.[ب][13][43]
كان الكيميائي الألماني أندرياس ليبافيوس هو من اكتشف الأنتيمون الفلزي عام 1615، حيث حصل عليه بإضافة الحديد إلى خليط منصهر من كبريتيد الأنتيمون والملح وطرطرات البوتاسيوم. وقد أدى هذا الإجراء إلى إنتاج الأنتيمون بسطح بلوري أو نجمي.[37]
مع ظهور التحديات التي واجهت نظرية فلوگستون، تم الاعتراف بأن الأنتيمون هو عنصر يشكل الكبريتيدات والأكاسيد والمركبات الأخرى، كما تفعل الفلزات الأخرى.[37]
وُصف أول اكتشاف للأنتيمون النقي الطبيعي في قشرة الأرض بواسطة العالم السويدي ومهندس منطقة التعدين المحلية أنطون فون سواب عام 1783؛ جُمعت عينة نوعية من منجم سالا للفضة في منطقة تعدين برگسلاگن في بلدية سالا السويدية.[44][45]
الإنتاج
العملية
يعتمد استخراج الأنتيمون من الخامات على جودة الخام وتركيبه. يُستخرج معظم الأنتيمون على شكل كبريتيد؛ يتم تركيز الخامات ذات الدرجة الأدنى عن طريق التعويم الزبدي، بينما تُسخن الخامات ذات الدرجة الأعلى إلى 500-600 درجة مئوية، وهي درجة الحرارة التي يذوب عندها الإستبنيت وينفصل عن الشوائب المعدنية المتراكمة. يمكن عزل الأنتيمون من كبريتيد الأنتيمون الخام عن طريق الاختزال باستخدام خردة الحديد:[46]
- Sb 2S 3 + 3 Fe → 2 Sb + 3 FeS
يُحول الكبريتيد إلى أكسيد عن طريق التحميص. ثم يتم تنقية المنتج عن طريق تبخير ثلاثي أكسيد الأنتيمون المتطاير، والذي يتم استعادته.[27] غالباً ما يُستخدم هذا التسامي بشكل مباشر للتطبيقات الرئيسية، حيث تكون الشوائب عبارة عن زرنيخ وكبريتيد.[47][48] يُعزل الأنتيمون من الأكسيد عن طريق الاختزال الكربوني الحراري:[46][47]
- 2 Sb 2O 3 + 3 C → 4 Sb + 3 CO 2
تُختزل الخامات ذات الدرجة الأقل في الأفران اللافحة بينما تُختزل الخامات ذات الدرجة الأعلى في الأفران العاكسة.[46]

أكبر المنتجين وحجم الإنتاج
عام 2022، بحسب المسح الجيولوجي الأمريكي، كانت الصين تنتج 54.5% من إجمالي إنتاج الأنتيمون، تليها روسيا في المركز الثاني بنسبة إنتاج 18.2% وطاجيكستان بنسبة 15.5%.[49]
| البلد | طن | % من الإجمالي |
|---|---|---|
| 60.000 | 54.5 | |
| 20.000 | 18.2 | |
| 17.000 | 15.5 | |
| 4.000 | 3.6 | |
| 4.000 | 3.6 | |
| أكبر 5 | 105.000 | 95.5 |
| الإجمالي العالمي | 110.000 | 100.0 |
من المتوقع أن ينخفض إنتاج الصين من الأنتيمون في المستقبل مع إغلاق الحكومة للمناجم والمصاهر كجزء من مكافحة التلوث. وخاصة بسبب قانون حماية البيئة الذي دخل حيز التنفيذ في يناير 2015[50] وبعد أن دخلت "معايير انبعاث الملوثات الخاصة بالقصدير والانتيمون والزئبق" المنقحة حيز التنفيذ، أصبحت العقبات التي تعترض الإنتاج الاقتصادي أعلى.
وبحسب تقرير روسكيل، انخفض إنتاج الأنتيمون في الصين ومن غير المرجح أن يزداد في السنوات القادمة. ولم تُتطوير أي رواسب كبيرة من الأنتيمون في الصين منذ حوالي عشر سنوات، والاحتياطيات الاقتصادية المتبقية تستنفد بسرعة.[51]
الاحتياطات
| البلد | الاحتياطات (بالطن) |
|---|---|
| 350.000 | |
| 350.000 | |
| 310.000 | |
| 260.000 | |
| 140.000 | |
| 120.000 | |
| 100.000 | |
| 78.000 | |
| 60.000 | |
| 50.000 | |
| الإجمالي العالمي | >1.800.000 |
سلسلة التوريد الحرجة
بالنسبة للمناطق المستوردة للأنتيمون مثل أوروپا والولايات المتحدة، يعتبر الأنتيمون معدناً حرجاً للتصنيع الصناعي المعرض لخطر انقطاع سلسلة التوريد. ومع أن الإنتاج العالمي يأتي بشكل رئيسي من الصين (74%) وطاجيكستان (8%) وروسيا (4%)، فإن هذه المصادر حرجة للتوريد.[52][53]
- الاتحاد الأوروپي: يعتبر الأنتيمون مادة خام حرجة لصناعات الدفاع والسيارات والإنشاءات والنسيج. 100% من موارد الاتحاد الأوروپي مستوردة، وتأتي بشكل أساسي من تركيا (62%)، بوليڤيا (20%) وگواتيمالا (7%).[52]
- المملكة المتحدة: صنفت قائمة المخاطر لعام 2015 الصادرة عن المسح الجيولوجي البريطاني الأنتيمون في المرتبة الثانية (بعد العناصر الأرضية النادرة) على مؤشر مخاطر العرض النسبي.[54][55]
- الولايات المتحدة: يعتبر الانتيمون سلعة معدنية حرجة للأمن الاقتصادي والوطني.[56][53] عام 2022، لم يكن هناك أنتيمون يُعدن في الولايات المتحدة.[57]
مخاطر نقص الإمدادات
في 28 أغسطس 2024 أعلنت الصين فرض قيود على صادرات الأنتيمون، رداً على العقوبات الأمريكية عليها. إن الأنتيمون هو فلز غير معروف بشكل كبير وله تطبيقات متعددة. وقد يكون استخدامه كمادة مثبطة للهب هو الأكثر شهرة، لكن أهميته الأبرز هو استخدامه في صناعة الألواح الشمسية وبطاريات الرصاص-الحمض، والتي تستخدم في السيارات الكهربائية.
وقد صنفت وزارة الدفاع الأمريكية الأنتيمون كفلز بالغ الأهمية لأنه ضروري أيضاً لصناعة الذخيرة الخارقة للدروع وأجهزة استشعار الأشعة تحت الحمراء والبصريات الدقيقة. وكانت وزارة الدفاع الأمريكية تحتفظ بمخزونات تزيد قليلاً عن 90 طناً مترياً في نهاية سبتمبر 2022، وفقداً لخدمة أبحاث الكونگرس الأمريكي. وتفتح خطة المواد السنوية، التي تفتح علامة تبويب جديدة للسنة المالية الحالية (2024)، بشراء ما يصل إلى 1100 طن إضافية. وسوف يشكل هذا تحدياً صعباً إذا ما قررت الصين، المنتج المهيمن للأنتيمون في العالم، الحد من العرض العالمي.[58]
عام 2023، استعرضت بكين عضلاتها المعدنية بفرض قيود مماثلة على صادرات الگاليوم والجرمانيوم والگرافيت في رد بالمثل على الضوابط التي فرضتها الولايات المتحدة على صادرات رقائق أشباه الموصلات المتقدمة إلى الصين. ومن غير المرجح أن يكون الأنتيمون هو الفلز الاستراتيجي الأخير الذي يمكن استخدامه كسلاح في حرب تجارية محتملة مع الغرب، على غرار الحرب التجارية الأمريكية الصينية.
تضاعفت أسعار الأنتيمون تقريباً منذ بداية عام 2024 لتصل إلى مستوى قياسي بلغ 22.750 دولاراً للطن، وهو الفلز الأساسي الذي يتم تسليمه إلى شمال غرب أوروپا. ويرجع هذا جزئياً إلى انكماش صادرات المنتجين الرئيسيين. إذ تشهد صادرات الصين تراجعاً في الأمد المتوسط بسبب ارتفاع الطلب من قطاع الطاقة الشمسية، في حين تقلصت الإمدادات الروسية بسبب انخفاض الإنتاج والعقوبات الغربية. وتعطل تدفق الأنتيمون من دول منتجة كبيرة أخرى مثل ڤيتنام وطاجيكستان وميانمار بسبب إعادة توجيه الشحنات من البحر الأحمر بسبب هجمات الحوثيين على السفن. ويقدر المحللون في مشروع بلو أن السوق كانت تتطلع بالفعل إلى عجز قدره 10.000 طن قبل القيود التي فرضتها الصين.
ولا تفرض هذه القواعد الجديدة قيوداً صريحة على الصادرات، بل تلزم المصدرين بالتقدم بطلبات للحصول على تراخيص للمواد والتكنولوجيا المدنية والعسكرية ذات الاستخدام المزدوج، وهي عملية تستغرق عادة ما بين شهرين إلى ثلاثة أشهر في الصين. على الورق، لا تستهدف الضوابط أي بلد محدد، لكن السلطات الصينية يمكنها رفض التراخيص للتصدير إلى شركات أو بلدان فردية حسب ما تراه مناسباً. وإذا كان من الممكن الاعتماد على الگاليوم والجرمانيوم في تحديد الأسعار، فمن المتوقع حدوث انهيار في شحنات الأنتيمون الصادرة بمجرد دخول القواعد الجديدة حيز التنفيذ في 15 سبتمبر، يليه انتعاش ضعيف في أحجام المبيعات. وقد انخفضت الصادرات الصينية، التي تفتح علامة تبويب جديدة للفلزات النادرة، بنسبة 74% و63% على التوالي في الربع الأول على أساس سنوي.
إن ضوابط التصدير التي تفرضها الصين ليست أكثر من أداة للإشارة وليس هجوماً تجارياً صريحاً في هذه المرحلة. لقد بالغت بكين في استخدام نفوذها في مجال الفلزات عام 2010 عندما علقت شحنات الفلزات النادرة إلى اليابان. وخسرت قضية أمام منظمة التجارة العالمية، وشاهدت كيف أدت الأسعار المرتفعة إلى توليد موجة من الاستعاضة عن الفلزات النادرة. وهذه المرة، تُستخدم ضوابط التصدير كطلقات تحذيرية لردع الدول الغربية عن فرض المزيد من القيود على صادرات تكنولوجيا الجيل التالي مثل رقائق الحاسوب ذات الذكاء الاصطناعي. وتستهدف هذه الرسالة في المقام الأول الولايات المتحدة، حيث يوجد عداء ثنائي الحزبية للتحدي العسكري والتكنولوجي المتزايد الذي تمثله الصين.
وتظل الولايات المتحدة تعتمد بشكل كبير على الصين في الحصول على الأنتيمون. فقد استهلكت 22.000 طن من منتجات الأنتيمون عام 2023. وبلغ الإنتاج المحلي 4.000 طن فقط، أغلبها في هيئة رصاص الإثمد الذي يتم استعادته من بطاريات الرصاص-الحمض المستهلكة وامتصاصه مرة أخرى في سلسلة البطاريات.
وفقًا لهيئة المسح الجيولوجي الأمريكية، شكلت الصين 63% من واردات الولايات المتحدة من فلز وأكسيد الأنتيمون عام 2023. وتأتي بلجيكا في المرتبة التالية من حيث الحجم، بنسبة 8% فقط. وتأمل شركة محلية واحدة، وهي شركة پرپتوا ريسورز، في إعادة فتح منجم الإستبنيت للأنتيمون في ولاية أيداهو. وقد تلقت الشركة دعماً من كل من الپنتاگون وبنك التصدير والاستيراد الأمريكي. لكن مثل العديد من منتجي الفلزات المحليين المحتملين، تواجه شركة پرپتوا معارضة بيئية. ومن المقرر حالياً أن يبدأ الإنتاج الأول في المنجم عام 2028، على افتراض أن الشركة قادرة على اجتياز عملية الحصول على التصاريح.
من غير المرجح أن يكون الأنتيمون آخر المواد التي ستقيد الصين تصديرها، فقد يكون التنگستن هو الفلز الثانوي الآخر الذي تتداخل تطبيقاته المدنية والعسكرية وتهيمن الصين على سلسلة توريده. ففي نوفمبر 2023 أصدرت وزارة التجارة الصينية لوائح جديدة، وفرضت قيود على مصدري التنگستن والأنتيمون والفضة، بما في ذلك حد أدنى للسيولة المالية وسجل كامل للشحنات الخارجية خلال الفترة 2020-2022. في المقابل، حظر قانون REEShore الأمريكي بالفعل استخدام التنگستن الصيني في المعدات العسكرية بدءاً من عام 2026، مما يجعل هذا الفلز خياراً واضحاً للإشارة الانتقامية. ومع ذلك، فإن الصين ليست قليلة الخيارات عندما يتعلق الأمر بالاستفادة من هيمنتها في إنتاج الفلزات الحيوية. وتعتبر الصين أكبر مصدر لإمدادات 26 من الفلزات الخمسين التي صنفها المسح الجيولوجي الأمريكي على أنها بالغة الأهمية، وفقاً لمركز الدراسات الاستراتيجية والدولية.
التطبيقات
يُستهلد ما يقرب من 48% من الأنتيمون في صناعة مثبطات اللهب، و33% في صناعة بطاريات الرصاص-الحمضي، و8% في صناعة اللدائن.[46]
صناعة الأسلحة

يعتبر الأنتيمون من المواد الحرجة في صناعة الأسلحة. منذ الحرب العالمية الثانية كان الأنتيمون عنصراً أساسياً في تقنيات الدفاع، وكان حاسماً في تصنيع فولاذ التنجستن والطلقات المصنوعة من الرصاص. اليوم، يعد الأنتيمون مادة أساسية للذخيرة الخارقة للدروع، ونظارات الرؤية الليلية، وأجهزة الاستشعار بالأشعة تحت الحمراء، والبصريات الدقيقة. وقد فرضت الصراعات المستمرة في أوكرانيا والشرق الأوسط ضغوطاً إضافية على سلاسل توريد الأنتيمون، مع ارتفاع الطلب على الذخيرة وتقنيات الدفاع. زادت مبيعات المعدات العسكرية الأمريكية للحكومات الأجنبية بنسبة غير مسبوقة (16%) إلى 238 بليون دولار عام 2023. يعد الأنتيمون مادة ضرورية للقاعدة الصناعية الدفاعية الأمريكية وبالتالي فهو بالغ الأهمية للأمن القومي الأمريكي. ومع ذلك، تظل الولايات المتحدة تعتمد على الواردات الصينية لتلبية الطلب المحلي على الأنتيمون.[59]
مثبطات اللهب
يستخدم الأنتيمون بشكل أساسي كثلاثي أكسيد لصناعة المركبات المثبطة لللهب، دائماً بالاشتراك مع مثبطات اللهب المهلجنة باستثناء الپوليمرات المحتوية على الهالوجين. ينتج تأثير مثبط اللهب لثلاثي أكسيد الأنتيمون من خلال تكوين مركبات الأنتيمون المهلجنة،[60] التي تتفاعل مع ذرات الهيدروجين، وربما أيضاً مع ذرات الأكسجين وجذور الهيدروكسيل، وبالتالي تثبط الحريق.[61] تشمل أسواق مثبطات اللهب هذه ملابس الأطفال والألعاب والطائرات وأغطية مقاعد السيارات. كما تُضاف إلى راتنجات الپوليستر في مركبات الألياف الزجاجية لمنتجات مثل أغطية محركات الطائرات الخفيفة. يحترق الراتنج في وجود لهب خارجي، لكنه ينطفئ عند إزالة اللهب الخارجي.[27][62]
السبائك
يشكل الأنتيمون سبيكة مفيدة للغاية مع الرصاص، مما يزيد من صلابته وقوته الميكانيكية. عند الصب، يزيد من سيولة المصهور ويقلل من الانكماش أثناء التبريد.[63] بالنسبة لمعظم التطبيقات التي تتضمن الرصاص، تستخدم كميات متفاوتة من الأنتيمون كمعادن سبائكية. في بطاريات الرصاص-الحمض، تعمل هذه الإضافة على تحسين قوة اللوحة وخصائص الشحن.[27][64]
بالنسبة للقوارب الشراعية، تُستخدم عوارض الرصاص لتوفير عزم تصحيح يتراوح من 600 رطل إلى أكثر من 200 طن لليخوت الشراعية الضخمة الأكبر حجمًا؛ لتحسين صلابة وقوة الشد للعارضة الرصاصية، يُخلط الأنتيمون بالرصاص بنسبة تتراوح بين 2% و5% من حيث الحجم. يستخدم الأنتيمون في السبائك المضادة للاحتكاك (مثل معدن بابيت)،[65] في الرصاص وطلقات الرصاص، غلاف الكابلات الكهربائية، الفلزات النوعية (على سبيل المثال، لآلات طباعة لاينوتايب[66])، سبيكة لحام القصدير (بعض اللحامات "الخالية من الرصاص" تحتوي على 5% من الأنتيمون)،[67] في سبائك الپيوتر،[68] وفي تقوية السبائك ذات المحتوى المنخفض من القصدير في تصنيع أنانبي الأورجن .
تطبيقات أخرى
هناك ثلاث تطبيقات أخرى تستهلك ما يقرب من بقية الإمدادات العالمية.[46] ومن هذه التطبيقات استخدامه كمثبت ومحفز لإنتاج تريفثالات البولي إثيلين.[46] وهناك أيضاً مادة أخرى تستخدم كعامل تنقية لإزالة الفقاعات المجهرية في الزجاج، وخاصة لشاشات التلفزيون[69] – تتفاعل أيونات الأنتيمون مع الأكسجين، مما يؤدي إلى قمع ميل الأخير إلى تكوين فقاعات.[70] أما التطبيق الثالث فهو الصبغات.[46] في التسعينيات، كان الأنتيمون يستخدم بشكل متزايد في أشباه الموصلات كعامل إشابة في رقائق السليكون من النوع-ن[71] للصمامات الثنائية، كواشف الأشعة تحت الحمراء، وأجهزة تأثير هول. في الخمسينيات، كانت باعثات ومجمعات ترانزستورات الوصلة المسبوكة n-p-n تُطعم بحبيبات صغيرة من سبيكة الرصاص-الأنتيمون.[72] يستخدم أنتيمونيد الإنديوم (InSb) كمادة لكواشف الأشعة تحت الحمراء المتوسطة.[73][74][75]

يُستخدم الجرمانيوم-الأنتيمون-التلوريوم (Ge2Sb2Te5</sub) في ذاكرة تغيير الطور، إحدى أنواع ذاكرة الحاسوب.
لا يوجد سوى استخدامات قليلة للأنتيمون في علم الأحياء والطب. تُستخدم العلاجات التي تحتوي على الأنتيمون، والمعروفة باسم الأنتيمونيال، كمواد كمقيئات.[76] تُستخدم مركبات الأنتيمون كأدوية مضادة للطفيليات الأولية. استُخدمت طرطرات أنتيمونيل البوتاسيوم، أو المقيء الطرطري، كدواء مضاد للبلهارسيا منذ عام 1919. ثم استُبدلت لاحقاً بالپرازيكوانتل.[77] يستخدم الأنتيمون ومركباته في العديد من المستحضرات البيطرية، مثل الأنثيومالين وثيومالات أنتيمون الليثيوم، كمرطب للجلد في المجترات.[78]
يتمتع الأنتيمون بتأثير مغذي أو منعم للأنسجة الكراتينية في الحيوانات.
تعتبر الأدوية التي تحتوي على الأنتيمون، مثل أنتيمونيات المگلومين، هي الأدوية المفضلة لعلاج داء الليشمانيات. استخدمت العلاجات المبكرة أنواع الأنتيمون (الثلاثي) لكن في عام 1922 اخترع أوپندرانا براهماتشاري عقاراً أكثر أماناً يحتوي على الأنتيمون (الخماسي)، ومنذ ذلك الحين أصبح ما يسمى بالأنتيمون الخماسي هو العلاج القياسي من الخط الأول. ومع ذلك، طورت سلالات ليشمانيا في بيهار والمناطق المجاورة مقاومة للأنتيمون.[79] كان الأنتيمون العنصري يستخدم كدواء على شكل حبوب. وكان من الممكن إعادة استخدامه من قبل الآخرين بعد تناوله وإخراجه من الجسم.[80]
كان ثلاثي كبريتيد الأنتيمون يستخدم في رؤوس بعض أنواع أعواد الثقاب الآمن.[81][82] تساعد كبريتيدات الأنتيمون على تثبيت معامل الاحتكاك في مواد وسادات فرامل السيارات.[83] يستخدم الأنتيمون في طلقات الرصاص، ومتتبعات طلقات الرصاص،[84] الطلاء، وفن الزجاج، وكمادة معتمة في المينا المزججة. يستخدم الأنتيمون-124 مع البريليوم في مصادر النيوترون؛ حيث تبدأ آشعة گاما المنبعثة من الأنتيمون-124 عملية الانحلال الضوئي للبريليوم.[85][86] تبلغ الطاقة المتوسطة للنيوترونات المنبعثة 24 keV.[87] يستخدم الأنتيمون الطبيعي في مصادر النيوترونات الناشئة.
لآلاف السنين كان المسحوق المحضر من كبريتيد الأنتيمون المسحوق (الكحل) كمستحضر تجميلي للعين. تاريخياً، كان يُوضع على العينين بقضيب معدني بعد تبليله بلعاب الشخص، وكان القدماء يعتقدون أنه يساعد في علاج التهابات العين.[88]لا تزال هذا الممارسة موجودة في اليمن وبعض البلدان الإسلامية الأخرى.[89]
احتياطات السلامة
إن الأنتيمون والعديد من مركباته سامة، وتأثيرات التسمم بالأنتيمون تشبه تأثيرات التسمم بالزرنيخ. إن سمية الأنتيمون أقل بكثير من سمية الزرنيخ؛ وقد يكون هذا بسبب الاختلافات الكبيرة في الامتصاص والأيض والإخراج بين الزرنيخ والأنتيمون. إن امتصاص الأنتيمون الثلاثي أو الانتيمون الخماسي في الجهاز الهضمي لا يتجاوز 20%. لا يُختزل الأنتيمون الخماسي كمياً في الخلية إلى الأنتيمون الثلاثي (في الواقع، بدلاً من ذلك يتأكسد الأنتيمون الثلاثي إلى الأنتيمون الخماسي[90]).
نظرًا لعدم حدوث مثيلة للأنتيمون، فإن إفراز الأنتيمون الخماسي في البول هو الطريقة الرئيسية للتخلص منه.[91]
مثل الزرنيخ، فإن التأثير الأكثر خطورة للتسمم الحاد بالأنتيمون هو تسمم القلب والتهاب عضلة القلب الناتج عنها؛ ومع ذلك، يمكن أن يتجلى أيضاً في متلازمة آدامز-ستوكس، وهو ما لا يحدث مع الزرنيخ. تم الإبلاغ عن حالات التسمم بالأنتيمون بما يعادل 90 مجم من طرطرات البوتاسيوم الأنتيمون المذابة من مينا الأسنان لإظهار تأثيرات قصيرة المدى فقط. كما أبلغ عن أن التسمم بنحو 6 جم من طرطرات البوتاسيوم الأنتيمون يؤدي إلى الوفاة بعد ثلاثة أيام.[92]
إن استنشاق غبار الأنتيمون ضار وقد يكون مميتاً في بعض الحالات؛ ففي الجرعات الصغيرة، يسبب الأنتيمون الصداع، والدوار، والاكتئاب. أما الجرعات الأكبر عند ملامستها الجلد لفترة طويلة فقد تسبب التهاب الجلد، أو تلف الكلى والكبد، مما يسبب القيء العنيف والمتكرر، مما يؤدي إلى الوفاة في غضون أيام قليلة.[93]
لا يتوافق الأنتيمون مع عوامل الأكسدة القوية، أو الأحماض القوية، أو الأحماض الهالوجينية، أو الكلور، أو الفلور. ويجب حفظه بعيداً عن الحرارة.[94]
يرتشح الأنتيمون من زجاجات تريفثالات البولي إثيلين إلى السوائل.[95] في حين أن المستويات التي تم رصدها في المياه المعبأة أقل مما هو مكتوب في إرشادات مياه الشرب،[96] وجد أن مركزات عصير الفاكهة (التي لم تُوضع عليها إرشادات) المنتجة في المملكة المتحدة تحتوي على ما يصل إلى 44.7 ميكروجرام/لتر من الأنتيمون، وهو ما يتجاوز بكثير حدود الاتحاد الأوروپي لمياه الصنبور البالغة 5 ميكروجرام/لتر.[97] الإرشادات التالية لكميات الأنتيمون بحسب المنظمة:
- منظمة الصحة العالمية: 20 ميكروجرام/لتر[98]
- اليابان: 15 ميكروجرام/لتر[99]
- وكالة حماية البيئة الأمريكية، وزارة الصحة الكندية ووزارة البيئة في أونتاريو: 6 ميكروجرام/لتر[100]
- الاتحاد الأوروپي ووزارة البيئة الألمانية: 5 ميكروجرام/لتر[96]
الجرعة اليومية المقبولة التي اقترحتها منظمة الصحة العالمية هي 6 ميكروجرام من الأنتيمون لكل كيلوجرام من وزن الجسم.[98] القيمة الخطرة الفورية على الحياة أو الصحة للأنتيمون هي 50 مجم/م³.[101]
السمية
يبدو أن بعض مركبات الأنتيمون سامة، وخاصة ثالث أكسيد الأنتيمون وطرطرات البوتاسيوم الأنتيمون.[102] وقد تكون التأثيرات مشابهة لتسمم الزرنيخ.[103]
قد يؤدي التعرض المهني للأنتيمون إلى تهيج الجهاز التنفسي، والسحار الرئوي، وبقع الأنتيمون على الجلد، وأعراض الجهاز الهضمي، وعدم انتظام ضربات القلب. بالإضافة إلى ذلك، فإن ثالث أكسيد الأنتيمون قد يكون مسبباً للسرطان لدى البشر.[104]
لوحظت تأثيرات صحية ضارة على البشر والحيوانات بعد استنشاق الإنتيمون ومركباته أو التعرض لها عن طريق الفم أو الجلد.[102] تحدث سمية الأنتيمون عادةً إما بسبب التعرض المهني أو أثناء العلاج أو من خلال الابتلاع العرضي. ومن غير الواضح ما إذا كان الأنتيمون يمكن أن يدخل الجسم من خلال الجلد.[102] قد يكون وجود مستويات منخفضة من الأنتيمون في اللعاب مرتبطاً أيضاً تسوس الأسنان.[105]
مرئيات
| الصين تمنع بيع الأنتيمون رداً على العقوبات الأمريكية، سبتمبر 2024. |
الهوامش
- ^ التمدد الحراري متباين الخواص: the parameters (at 20 °C) for each crystal axis are αah = 8.24×10−6/K, αch = 16.62×10−6/K, and αaverage = αV/3 = 11.04×10−6/K.[4]
- ^ Already in 1710 Wilhelm Gottlob Freiherr von Leibniz, after careful inquiry, concluded the work was spurious, there was no monk named Basilius Valentinus, and the book's author was its ostensible editor, Johann Thölde (c. 1565 – c. 1624). Professional historians now agree the Currus Triumphalis ... was written after the middle of the 16th century and Thölde was likely its author.[41] Harold Jantz was perhaps the only modern scholar to deny Thölde's authorship, but he too agrees the work dates from after 1550.[42]
المصادر
- ^ Lide, D. R., ed. (2005). "Magnetic susceptibility of the elements and inorganic compounds". CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). "The NUBASE2020 evaluation of nuclear properties" (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ أ ب ت Arblaster, John W. (2018). Selected Values of the Crystallographic Properties of Elements. Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ David Kimhi's Commentary on Isaiah 4:30 and I Chronicles 29:2; Hebrew: פוך/כְּחֻל, Aramaic: כּוּחְלִי/צדידא; Arabic: كحل، والذي يمكن أيضاً أن يشير إلى ثلاثي كبريتيد الأنتيمون. انظر أيضاً Z. Dori, Antimony and Henna (Heb. הפוך והכופר), Jerusalem 1983 (Hebrew).
- ^ أ ب ت Wiberg and Holleman, p. 758
- ^ "Metals Used in Coins and Medals". ukcoinpics.co.uk. Archived from the original on 26 December 2010. Retrieved 16 October 2009.
- ^ Ashcheulov, A. A.; Manyk, O. N.; Manyk, T. O.; Marenkin, S. F.; Bilynskiy-Slotylo, V. R. (2013). "Some Aspects of the Chemical Bonding in Antimony". Inorganic Materials. 49 (8): 766–769. doi:10.1134/s0020168513070017. S2CID 54954678.
- ^ Shen, Xueyang; Zhou, Yuxing; Zhang, Hanyi; Derlinger, Volker L.; Mazzarello, Riccardo; Zhang, Wei (2023). "Surface effects on the crystallization kinetics of amorphous antimony". Nanoscale. 15 (37): 15259–15267. doi:10.1039/D3NR03536K. PMID 37674458. S2CID 261552619.
- ^ أ ب قالب:RubberBible82nd
- ^ Krebs, H.; Schultze-Gebhardt, F.; Thees, R. (1955). "Über die Struktur und die Eigenschaften der Halbmetalle. IX: Die Allotropie des Antimons". Zeitschrift für anorganische und allgemeine Chemie (in الألمانية). 282 (1–6): 177–195. doi:10.1002/zaac.19552820121.
- ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةkirk - ^ أ ب Wang, Chung Wu (1919). "The Chemistry of Antimony" (PDF). Antimony: Its History, Chemistry, Mineralogy, Geology, Metallurgy, Uses, Preparation, Analysis, Production and Valuation with Complete Bibliographies. London, United Kingdom: Charles Geiffin and Co. Ltd. pp. 6–33. Archived (PDF) from the original on 2022-10-09.
- ^ Norman 1998, [[[:قالب:GBUrl]] pp. 50–51]
- ^ أ ب Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A 729: 3–128, doi:, Bibcode: 2003NuPhA.729....3A, https://hal.archives-ouvertes.fr/in2p3-00020241/document
- ^ أ ب Greenwood and Earnshaw, p. 548
- ^ Antimony minerals. mindat.org
- ^ Greenwood and Earnshaw, p. 553
- ^ Reger, Daniel L.; Goode, Scott R. & Ball, David W. (2009). Chemistry: Principles and Practice (3rd ed.). Cengage Learning. p. 883. ISBN 978-0-534-42012-3.
- ^ أ ب House, James E. (2008). Inorganic chemistry. Academic Press. p. 502. ISBN 978-0-12-356786-4.
- ^ Wiberg and Holleman, p. 763
- ^ أ ب Godfrey, S. M.; McAuliffe, C. A.; Mackie, A. G. & Pritchard, R. G. (1998). Norman, Nicholas C. (ed.). Chemistry of arsenic, antimony, and bismuth. Springer. ISBN 978-0-7514-0389-3.
- ^ Wiberg and Holleman, p. 757
- ^ Long, G.; Stevens, J. G.; Bowen, L. H.; Ruby, S. L. (1969). "The oxidation number of antimony in antimony pentasulfide". Inorganic and Nuclear Chemistry Letters. 5: 21. doi:10.1016/0020-1650(69)80231-X.
- ^ Lees, R.; Powell, A.; Chippindale, A. (2007). "The synthesis and characterisation of four new antimony sulphides incorporating transition-metal complexes". Journal of Physics and Chemistry of Solids. 68 (5–6): 1215. Bibcode:2007JPCS...68.1215L. doi:10.1016/j.jpcs.2006.12.010.
- ^ Wiberg and Holleman, pp. 761–762
- ^ أ ب ت ث Grund, Sabina C.; Hanusch, Kunibert; Breunig, Hans J.; Wolf, Hans Uwe (2006) "Antimony and Antimony Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a03_055.pub2
- ^ Wiberg and Holleman, p. 761
- ^ Wiberg and Holleman, p. 764
- ^ Wiberg and Holleman, p. 760
- ^ Kahlenberg, Louis (2008). Outlines of Chemistry – A Textbook for College Students. READ BOOKS. pp. 324–325. ISBN 978-1-4097-6995-8.
- ^ Greenwood and Earnshaw, p. 558
- ^ Elschenbroich, C. (2006) "Organometallics". Wiley-VCH: Weinheim. ISBN 3-527-29390-6
- ^ Greenwood and Earnshaw, p. 598
- ^ Shortland, A. J. (2006). "Application of Lead Isotope Analysis to a Wide Range of Late Bronze Age Egyptian Materials". Archaeometry. 48 (4): 657. doi:10.1111/j.1475-4754.2006.00279.x.
- ^ أ ب ت Moorey, P. R. S. (1994). Ancient Mesopotamian Materials and Industries: the Archaeological Evidence. New York: Clarendon Press. p. 241. ISBN 978-1-57506-042-2.
- ^ أ ب ت ث Mellor, Joseph William (1964). "Antimony". A comprehensive treatise on inorganic and theoretical chemistry. Vol. 9. p. 339.
- ^ Pliny, Natural history, 33.33; W.H.S. Jones, the Loeb Classical Library translator, supplies a note suggesting the identifications.
- ^ Montserrat Filella, ed. (2021). Antimony. De Gruyter. p. 4. ISBN 9783110668711.
- ^ Vannoccio Biringuccio, De la Pirotechnia (Venice (Italy): Curtio Navo e fratelli, 1540), Book 2, chapter 3: Del antimonio & sua miniera, Capitolo terzo (On antimony and its ore, third chapter), pp. 27–28. [Note: Only every second page of this book is numbered, so the relevant passage is to be found on the 74th and 75th pages of the text.] (in Italian)
- ^ Priesner, Claus; Figala, Karin, eds. (1998). Alchemie. Lexikon einer hermetischen Wissenschaft (in الألمانية). München: C.H. Beck. ISBN 3406441068.
- ^ Harold Jantz Collection of German Baroque Literature Reel Listing.
- ^ Weeks, Mary Elvira (1932). "The discovery of the elements. II. Elements known to the alchemists". Journal of Chemical Education. 9 (1): 11. Bibcode:1932JChEd...9...11W. doi:10.1021/ed009p11.
- ^ "Native antimony". Mindat.org.
- ^ Klaproth, M. (1803). "XL. Extracts from the third volume of the analyses". Philosophical Magazine. Series 1. 17 (67): 230. doi:10.1080/14786440308676406.
- ^ أ ب ت ث ج ح خ Klochko, Kateryna (2021). "2017 Minerals Yearbook: Antimony" (PDF). United States Geological Survey.
- ^ أ ب Norman 1998, [[[:قالب:GBUrl]] p. 45]
- ^ Wilson, N. J.; Craw, D.; Hunter, K. (2004). "Antimony distribution and environmental mobility at an historic antimony smelter site, New Zealand". Environmental Pollution. 129 (2): 257–66. Bibcode:2004EPoll.129..257W. doi:10.1016/j.envpol.2003.10.014. PMID 14987811.
- ^ أ ب ت ث "Antimony Statistics and Information" (PDF). National Minerals Information Center. USGS.
- ^ "Environmental Protection Law of the People's Republic of China" (PDF). 24 April 2014. Archived from the original (PDF) on 2 June 2014. Retrieved 14 October 2016.
- ^ "Study of the antimony market by Roskill Consulting Group" (PDF). Archived from the original (PDF) on 18 October 2012. Retrieved 9 April 2012.
- ^ أ ب "Critical Raw Materials Resilience: Charting a Path towards greater Security and Sustainability". European Commission. 2020. Retrieved 2 February 2022.
- ^ أ ب Nassar, Nedal T.; et al. (2020-02-21). "Evaluating the mineral commodity supply risk of the U.S. manufacturing sector". Sci. Adv. 6 (8): eaay8647. Bibcode:2020SciA....6.8647N. doi:10.1126/sciadv.aay8647. PMC 7035000. PMID 32128413.
- ^ "MineralsUK Risk List 2015". BGS.
- ^ "British Geological Survey Risk list 2015" (PDF). Minerals UK. BGS. Archived (PDF) from the original on 2022-10-09. Retrieved 2 February 2022.
- ^ "Interior Releases 2018's Final List of Critical Minerals". United States Geological Survey. Retrieved 1 February 2022.
- ^ "Antimony". U.S. Geological Survey, Mineral Commodity Summaries, January 2022 (PDF). Archived (PDF) from the original on 2022-10-09. Retrieved 1 February 2022.
- ^ "China fires latest warning signal with antimony controls". رويترز. 2024-08-29. Retrieved 2024-09-04.
- ^ "China's Antimony Export Restrictions: The Impact on U.S. National Security". csis.org. 2024-08-20. Retrieved 2024-09-05.
- ^ Weil, Edward D.; Levchik, Sergei V. (4 June 2009). "Antimony trioxide and Related Compounds". Flame retardants for plastics and textiles: Practical applications. Hanser. ISBN 978-3-446-41652-9.
- ^ Hastie, John W. (1973). "Mass spectrometric studies of flame inhibition: Analysis of antimony trihalides in flames". Combustion and Flame. 21 (1): 49. Bibcode:1973CoFl...21...49H. doi:10.1016/0010-2180(73)90006-0.
- ^ Weil, Edward D.; Levchik, Sergei V. (4 June 2009). Flame retardants for plastics and textiles: Practical applications. Hanser. pp. 15–16. ISBN 978-3-446-41652-9.
- ^ Butterman, W.C.; Carlin, Jr., J.F. (2004). "Mineral Commodity Profiles - Antimony" (PDF). U.S. Geological Survey. Archived (PDF) from the original on 24 March 2024. Retrieved 18 July 2024.
- ^ Kiehne, Heinz Albert (2003). "Types of Alloys". Battery Technology Handbook. CRC Press. pp. 60–61. ISBN 978-0-8247-4249-2.
- ^ Williams, Robert S. (2007). Principles of Metallography. Read books. pp. 46–47. ISBN 978-1-4067-4671-6.
- ^ Holmyard, E. J. (2008). Inorganic Chemistry – A Textbook for Colleges and Schools. Read Books. pp. 399–400. ISBN 978-1-4437-2253-7.
- ^ Ipser, H.; Flandorfer, H.; Luef, Ch.; Schmetterer, C.; Saeed, U. (2007). "Thermodynamics and phase diagrams of lead-free solder materials". Journal of Materials Science: Materials in Electronics. 18 (1–3): 3–17. doi:10.1007/s10854-006-9009-3. S2CID 85452380.
- ^ Hull, Charles (1992). Pewter. Osprey Publishing. pp. 1–5. ISBN 978-0-7478-0152-8.
- ^ De Jong, Bernard H. W. S.; Beerkens, Ruud G. C.; Van Nijnatten, Peter A. (2000). "Glass". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a12_365. ISBN 978-3-527-30673-2.
- ^ Yamashita, H.; Yamaguchi, S.; Nishimura, R.; Maekawa, T. (2001). "Voltammetric Studies of Antimony Ions in Soda-lime-silica Glass Melts up to 1873 K". Analytical Sciences. 17 (1): 45–50. doi:10.2116/analsci.17.45. PMID 11993676.
- ^ O'Mara, William C.; Herring, Robert B.; Hunt, Lee Philip (1990). Handbook of semiconductor silicon technology. William Andrew. p. 473. ISBN 978-0-8155-1237-0.
- ^ Maiti, C. K. (2008). Selected Works of Professor Herbert Kroemer. World Scientific, 2008. p. 101. ISBN 978-981-270-901-1.
- ^ Committee on New Sensor Technologies: Materials And Applications, National Research Council (U.S.) (1995). Expanding the vision of sensor materials. National Academies Press. p. 68. ISBN 978-0-309-05175-0.
- ^ Kinch, Michael A (2007). Fundamentals of infrared detector materials. SPIE Press. p. 35. ISBN 978-0-8194-6731-7.
- ^ Willardson, Robert K & Beer, Albert C (1970). Infrared detectors. Academic Press. p. 15. ISBN 978-0-12-752105-3.
- ^ Russell, Colin A. (2000). "Antimony's Curious History". Notes and Records of the Royal Society of London. 54 (1): 115–116. doi:10.1098/rsnr.2000.0101. JSTOR 532063. PMC 1064207.
- ^ Harder, A. (2002). "Chemotherapeutic approaches to schistosomes: Current knowledge and outlook". Parasitology Research. 88 (5): 395–7. doi:10.1007/s00436-001-0588-x. PMID 12049454. S2CID 28243137.
- ^ Kassirsky, I. A.; Plotnikov, N. N. (1 August 2003). Diseases of Warm Lands: A Clinical Manual. The Minerva Group. pp. 262–265. ISBN 978-1-4102-0789-0.
- ^ Control of the leishmaniases: report of a meeting of the WHO Expert Committee on the Control of Leishmaniases, Geneva, 22-26 March 2010. World Health Organization. 2010. p. 1–2, 55, 67–68. ISBN 978-92-4-120949-6.
- ^ McCallum, R. I. (1999). Antimony in medical history: an account of the medical uses of antimony and its compounds since early times to the present. Pentland Press. ISBN 978-1-85821-642-3.
- ^ National Research Council (1970). Trends in usage of antimony: report. National Academies. p. 50.
- ^ Stellman, Jeanne Mager (1998). Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations. International Labour Organization. p. 109. ISBN 978-92-2-109816-4.
- ^ Jang, H & Kim, S. (2000). "The effects of antimony trisulfide (Sb2S3) and zirconium silicate (ZrSiO4) in the automotive brake friction material on friction". Journal of Wear. 239 (2): 229. doi:10.1016/s0043-1648(00)00314-8.
- ^ Randich, Erik; Duerfeldt, Wayne; McLendon, Wade; Tobin, William (2002). "A metallurgical review of the interpretation of bullet lead compositional analysis". Forensic Science International. 127 (3): 174–91. doi:10.1016/S0379-0738(02)00118-4. PMID 12175947. S2CID 22272775.
- ^ Lalovic, M.; Werle, H. (1970). "The energy distribution of antimonyberyllium photoneutrons". Journal of Nuclear Energy. 24 (3): 123. Bibcode:1970JNuE...24..123L. doi:10.1016/0022-3107(70)90058-4.
- ^ Ahmed, Syed Naeem (2007). Physics and engineering of radiation detection. Academic Press. p. 51. Bibcode:2007perd.book.....A. ISBN 978-0-12-045581-2.
- ^ Schmitt, H (1960). "Determination of the energy of antimony-beryllium photoneutrons". Nuclear Physics. 20: 220. Bibcode:1960NucPh..20..220S. doi:10.1016/0029-5582(60)90171-1.
- ^ Rabbeinu Hananel (1995). "Rabbeinu Hananel's Commentary on Tractate Shabbat". In Metzger, David (ed.). Perushe Rabenu Ḥananʼel Bar Ḥushiʼel la-Talmud (in العبرية). Jerusalem: Mekhon 'Lev Sameaḥ'. p. 215 (Shabbat 109a). OCLC 319767989.
- ^ "Sunan an-Nasa'i 5113 – The Book of Adornment – كتاب الزينة من السنن – Sunnah.com – Sayings and Teachings of Prophet Muhammad (صلى الله عليه و سلم)". sunnah.com. Retrieved 2021-02-18.
- ^ Foster, S.; Maher, W.; Krikowa, F.; Telford, K.; Ellwood, M. (2005). "Observations on the measurement of total antimony and antimony species in algae, plant and animal tissues". Journal of Environmental Monitoring. 7 (12): 1214–1219. doi:10.1039/b509202g. PMID 16307074.
- ^ Gebel, T (1997). "Arsenic and antimony: Comparative approach on mechanistic toxicology". Chemico-Biological Interactions. 107 (3): 131–44. Bibcode:1997CBI...107..131G. doi:10.1016/S0009-2797(97)00087-2. PMID 9448748.
- ^ McCallum, RI (1977). "President's address. Observations upon antimony". Proceedings of the Royal Society of Medicine. 70 (11): 756–63. doi:10.1177/003591577707001103. PMC 1543508. PMID 341167.
- ^ Sundar, S.; Chakravarty, J. (2010). "Antimony Toxicity". International Journal of Environmental Research and Public Health. 7 (12): 4267–4277. doi:10.3390/ijerph7124267. PMC 3037053. PMID 21318007.
- ^ Antimony MSDS[dead link]. Baker
- ^ Westerhoff, P; Prapaipong, P; Shock, E; Hillaireau, A (2008). "Antimony leaching from polyethylene terephthalate (PET) plastic used for bottled drinking water". Water Research. 42 (3): 551–6. Bibcode:2008WatRe..42..551W. doi:10.1016/j.watres.2007.07.048. PMID 17707454.
- ^ أ ب Shotyk, W.; Krachler, M.; Chen, B. (2006). "Contamination of Canadian and European bottled waters with antimony from PET containers". Journal of Environmental Monitoring. 8 (2): 288–92. doi:10.1039/b517844b. PMID 16470261. S2CID 9416637.
- ^ Hansen, Claus; Tsirigotaki, Alexandra; Bak, Søren Alex; Pergantis, Spiros A.; Stürup, Stefan; Gammelgaard, Bente; Hansen, Helle Rüsz (2010). "Elevated antimony concentrations in commercial juices". Journal of Environmental Monitoring. 12 (4): 822–4. doi:10.1039/b926551a. PMID 20383361.
- ^ أ ب Guidelines for Drinking-water Quality (PDF) (4th ed.). World Health Organization. 2011. p. 314. ISBN 978-92-4-154815-1. Archived (PDF) from the original on 2022-10-09.
- ^ Wakayama, Hiroshi (2003) "Revision of Drinking Water Standards in Japan", Ministry of Health, Labor and Welfare (Japan); Table 2, p. 84
- ^ Screening assessment antimony-containing substances. Health Canada. July 2020. ISBN 978-0-660-32826-3
- ^ NIOSH Pocket Guide to Chemical Hazards 0036
- ^ أ ب ت "Toxicological Profile for Antimony and Compounds" (PDF). U.S. Department of Health and Human Services. Archived (PDF) from the original on 2022-10-09. Retrieved 19 May 2022.
- ^ "Antimony poisoning". Encyclopedia Britannica.
- ^ Sundar, S; Chakravarty, J (2010). "Antimony Toxicity". International Journal of Environmental Research and Public Health. 7 (12): 4267–4277. doi:10.3390/ijerph7124267. PMC 3037053. PMID 21318007.
- ^ Davis, E.; Bakulski, K. M.; Goodrich, J. M. (2020). "Low levels of salivary metals, oral microbiome composition and dental decay". Scientific Reports. 10 (1): 14640. Bibcode:2020NatSR..1014640D. doi:10.1038/s41598-020-71495-9. PMC 7474081. PMID 32887894.
المراجع
- Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
- Wiberg, Egon; Wiberg, Nils & Holleman, Arnold Frederick (2001). Inorganic chemistry. Academic Press. ISBN 978-0-12-352651-9.
وصلات خارجية
- Public Health Statement for Antimony
- International Antimony Association vzw (i2a)
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Antimony
- Antimony at The Periodic Table of Videos (University of Nottingham)
- CDC – NIOSH Pocket Guide to Chemical Hazards – Antimony
- Antimony Mineral data and specimen images
- CS1 الألمانية-language sources (de)
- CS1 العبرية-language sources (he)
- Articles with dead external links from March 2013
- Short description is different from Wikidata
- Pages using infobox element with unknown parameters
- Articles containing لاتينية-language text
- Pages using Lang-xx templates
- Articles with hatnote templates targeting a nonexistent page
- أنتيمون
- عناصر كيميائية
- أشباه فلزات
- مجموعة النيتروجين
- معادن عناصر طبيعية
- مواد نووية
- مجموعات النتروجين
- معادن ثلاثية الأضلع
- معادن في الزمرة الفراغية 166
- مواد تتمدد عند تجمدها
- Chemical elements with rhombohedral structure