تفاعلات أكسدة-اختزال

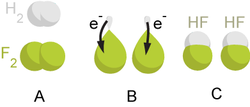
تفاعلات أكسدة-اختزال أو أكسدة-إرجاع هي جميع التفاعلات الكيميائية التي يحدث فيها تغير في عدد أكسدة ذرات المواد المتفاعلة بسبب انتقال الإلكترونات فيما بينها.
يمكن أن تكون عملية الأكسدة-الاختزال عملية بسيطة مثل أكسدة الكربون ليعطي ثنائي أكسيد الكربون، أو إرجاع الكربون بالهيدروجين ليعطي الميثان، كما يمكن أن تكون عملية معقدة مثل أكسدة السكر في جسم الإنسان حيث تتضمن سلسلة معقدة من الانتقالات الإلكترونية.

. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
عوامل الأكسدة والاختزال
- الأكسدة هي عملية فقدان للإلكترونات من قبل الذرات أو الجزيئات أو الأيونات .
- الاختزال هي عملية ربح للإلكترونات من قبل الذرات أو الجزيئات او الأيونات .
وبتعريف أدق يمكن وصف عملية الأكسدة بالنسبة لعنصر ما (أو لجزيء يحوي عنصر تجري عليه هذه العملية) بأنها زيادة في عدد أكسدة هذا العنصر، في حين أن الاختزال (أو الإرجاع) هو النقصان في عدد الأكسدة.
أمثلة
وكمثال على هذه التفاعلات، التفاعل بين الحديد و كبريتات النحاس:
حيث ان التفاعل الأيوني هو:
حيث أن الحديد يتأكسد (عدد أكسدة الحديد ازداد من 0 إلى +2) :
والنحاس يختزل (عدد أكسدة النحاس تناقص من +2 إلى 0) :
تفاعلات الأكسدة-الاختزال في الصناعة
العملية الرئيسية في اختزال الخام لانتاج المعادن مشروحة في مقال صهر.
وتستخدم الأكسدة على نطاق واسع من الصناعات مثل انتاج المنظفات والأمونيا المؤكسدة لانتاج حمض النيتريك، الذي يستعمل في معظم الأسمدة.
تفاعلات الأكسدة-الاختزال هي أساس الخلايا الكهروكيميائية.
انتاج الأقراص المضغوطة يعتمد على تفاعل الأكسدة-الاختزال، الذي يطلي القرص بطبقة رقيقة من رقاقة معدنية.
تفاعلات الأكسدة-الاختزال في علم الأحياء

|

|
أسفل: حمض الديهيدروأسكوربيك (الصيغة المأكسدة من ڤيتامين ج)
يتضمن العديد من العمليات الحيوية الهامة تفاعلات أكسدة-اختزال.
التنفس الخلوي، على سبيل المثال، هو أكسدة الگلوكوز (C6H12O6) إلى CO2 واختزال الأكسجين إلى ماء. المعادلة الملخصة لتنفس الخلية هي:
- C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
- وتعتمد عملية تنفس الخلية بشدة أيضاً على اختزال NAD+ إلى NADH والتفاعل العكسي (أكسدة NADH إلى NAD+). وما التمثيل الضوئي في الأساس إلا عكس تفاعل الأكسدة-اختزال في تنفس الخلية:
- 6 CO2 + 6 H2O + light energy → C6H12O6 + 6 O2
Mnemonics
The key terms involved in redox can be confusing.[1][2] For example, a reagent that is oxidized loses electrons; however, that reagent is referred to as the reducing agent. Likewise, a reagent that is reduced gains electrons and is referred to as the oxidizing agent.[3] These mnemonics are commonly used by students to help memorise the terminology:[4]
- "OIL RIG" — oxidation is loss of electrons, reduction is gain of electrons[1][2][3][4]
- "LEO the lion says GER [grr]" — loss of electrons is oxidation, gain of electrons is reduction[1][2][3][4]
- "LEORA says GEROA" — the loss of electrons is called oxidation (reducing agent); the gain of electrons is called reduction (oxidizing agent).[3]
- "RED CAT" and "AN OX", or "AnOx RedCat" ("an ox-red cat") — reduction occurs at the cathode and the anode is for oxidation
- "RED CAT gains what AN OX loses" – reduction at the cathode gains (electrons) what anode oxidation loses (electrons)
- "PANIC" – Positive Anode and Negative is Cathode. This applies to electrolytic cells which release stored electricity, and can be recharged with electricity. PANIC does not apply to cells that can be recharged with redox materials. These galvanic or voltaic cells, such as fuel cells, produce electricity from internal redox reactions. Here, the positive electrode is the cathode and the negative is the anode.
انظر أيضاً
- اختزال عضوي Organic reduction
- هدرجة
- عملية بسمر
- Bioremediation
- دورة كلڤين
- دورة حمض الستريك
- خلية كهروكيميائية Electrochemical cell
- كيمياء كهربائية
- Electrolysis
- Electron equivalent
- Electron transport chain
- Electrosynthesis
- خلية جلفانية
- Membrane potential
- Microbial fuel cell
- Murburn concept
- Nucleophilic abstraction
- Organic redox reaction
- Oxidative addition and reductive elimination
- Oxidative phosphorylation
- عامل اختزال Reducing agent
- Thermic reaction
- أكسدة جزئية
- Pro-oxidant
- Redox gradient
- Redox potential
- Redox therapy
- Reducing agent
- Reducing atmosphere
- Reduction potential
- Thermic reaction
- Transmetalation
- Sulfur cycle
المصادر
- ^ أ ب ت Robertson, William (2010). More Chemistry Basics. National Science Teachers Association. p. 82. ISBN 978-1-936137-74-9.
- ^ أ ب ت Phillips, John; Strozak, Victor; Wistrom, Cheryl (2000). Chemistry: Concepts and Applications. Glencoe McGraw-Hill. p. 558. ISBN 978-0-02-828210-7.
- ^ أ ب ت ث Rodgers, Glen (2012). Descriptive Inorganic, Coordination, and Solid-State Chemistry. Brooks/Cole, Cengage Learning. p. 330. ISBN 978-0-8400-6846-0.
- ^ أ ب ت Zumdahl, Steven; Zumdahl, Susan (2009). Chemistry. Houghton Mifflin. p. 160. ISBN 978-0-547-05405-6.
- Schüring, J., Schulz, H. D., Fischer, W. R., Böttcher, J., Duijnisveld, W. H. (editors)(1999). Redox: Fundamentals, Processes and Applications, Springer-Verlag, Heidelberg, 246 pp., ISBN 978-3-540-66528-1 (pdf 3,6 MB)
وصلات خارجية