صوديوم
 | |||||||||||||||
| الصوديوم | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| المظهر | أبيض فضي لامع | ||||||||||||||
| الوزن الذري العياري Ar°(Na) | |||||||||||||||
| الصوديوم في الجدول الدوري | |||||||||||||||
| |||||||||||||||
| الرقم الذري (Z) | 11 | ||||||||||||||
| المجموعة | 1 | ||||||||||||||
| الدورة | period 3 | ||||||||||||||
| المستوى الفرعي | s-block | ||||||||||||||
| التوزيع الإلكتروني | [Ne] 3s1 | ||||||||||||||
| الإلكترونات بالغلاف | 2, 8, 1 | ||||||||||||||
| الخصائص الطبيعية | |||||||||||||||
| الطور at د.ح.ض.ق | صلب | ||||||||||||||
| نقطة الانصهار | 370.944 K (97.794 °س، 208.029 °F) | ||||||||||||||
| نقطة الغليان | 1156.090 K (882.940 °س، 1621.292 °ف) | ||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 0.968 ج/سم³ | ||||||||||||||
| حين يكون سائلاً (عند ن.إ.) | 0.927 ج/سم³ | ||||||||||||||
| النقطة الحرجة | 2573 K, 35 MPa (extrapolated) | ||||||||||||||
| حرارة الانصهار | 2.60 kJ/mol | ||||||||||||||
| حرارة التبخر | 97.42 kJ/mol | ||||||||||||||
| السعة الحرارية المولية | 28.230 J/(mol·K) | ||||||||||||||
ضغط البخار
| |||||||||||||||
| الخصائص الذرية | |||||||||||||||
| حالات الأكسدة | +1, −1 | ||||||||||||||
| الكهرسلبية | مقياس پاولنگ: 0.93 | ||||||||||||||
| طاقات التأين |
| ||||||||||||||
| نصف القطر الذري | empirical: 186 pm | ||||||||||||||
| نصف قطر التكافؤ | 166±9 pm | ||||||||||||||
| نصف قطر ڤان در ڤالز | 227 pm | ||||||||||||||
| خصائص أخرى | |||||||||||||||
| البنية البلورية | مكعب مركزي | ||||||||||||||
| سرعة الصوت قضيب رفيع | 3200 م/ث (عند 20 °س) | ||||||||||||||
| قضيب رفيع | 142 W/(m·K) | ||||||||||||||
| التمدد الحراري | 71 µm/(m⋅K) (عند 25 °س) | ||||||||||||||
| المقاومة الكهربائية | 47.7 nΩ⋅m (at 20 °C) | ||||||||||||||
| الترتيب المغناطيسي | مغناطيسي مساير[1] | ||||||||||||||
| معامل يونگ | 10 GPa | ||||||||||||||
| معامل القص | 3.3 GPa | ||||||||||||||
| معاير الحجم | 6.3 GPa | ||||||||||||||
| صلادة موز | 0.5 | ||||||||||||||
| صلادة برينل | 0.69 MPa | ||||||||||||||
| رقم كاس | 7440-23-5 | ||||||||||||||
| التاريخ | |||||||||||||||
| الاكتشاف وأول عزل | همفري ديڤي (1807) | ||||||||||||||
| الرمز | "Na": from New Latin natrium, coined from German Natron, 'natron' | ||||||||||||||
| نظائر الالصوديوم | |||||||||||||||
| قالب:جدول نظائر الصوديوم غير موجود | |||||||||||||||
الصوديوم Sodium /ˈsoʊdiəm/[4] هو عنصر كيميائي في الجدول الدوري، له الرمز Na باللاتينية (Natrium) وله العدد الذري 11. الصوديوم لين، شمعيّ لامع ونشط كيميائياً، ينتمي للعناصر الفلزية القلوية ويحترق بلهب أصفر. يتفاعل في الهواء وشديد التفاعل مع الماء، مما يجعله يحفظ في الزيوت أو مشتقات النفط.
الخصائص
الفيزيائية
الكيميائية

مثل غيره من الفلزات القلوية (عناصر الزمرة الأولى 1A)، الصوديوم لين، خفيف، لونه أبيض مائل إلى الفضي اذا قطع حديثاً، وهو نشط كيميائياً ولا يوجد في الطبيعة بشكل حر لفعاليته العالية. الصوديوم يطفو في الماء أي كثافته أقل من كثافة الماء، كما يفكك جزيئات الماء محررا غاز الهيدرجين وأيونات الأكسجين. وإذا تم طحنه ليصبح مسحوقا ناعما، فإنه يشتعل بشكل تلقائي في الماء. وعادة ما يحفظ فلز الصوديوم في النفط الأبيض (الكيروسين) لكونه يشتعل عند تعرضه للهواء بدرجات حرارة دون 388 كلڤن.
النظائر
هناك ثلاثة عشر نظيرا للصوديوم تم اكتشافها. والنظير المستقر الوحيد هو Na-23. الصوديوم له نظيران مشعان ناتجان عن الأشعة الكونية هما (Na-22، بعمر نصف = 2.605 سنة; Na-24، بنصف عمر ≈ 15 ساعة).
التواجد
الصوديوم متوافر نسبياً في النجوم، وطيفه الضوئي من بين الأبرز في أطياف ضوء النجوم. يشكل الصوديوم حوالي 2.6% من كتلة القشرة الأرضية مما يجعله في المرتبة الرابعة بين الفلزات القلوية من حيث الوفرة. يتم إنتاجه اليوم بشكل تجاري عن طريق التحليل الكهربائي لمصهور لكلوريد الصوديوم الجاف تماما (ملح الطعام). هذه الطريقة هي الأقل تكلفة مقارنة مع الطريقة القديمة القائمة على تحليل الكهربائي لهيدوركسيد الصوديوم. الصوديوم بشكله المعدني يكلف ما بين 30 إلى 45 سنتا أمريكيا للكيلوجرام عام 1997. وهو الأرخص بين الفلزات حسب الحجم.
المركبات
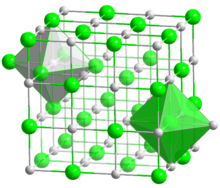
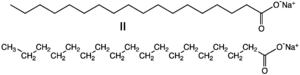
كلوريد الصوديوم، المعروف بملح الطعام أو ملح المائدة، هو أكثر مركبات الصوديوم شيوعا، ولكن الصوديوم موجود في معادن أخرى كثيرة، مثل أمفيبول، الكريوتيل، الهاليت (ملح صخري)، الزيوليت وغيرها. والصوديوم عنصر مهم في الصناعة ،مثل صناعة الزجاج، التعدين، الورق، الصابون، والاقمشة. والصابون بشكل عام عبارة عن ملح الصوديوم متحداً مع أحماض دهنية معينة.
مركبات الصوديوم الأكثر أهمية هي كربونات الصوديوم (رماد الصودا) (Na2CO3)، بيكربونات الصوديوم (صودا الخبيز) (NaHCO3)، الصودا الكاوية (NaOH)، نترات الصوديوم (ملح بارود شيلي) (NaNO3) ،ثنائي وثلاثي فوسفات الصوديوم، ثيوكبريتات الصوديوم (نظريا، Na2S2O3.5H2O) والبورق (Na2B4O7 · 10H2O).
المحاليل المائية
Electrides and sodides
مركبات الصوديوم العضوية
التاريخ
إن الصوديوم معروف منذ زمن كجزء من مركبات كيميائية، ولكن لم يتم الحصول عليه بشكل منفصل حتى عام 1807 على يد السير همفري ديفي عن طريق التحليل الكهربائي لمصهور كلوريد الصوديوم في وجود بعض المواد الصهارة (تخفض من درجة انصهار الملح). وفي العصور الوسطى في أوروبا كان استخدام مركب للصودا بالاسم اللاتيني sodanum شائعا لعلاج الصداع. والرمز Na يأتي من اللاتينية الجديدة لمركب شائع للصوديوم هو الناتريوم natrium، والمشتق من اللفظة اليونانية nítron وهو نوع من الملح الطبيعي.
الانتاج التجاري
التطبيقات
الصوديوم بشكله الفلزي جزء ضروري في صناعة ملح الإستر وتصنيع المركبات العضوية. كما أن هذا الفلز القلوي هو جزء من كلوريد الصوديوم النقي الذي لا يتميء في الجو NaCl (ملح الطعام) الضروري للحياة، كما أن له استخدامات أخرى لعلنا اوجزناها و تشمل:
- يستخدم في (عملية التعدين) و تعتبر طريقة ملائمة لإستخلاص الأكسجين المتحد مع الفلزات او الذائب في منصهراتها
- استخدامه الضروري في عملية انتاج سيانيد الصودويم الذي ينقي الذهب (Hg)
- استخدامه في بعض السبائك لتحسين بنيانها.
- في الصابون (سوية مع الأحماض الدهنية).
- لجعل سطوح المعادن ملساء.
- لتنقية المعادن المصهورة.
- في مصابيح بخار الصوديوم، لإنتاج إضاءه كهربائية بفاعلية عالية جدا.
- يضاف الصوديوم (أو رابع إيثيل الرصاص) إلى الوقود لمنع الفرقعة أثناء الاحتراق في محركات السيارات [5]
- استخلاص التيتانيوم من خاماته
- يستخدم الصوديوم السائل في تبريد المفاعلات النووية لقدرته العالية على نقل الحرارة
- استخدامه كعامل مختزل قوي في بعض التفاعلات العضوية لشدة و سرعة تأكسده
العنصر الحر
ناقل الحرارة
الاستخدامات الغذائية
إن الحاجة اليومية للصوديوم في الغذاء هي حوالي 1.54 غ يومياً [7] وهي أقل بعشر مرات من الكمية الموجودة في المأكولات "المنكّهة بحسب الذوق". إن معظم الأشخاص يتناولون كميات أكبر بكثير من كمية الصوديوم التي يحتاجون إليها. تناول كميات من الصوديوم أقل من الكميات الموصى بها يؤدي إلى النقص الصوديوم في الدم.
الدور الحيوي
تلعب أيونات الصوديوم أدوار متنوعة في العديد من العمليات الفسيولوجية في الجسم الحي. الخلايا الإستثارية، على سبيل المثال، تعمتد على إدخال أيونات الصوديوم الموجبة Na+ لإزالة الإستقطاب. إنتقال الإشارات العصبية في الجهاز العصبي المركزي للبشر مثال على ذلك.
احتيطات الأمان
مسحوق الصوديوم يشكل مادة شديدة الإنفجار في الماء ويكون ساماً دون إتحاده مع مواد اخرى أو بإتحاده مع العديد من المواد. يجب التعامل مع هذا الفلز بشكل حذر دوما. يجب حفظ الصوديوم إما في جو لا يتفاعل معه، أو في مشتقات النفط.
انظر أيضاً
المصادر
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights
- ^ Endt, P. M. (1990). "Energy levels of A = 21–44 nuclei (VII)". Nuclear Physics A. 521: 1–400. Bibcode:1990NuPhA.521....1E. doi:10.1016/0375-9474(90)90598-G.
- ^ Wells, John C. (2008), Longman Pronunciation Dictionary (3rd ed.), Longman, p. 755, ISBN 9781405881180.
- ^
{{cite web}}: Empty citation (help) - ^ van Rossen, G. L. C. M.; van Bleiswijk, H. (1912). "Über das Zustandsdiagramm der Kalium-Natriumlegierungen". Zeitschrift für anorganische Chemie. 74: 152–156. doi:10.1002/zaac.19120740115.
- ^ http://maakom.com/site/article/5433
وصلات خارجية
- Sodium at The Periodic Table of Videos (University of Nottingham)
- Etymology of "natrium" – source of symbol Na
- The Wooden Periodic Table Table's Entry on Sodium
- Sodium isotopes data from The Berkeley Laboratory Isotopes Project's
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
- CS1 errors: empty citation
- Short description is different from Wikidata
- Pages using infobox element with unknown parameters
- Articles with hatnote templates targeting a nonexistent page
- معادن الصوديوم
- صوديوم
- مجففات
- معادن غذائية
- عوامل مختزلة
- فلزات قلوية
- أحياء وصيدلة العناصر الكيميائية
- مبردات المفاعلات النووي
- عناصر كيميائية