التهاب الغدة الدرقية لهاشيموتو
| التهاب الغدة الدرقية لهاشيموتو Hashimoto's thyroiditis | |
|---|---|
| الأسماء الأخرى | Chronic lymphocytic thyroiditis, autoimmune thyroiditis, struma lymphomatosa, Hashimoto's disease |
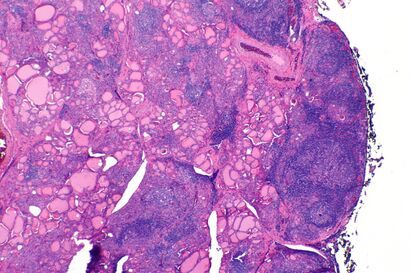 | |
| The thyroid of someone with Hashimoto's thyroiditis as seen with a microscope at low magnification | |
| التخصص | Endocrinology |
| الأعراض | Painless goiter, weight gain, feeling tired, constipation, depression, dry skin, hair loss[1] |
| المضاعفات | Thyroid lymphoma.[2] |
| البداية المعتادة | 30–50 years old[1][3] |
| المسببات | Genetic and environmental factors.[4] |
| عوامل الخطر | Family history, another autoimmune disease[1] |
| الطريقة التشخيصية | TSH, T4, anti-thyroid autoantibodies[1] |
| التشخيص المفاضل | Graves’ disease, nontoxic nodular goiter[5] |
| العلاج | Levothyroxine, surgery[1][5] |
| التردد | 5% at some point[4] |
التهاب الغدة الدرقية لهاشيموتو (إنگليزية: Hashimoto's thyroiditis، يُعرف أيضاً باسم التهاب الغدة الدرقية اللمفاوي المزمن (إنگليزية: chronic lymphocytic thyroiditis)، و مرض هاشيموتو (إنگليزية: Hashimoto's disease)، هو مرض مناعة ذاتية التي تتلف فيها الغدة الدرقية تدريجيًا..[1][6] في وقت مبكر ، قد لا يتم ملاحظة الأعراض.[1] بمرور الوقت ، قد تتضخم الغدة الدرقية وتشكل تضخمًا غير مؤلم.[1] يصاب بعض الأشخاص في نهاية المطاف بقصور الغدة الدرقية مصحوبًا بزيادة الوزن ، والتعب ، والإمساك ، والاكتئاب ، وتساقط الشعر ، والآلام العامة..[1] بعد سنوات عديدة ، يتقلص حجم الغدة الدرقية عادة.[1] تشمل المضاعفات المحتملة سرطان الغدد الليمفاوية الدرقي.[2]
يُعتقد أن التهاب الغدة الدرقية لهاشيموتو ناتج عن مجموعة من العوامل الوراثية والبيئية.[4] تشمل عوامل الخطر وجود تاريخ عائلي للحالة والإصابة بمرض مناعي ذاتي آخر.[1] يتم تأكيد التشخيص من خلال اختبارات الدم لهرمون المحفز للدرقية و الثيروكسين والأجسام المضادة للغدة الدرقية.[1] تشمل الحالات الأخرى التي يمكن أن تسبب أعراضًا مماثلة مرض جريفز وتضخم الغدة الدرقية العقدي الغير سام.[5]
عادة ما يتم علاج التهاب الغدة الدرقية في هاشيموتو باستخدام ليفوثيروكسين.[1][7] إذا لم يكن قصور الغدة الدرقية موجودًا ، فقد يوصي البعض بعدم العلاج ، بينما قد يعالج البعض الآخر لمحاولة تقليل حجم تضخم الغدة الدرقية.[1][8] يجب على المصابين تجنب تناول كميات كبيرة من اليود ؛ ومع ذلك ، هناك حاجة إلى كمية كافية من اليود خاصة أثناء الحمل.[1] نادرًا ما تكون الجراحة مطلوبة لعلاج تضخم الغدة الدرقية.[5]
يصيب التهاب الغدة الدرقية لهاشيموتو حوالي 5٪ من القوقازيين في مرحلة ما من حياتهم..[4] يبدأ عادةً بين سن 30 و 50 وهو أكثر شيوعًا عند النساء منه عند الرجال.[1][3] يبدو أن معدلات المرض آخذة في الازدياد.[5] تم وصفه لأول مرة من قبل الطبيب الياباني هاكارو هاشيموتو في عام 1912.[9] في عام 1957 تم الاعتراف به على أنه اضطراب في المناعة الذاتية..[10]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الأعراض والعلامات
تُعزى العديد من الأعراض إلى تطور التهاب الغدة الدرقية لهاشيموتو. وتشمل معظم الأعراض الشائعة: التعب، وزيادة الوزن، وجه شاحب أو منتفخ، الشعور بالبرد، و آلام في العضلات و المفاصل ، والإمساك وجفاف ورقة الشعر، غزارة الطمث أو عدم انتظام الدورة الشهرية ، والاكتئاب ، اضطرابات الهلع ، و تباطؤ معدل ضربات القلب ، و مشاكل الحمل والاستمرار في الحمل.[11]
مرض هاشيموتو أكثر شيوعًا بين النساء سبع مرات منه لدى الرجال. يمكن أن تحدث عند المراهقين والشابات ، ولكنها تظهر بشكل أكثر شيوعًا في منتصف العمر ، خاصة للرجال. غالبًا ما يكون لدى الأشخاص الذين يصابون بمرض هاشيموتو أفراد من عائلاتهم يعانون من أمراض الغدة الدرقية أو أمراض المناعة الذاتية الأخرى ، وفي بعض الأحيان يعانون من أمراض المناعة الذاتية الأخرى.[12]
قد تصبح الغدة الدرقية صلبة وكبيرة ومفصصة في التهاب الغدة الدرقية لهاشيموتو ، ولكن التغيرات في الغدة الدرقية قد تكون أيضًا غير محسوسة.[13] يرجع تضخم الغدة الدرقية إلى تسلل الخلايا الليمفاوية والتليف ، وليس تضخم الأنسجة. في حين أن دورها في التدمير الأولي للبصيلات غير واضح ، فإن الأجسام المضادة ضد بيروكسيداز الغدة الدرقية أو ثيروجلوبولين مرتبطة ، لأنها تعمل كعلامات للكشف عن المرض وشدته.[14] يُعتقد أنها المنتجات الثانوية لتدمير الغدة بواسطة الخلايا التائية.[15]
يتميز أيضًا بغزو أنسجة الغدة الدرقية بواسطة كريات الدم البيضاء ، وخاصة الخلايا اللمفاوية التائية . المضاعفات النادرة والخطيرة هي سرطان الغدد الليمفاوية الدرقي ، وعادة ما تكون من نوع الخلايا البائية ، لمفوما اللاهودجكينية.[16]
عوامل الخطر
تم إثبات المكون الجيني القوي في الدراسات التي أجريت على التوائم أحادية الزيجوت ، مع توافق بنسبة 38-55 ٪ ، مع توافق أعلى من الأجسام المضادة للغدة الدرقية المنتشرة ليس فيما يتعلق بالظهور السريري (تصل إلى 80 ٪ في التوائم أحادية الزيجوت). لم تُشاهد أي من النتيجتين بدرجة مماثلة في التوائم ثنائية الزيجوت ، مما يوفر تفضيلًا قويًا للمسببات الجينية العالية.[17]
الأدوية التي تؤثر على وظيفة الغدة الدرقية
ارتبطت بعض الأدوية أو العقاقير بتعديل وظيفة الغدة الدرقية والتدخل فيها. من بين هذه الأدوية ، هناك آليتان رئيسيتان للتدخل يمكن أن يكون لديهم.
إحدى آليات التداخل هي عندما يغير الدواء بروتينات نقل مصل هرمون الغدة الدرقية..[18] يزيد كل من الإستروجين ، والتاموكسيفين ، والهيروين ، والميثادون ، والكلوفيبرات ، و 5-فلورويوراسيل ، والميتوتان ، والبيرفينازين من تركيز الجلوبيولين المرتبط بالغدة الدرقية (TBG)[18] الأندروجينات ، الستيرويدات الابتنائية مثل دانازول ، الجلوكوكورتيكويد ، وحمض النيكوتينيك بطيء الإطلاق ، كلها تقلل من تركيزات الجلوبيولين المرتبط بالغدة الدرقية. فوروسيميد ، فينوفليناك ، حمض الميفاناميك ، الساليسيلات ، الفينيتوين ، الديازيبام ، السلفونيل يوريا ، الأحماض الدهنية الحرة ، والهيبارين كلها تتداخل مع هرمون الغدة الدرقية المرتبط بالجلوبيولين المرتبط بالغدة الدرقية و / أو ترانستريتين
.
الآلية الأخرى التي يمكن أن تستخدمها الأدوية للتدخل في وظيفة الغدة الدرقية هي تغيير الاستقلاب الإضافي لهرمون الغدة الدرقية. بروبيل ثيوراسيل ، جلوكوكورتيكويد ، بروبانولول ، عوامل تباين مؤينة ، أميودارون ، وكلوميبرامين كلها تمنع تحويل T4 و T3..[18] الفينوباربيتال والريفامبين والفينيتوين وكاربامازيبين كلها تزيد من الاستقلاب للكبد.[18] أخيرًا ، الكوليستريامين ، كوليستيبول ، هيدروكسيد الألومنيوم ، كبريتات الحديدوز ، والسوكرالفات كلها أدوية تقلل من امتصاص T4(الثيروكسين 4) أو تعزز الإخراج.[18]
جينات HLA
كان موضع الجين الأول المرتبط بمرض الغدة الدرقية المناعي الذاتي هو منطقة معقد التوافق النسيجي الرئيسي (MHC) على الكروموسوم 6p21. يقوم بترميز HLAs. أليلات HLA المحددة لها انجذاب أكبر للببتيدات الدرقية الذاتية المنشأ ويمكن أن تساهم في تطور أمراض الغدة الدرقية المناعية الذاتية. على وجه التحديد ، في مرض هاشيموتو ، تم إثبات التعبير الشاذ عن HLA II على الخلايا الدرقية. يمكنهم تقديم المستضدات الذاتية للغدة الدرقية وبدء مرض الغدة الدرقية المناعي الذاتي.[19] أليلات الاستعداد (الحساسية ) ليست متسقة في مرض هاشيموتو. في القوقازيين ، تم الإبلاغ عن العديد من الأليلات المرتبطة بالمرض ، بما في ذلك DR3 و DR5 و DQ7..[20][21]
جينات CTLA-4
هذا الجين هو ثاني أكبر جين منظم للمناعة مرتبط بمرض الغدة الدرقية المناعي الذاتي. قد يساهم تعدد الأشكال الجيني ل CTLA-4 في تقليل تثبيط تكاثر الخلايا التائية وزيادة القابلية للاستجابة للمناعة الذاتية.[22] CTLA-4 هو جين استعدادي رئيسي للإصابة بالأجسام المضادة للغدة الدرقية. تم إثبات ارتباط منطقة CTLA-4 بوجود الأجسام المضادة للغدة الدرقية من خلال تحليل ارتباط الجينوم الكامل.[23] تم تأكيد CTLA-4 باعتباره الموقع الرئيسي للأجسام المضادة للغدة الدرقية.[24]
جين البروتين التيروزين الفوسفاتيز غير المستقبلي من النوع 22
PTPN22 هو أحدث جين منظم للمناعة مرتبط بمرض الغدة الدرقية المناعي الذاتي. يقع على الكروموسوم 1p13 ويتم التعبير عنه في الخلايا الليمفاوية. يعمل كمنظم سلبي لتنشيط الخلايا التائية. الطفرة في هذا الجين هي عامل خطر للعديد من أمراض المناعة الذاتية. قد يؤدي ضعف إشارات الخلايا التائية إلى ضعف حذف الغدة الصعترية للخلايا التائية النشطة ، وقد تؤدي زيادة وظيفة PTPN22 إلى تثبيط الخلايا التائية التنظيمية ، التي تحمي من المناعة الذاتية..[25]
الجينات المرتبطة بالمناعة
إنترفيرون-جاما يعزز السمية الخلوية بوساطة الخلايا ضد الغدة الدرقية. ارتبطت الطفرات التي تسبب زيادة إنتاج إنترفيورن- جاما مع شدة قصور الغدة الدرقية.[26] يرتبط قصور الغدة الدرقية الشديد بالطفرات التي تؤدي إلى انخفاض إنتاج إنترلوكين-4 (Th2 سيتوكين الذي يثبط المناعة الذاتية الخلوية)),[27] انخفاض إفراز عامل النمو والتحويل-بيتا (مثبط إنتاج السيتوكين)),[28] , وطفرات في FoxP3 ، وهي عنصر أساسي العامل التنظيمي لتطوير الخلايا التائية التنظيمية..[29] ارتبط تطور مرض هاشيموتو بطفرة في جين عامل نخر الورم-ألفا (محفز لإنتاج إنترفيرون-جاما) ، مما تسبب في زيادة تركيزه.[30]
العوامل البيئية التي يمكن الوقاية منها ، بما في ذلك تناول كميات كبيرة من اليود ، ونقص السيلينيوم ، والأمراض المعدية وبعض الأدوية ، قد تورطت في تطور مرض الغدة الدرقية المناعي الذاتي لدى الأفراد المهيئين وراثياً.[31]
اليود
الإفراط في تناول اليود هو عامل بيئي راسخ لتحفيز المناعة الذاتية للغدة الدرقية. يوجد انتشار أعلى للأجسام المضادة للغدة الدرقية في المناطق التي ترتفع فيها إمداد اليود. تم اقتراح العديد من الآليات التي قد يعزز اليود من خلالها المناعة الذاتية للغدة الدرقية. يؤدي التعرض لليود إلى زيادة نسبة اليود في ثيروجلوبولين ، مما يزيد من قدرتها المناعية عن طريق إنشاء حواتم جديدة تحتوي على اليود أو تعريض الحواتم المشفرة. قد يسهل العرض التقديمي بواسطة الخلية المقدمة للمستضد ، ويعزز ألفة الربط لمستقبل الخلايا التائية ، وينشط الخلايا التائية المحددة.[32]
تبين أن التعرض لليود يزيد من مستوى أنواع الأكسجين التفاعلي. أنها تعزز التعبير عن جزيء الالتصاق داخل الخلايا -1 على الخلايا الحويصلية للغدة الدرقية ، والتي يمكن أن تجذب الخلايا ذات الكفاءة المناعية إلى الغدة الدرقية.[33]
يعتبر اليود سامًا للخلايا الدرقية لأن أنواع الأكسجين عالية التفاعل قد ترتبط بدهون الغشاء والبروتينات. يسبب تلف الغدة الدرقية وإفراز المستضدات الذاتية. يعزز اليود أيضًا موت الخلايا المبرمج للخلايا الجريبية وله تأثير على الخلايا المناعية (زيادة نضوج الخلايا التغصنية ، وزيادة عدد الخلايا التائية ، وتحفيز إنتاج الغلوبولين المناعي للخلايا البائية)).[34][35]
تُظهر البيانات المستمدة من التقصي الدنماركي حول تناول اليود وأمراض الغدة الدرقية أنه في مجموعتين (ذكور وإناث) يعانون من نقص اليود المعتدل والخفيف ، تكون مستويات كل من بيروكسيداز الغدة الدرقية والأجسام المضادة للثيروجلوبولين أعلى في الإناث ، وتزداد معدلات انتشار كل من الأجسام المضادة مع السن.[36]
النوع
قدرت دراسة التوائم الدنماركية الصحية المقسمة إلى ثلاث مجموعات (أحادي الزيجوت وثنائي الزيجوت من نفس الجنس ، وأزواج مزدوجة من الجنس الآخر) أن المساهمة الجينية في حساسية الأجسام المضادة لبيروكسيداز الغدة الدرقية كانت 61٪ عند الذكور و 72٪ في الإناث ، وكانت المساهمة في حساسية الأجسام المضادة للثيروجلوبولين 39 ٪ عند الذكور و 75٪ عند الإناث.[37]
قد تكون الغلبة الأنثوية العالية في المناعة الذاتية للغدة الدرقية مرتبطة بالكروموسوم X. يحتوي على الجينات المرتبطة بالجنس والمناعة المسؤولة عن التحمل المناعي.[38] تم الإبلاغ عن ارتفاع معدل الإصابة بالمناعة الذاتية للغدة الدرقية في المرضى الذين لديهم معدل أعلى من كروموسوم X أحادي في خلايا الدم البيضاء المحيطية..[39]
قد تكون هناك آلية محتملة أخرى تتمثل في تعطيل نشاط كروموسوم X ، مما يؤدي إلى هروب المستضدات الذاتية المرتبطة بـ X من الظهور في الغدة الصعترية وفقدان تحمل الخلايا التائية.[بحاجة لمصدر]
تُعد الإصابة بأمراض المناعة الذاتية الأخرى عامل خطر للإصابة بالتهاب الغدة الدرقية لدى هاشيموتو ، والعكس صحيح أيضًا.[1] تشمل أمراض المناعة الذاتية الأكثر شيوعًا المرتبطة بالتهاب الغدة الدرقية لهاشيموتو الداء البطني وداء السكري من النوع الأول والبهاق والثعلبة.[40]
تختلف الجينات المتورطة في المجموعات العرقية المختلفة ويزداد معدل الإصابة لدى الأشخاص الذين يعانون من اضطرابات الكروموسومات ، بما في ذلك متلازمات تيرنر وداون وكلينفلتر المرتبطة عادةً بالأجسام المضادة الذاتية ضد ثيروجلوبولين وثيرروبيروكسيداز. يؤدي الاستنفاد التدريجي لهذه الخلايا مثل الاستجابة المناعية السامة للخلايا إلى درجات أعلى من قصور الغدة الدرقية الأولي ، مع انخفاض مستويات T3 / T4 ، والارتفاعات التعويضية للهرمون المنبة للدرقية.[بحاجة لمصدر]
الفسيولوجيا المرضية
تم اقتراح آليات متعددة تتطور من خلالها أمراض التهاب الغدة الدرقية لهاشيموتو.
قد توجد العديد من الأجسام المضادة الذاتية ضد مستقبلات بيروكسيداز الغدة الدرقية ، وثيروجلوبولين ، ومستقبلات الهرمون المنبه للدرقية ، على الرغم من أن نسبة صغيرة من الأشخاص قد لا يوجد عندهم أي من هذه الأجسام المضادة. كما هو مبين في دراسات التوائم المختلفة ، قد يكون لدى نسبة مئوية من السكان أيضًا هذه الأجسام المضادة دون الإصابة بالتهاب الغدة الدرقية هاشيموتو. ومع ذلك ، فإن السمية الخلوية المعتمدة على الأجسام المضادة والتي تتوسطها الخلايا هي عامل أساسي وراء السقوط المعتمد علي الموت المبرمج للخلايا لالتهاب الغدة الدرقية لهاشيموتو. يعد تنشيط الخلايا الليمفاوية التائية السامة للخلايا ( CD8 + -الخلايا التائية) استجابةً للاستجابة المناعية بوساطة الخلايا المتأثرة بالخلايا اللمفاوية التائية المساعدة ( CD4 + T-cells) أمرًا أساسيًا لتدمير الخلايا الدرقية. كما هو الحال مع فرط الحساسية من النوع الرابع ، فإن استدعاء الخلايا البلعمية الكبيرة هو تأثير آخر لتنشيط الخلايا اللمفاوية التائية المساعدة ، مع الخلايا الليمفاوية المحور Th1 التي تنتج السيتوكينات الالتهابية داخل أنسجة الغدة الدرقية لزيادة تنشيط البلاعم والهجرة إلى الغدة الدرقية للحصول على تأثير مباشر.[بحاجة لمصدر]
تظهر التغيرات المورفولوجية الإجمالية داخل الغدة الدرقية في التضخم العام ، والذي يكون عقديًا محليًا وغير منتظم بدرجة أكبر بكثير من الأنماط الأكثر انتشارًا (مثل فرط نشاط الغدة الدرقية ). في حين أن الكبسولة سليمة والغدة نفسها لا تزال متميزة عن الأنسجة المحيطة ، يمكن أن يوفر الفحص المجهري مؤشرًا أكثر كشفًا عن مستوى الضرر..[41]
من الناحية النسيجية ، يُنظر إلى فرط الحساسية على أنه تسلل نسيجي منتشر بواسطة الخلايا الليمفاوية ، وخاصة الخلايا البائية البلازمية ، والتي يمكن غالبًا اعتبارها بصيلات ليمفاوية ثانوية (مراكز إنتاشية ، لا ينبغي الخلط بينها وبين البصيلات المملوءة بالغروية الموجودة عادة والتي تشكل الغدة الدرقية). تصطف ضمور الأجسام الغروانية بواسطة خلايا Hürthle ، وهي خلايا تحتوي على السيتوبلازم الحبيبي الحمضي بشكل مكثف ، وهو حؤول من الخلايا المكعبة الطبيعية التي تشكل بطانة جريبات الغدة الدرقية. غالبًا ما يظهر ضمور الغدة الدرقية الشديد مع عصابات ليفية من الكولاجين تظل داخل حدود كبسولة الغدة الدرقية.[41]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التشخيص
يتم التشخيص عادةً عن طريق الكشف عن المستويات المرتفعة من الأجسام المضادة لبيروكسيداز الغدة الدرقية في المصل ، ولكن من الممكن أيضًا الإصابة بالتهاب الغدة الدرقية سلبي المصل (بدون الأجسام المضادة المنتشرة).[42]
نظرًا للأعراض غير المحددة نسبيًا لقصور الغدة الدرقية الأولي ، غالبًا ما يتم تشخيص التهاب الغدة الدرقية لهاشيموتو بشكل خاطئ على أنه اكتئاب ، واضطراب المزاج الدوري ، ومتلازمة ما قبل الحيض ، ومتلازمة التعب المزمن ، والألم العضلي الليفي ، وفي كثير من الأحيان ، مثل ضعف الانتصاب أو اضطراب القلق . في الفحص الإجمالي ، غالبًا ما يظهر تضخم الغدة الدرقية غير المؤلم للمس;[41] الأعراض الأخرى التي تظهر مع قصور الغدة الدرقية ، مثل الوذمة المخاطية امام الظنبوب ، تعتمد على الحالة الحالية لتطور الاستجابة ، خاصة بالنظر إلى التطور التدريجي عادةً لقصور الغدة الدرقية ذي الصلة سريريًا. يمكن أن يساعد اختبار الهرمون المنبه للغدة الدرقية (TSH) ، و T3 الحر ، و T4 الحر ، والأجسام المضادة لـ ثيروغلوبيولين ، والأجسام المضادة لبيروكسيداز الغدة الدرقية (anti-TPO ، أو TPOAb) والأجسام المضادة المضادة للفيروسات في الحصول على تشخيص دقيق.[43] قد يظهر التقييم المبكر للشخص بمستويات مرتفعة من ثيروجلوبولين بسبب التسمم الدرقي العابر ، لأن الالتهاب داخل الغدة الدرقية يسبب ضررًا لسلامة تخزين جريب الغدة الدرقية للثيروجلوبولين ؛ يزداد إفراز الهرمون المنبة للدرقية من الغدة النخامية الأمامية استجابةً لانخفاض تثبيط ردود الفعل السلبية الثانوية لانخفاض هرمونات الغدة الدرقية في الدم. عادة ، T4 هو اختبار هرمون الغدة الدرقية المفضل لقصور الغدة الدرقية..[44] يُعتقد أن تعرض الجسم لكميات كبيرة من إنزيمات الغدة الدرقية المعزولة سابقًا يساهم في تفاقم انهيار التحمل ، مما يؤدي إلى ظهور أعراض أكثر وضوحًا تظهر لاحقًا في المرض. غالبًا ما يؤدي التسلل الليمفاوي للأنسجة المرتبطة بالخلايا الدرقية إلى اكتشاف مهم من الناحية النسيجية لتطور المركز المنتش داخل الغدة الدرقية..[بحاجة لمصدر]
يُعرف هاشيموتو عند تقديمه على أنه هوس بمتلازمة براساد بعد أشوك براساد ، الطبيب النفسي الذي وصفها لأول مرة.[45]
العلاج
معالجة مستويات الهرمون
يُعالج قصور الغدة الدرقية الناجم عن التهاب الغدة الدرقية في هاشيموتو بعوامل بديلة لهرمون الغدة الدرقية مثل ليفوثيروكسين أو ثلاثي يودوثيرونين أو مستخلص الغدة الدرقية المجفف . بشكل عام ، يحافظ شريط الدواء الذي يتم تناوله مرة واحدة يوميًا على مستويات هرمون الغدة الدرقية طبيعية. في معظم الحالات ، يجب أن يؤخذ العلاج لبقية حياة الشخص. إذا كان قصور الغدة الدرقية ناتجًا عن التهاب الغدة الدرقية لهاشيموتو ، فقد يوصى بإبقاء مستويات هرمون المنبه للغدة الدرقية أقل من 3.0 م وحدة دولية / لتر..[46]
مآل المرض
يعتبر ضعف الغدة الدرقية الصريح المصحوب بأعراض أكثر المضاعفات شيوعًا ، حيث يتطور حوالي 5 ٪ من الأشخاص المصابين بقصور الغدة الدرقية تحت السريري والتهاب الغدة الدرقية المناعي الذاتي المزمن إلى فشل الغدة الدرقية كل عام. فترات عابرة من التسمم الدرقي (الإفراط في نشاط الغدة الدرقية) تحدث في بعض الأحيان، ونادرا ما يكون المرض قد يتطور إلى زيادة نشاط الغدة كاملة داء جريفز مع اعتلال الحجاج النشط (انتفاخ، التهاب العيون). تظهر حالات نادرة من التهاب الغدة الدرقية المناعي الليفي مع ضيق شديد في التنفس وصعوبة في البلع ، تشبه أورام الغدة الدرقية العدوانية ، ولكن هذه الأعراض تتحسن دائمًا بالجراحة أو العلاج بالكورتيكوستيرويد. يصيب سرطان الغدد الليمفاوية الأولية من الخلايا البائية أقل من شخص واحد من كل 1000 شخص ، ومن المرجح أن يصيب أولئك الذين يعانون من التهاب الغدة الدرقية المناعي الذاتي لفترة طويلة..[47]
علم الأوبئة
يُعتقد أن هذا الاضطراب هو السبب الأكثر شيوعًا لقصور الغدة الدرقية الأولي في أمريكا الشمالية. كسبب لتضخم الغدة الدرقية غير المتوطن ، فهو من بين أكثر الأسباب شيوعًا.[41]يصيب التهاب الغدة الدرقية لهاشيموتو حوالي 5٪ من القوقازيين في مرحلة ما من حياتهم..[4] في الولايات المتحدة ، يؤثر على عدد أقل من الأمريكيين من أصل أفريقي ، ولكنه مرتبط بزيادة معدل الوفيات بين السكان الأمريكيين من أصل أفريقي.[48] كما أنه أقل شيوعًا في السكان الآسيويين.[49] حوالي 1.0 إلى 1.5 من كل 1000 شخص يعانون من هذا المرض في أي وقت.[41] يحدث ما بين ثمانية إلى 15 مرة في كثير من الأحيان عند النساء أكثر من الرجال. على الرغم من أنه قد يحدث في أي عمر ، بما في ذلك الأطفال ، إلا أنه غالبًا ما يُلاحظ عند النساء بين 30 و 60 عامًا.[47] تشير بعض الأبحاث إلى وجود صلة بدور المشيمة كتفسير للاختلاف بين الجنسين..[50]
وهو أكثر شيوعًا في المناطق التي ترتفع فيها نسبة تناول اليود في النظام الغذائي ، وبين الأشخاص المعرضين وراثيًا للإصابة به.[47]
التاريخ
يُعرف التهاب الغدة الدرقية لهاشيموتو ، المعروف أيضًا باسم مرض هاشيموتو ، على اسم الطبيب الياباني هاكارو هاشيموتو (1881-1934) من كلية الطب بجامعة كيوشو,[51] الذي وصف لأول مرة أعراض الأشخاص المصابين بالسلعة الليمفاوية ، وهو تسلل شديد للخلايا الليمفاوية داخل الغدة الدرقية ، في عام 1912 في الجريدة الألمانية المسماة Archiv für Klinische Chirurgie.[52][53] تتكون هذه الورقة من 30 صفحة و 5 رسوم توضيحية تصف جميعها التغيرات النسيجية في أنسجة الغدة الدرقية. علاوة على ذلك ، تم جمع جميع النتائج في دراسته الأولى من أربع نساء. وقد أوضحت هذه النتائج الخصائص المرضية التي لوحظت لدى هؤلاء النساء خاصة تسلل الخلايا اللمفاوية والبلازما وكذلك تكوين الحويصلات اللمفاوية مع المراكز الإنتاشية والتليف وخلايا الغدة الدرقية الظهارية المتدهورة والكريات البيض في التجويف.[52] ووصف هذه السمات بأنها مشابهة من الناحية النسيجية لتلك الخاصة بمرض ميكوليتش. كما هو مذكور أعلاه ، بمجرد اكتشاف هذه السمات في هذا المرض الجديد ، قام بتسمية مرض السلعة الليمفاوية. أكد هذا المرض على تسلل الخلايا اللمفاوية وتشكيل الجريبات اللمفاوية مع مراكز إنتاشية ، ولم يتم الإبلاغ عن أي منهما من قبل[52]
على الرغم من اكتشاف الدكتور هاشيموتو ونشره ، إلا أنه للأسف لم يتم التعرف على المرض على أنه مختلف عن التهاب الغدة الدرقية المنسوب لراديل الذي كان مرضًا شائعًا في ذلك الوقت في أوروبا. على الرغم من الإبلاغ عن العديد من المقالات الأخرى ونشرها من قبل باحثين آخرين ، إلا أن السلعة الليمفاوية لهاشيموتو لم يتم التعرف عليه إلا كمرحلة مبكرة من التهاب الغدة الدرقية في راديل في أوائل القرن العشرين. لم يتم التعرف على المرض حتى عام 1931 كمرض في حد ذاته عندما أبلغ الباحثون ألين جراهام وآخرون من كليفلاند عن أعراضه وعرضه بنفس الطريقة التفصيلية مثل هاكورو.[52]
في عام 1956 ، تمكنت الدكتورة روز وويتبسكي من إثبات كيف أن تحصين بعض القوارض بمستخلصات من الغدة الدرقية للقوارض الأخرى يشبه المرض الذي كان يحاول هاكورو وباحثون آخرون وصفه.[52] تمكن هؤلاء الأطباء أيضًا من وصف الأجسام المضادة للثيروغلوبولين في عينات مصل الدم من نفس هذه الحيوانات.
في وقت لاحق من نفس العام ، تمكن باحثون من مستشفى ميدلسكس في لندن من إجراء تجارب بشرية على المرضى الذين ظهرت عليهم أعراض مماثلة. قاموا بتنقية الأجسام المضادة للثيروجلوبولين من مصلهم وتمكنوا من استنتاج أن هؤلاء المرضى لديهم رد فعل مناعي ضد ثيروجلوبولين الإنسان.[3] من هذه البيانات ، تم اقتراح أن سِلْعَة هاشيموتو من الممكن أن تكون أحد أمراض المناعة الذاتية للغدة الدرقية.
في عام 1957 ، تم التعرف عليه على أنه اضطراب في المناعة الذاتية وكان أول اضطراب مناعي ذاتي خاص بأعضاء يتم تحديده..[10]
بعد هذا التعرف ، نشر نفس الباحثين من مستشفى ميدلسكس مقالًا في عام 1962 في لانسيت انتهى به الأمر متضمنا صورة هاكورو هاشيموتو.[52] أصبح المرض أكثر شهرة منذ تلك اللحظة وأصبح مرض هاشيموتو يظهر بشكل متكرر في الكتب المدرسية.
منذ تلك الاكتشافات ، تم اكتشاف عدد من أمراض المناعة الذاتية والعديد منها له علاقة بالأجسام المضادة الخاصة بالغدة الدرقية.
الحمل
قد تعاني النساء الحوامل المصابات بالتهاب الغدة الدرقية لهشيموتو من انخفاض في وظيفة الغدة الدرقية أو قد تفشل الغدة تمامًا..[54] إذا كانت المرأة موجبة للاجسام المضادة لبيروكسيدز الغدة الدرقية TPOAb ، فيمكن للأطباء إخبارها بالمخاطر التي تتعرض لها هي ورضيعها إذا لم يتم علاج المرض. تم الكشف عن "الأجسام المضادة لبيروكسيداز الغدة الدرقية (TPOAb) في 10٪ من النساء الحوامل" ، مما يمثل مخاطر على حالات الحمل تلك.[54] النساء اللواتي يعانين من ضعف وظيفة الغدة الدرقية غير المستقرة معرضات بشكل أكبر لخطر إنجاب طفل يعاني من: انخفاض الوزن عند الولادة ، وضيق التنفس الوليدي ، واستسقاء المخ ، والمبال التحتاني ، والإجهاض ، والولادة المبكرة.[54][55] يتم تحسين معدل زرع الأجنة ونتائج الحمل الناجحة عند علاج هاشيموتو.[55] التوصيات هي علاج النساء الحوامل فقط إذا كن إيجابيات TPOAb طوال فترة الحمل وفحص جميع النساء الحوامل لمستويات الغدة الدرقية.[54] التعاون الوثيق بين أخصائي الغدد الصماء وأخصائي التوليد يفيد المرأة والرضيع .[54][56][57] توصي جمعية الغدد الصماء بإجراء فحص على النساء الحوامل اللاتي يعتبرن معرضات لخطر الإصابة بأمراض المناعة الذاتية للغدة الدرقية.[58]
يوصى باختبار الأجسام المضادة لبيروكسيدات الغدة الدرقية للنساء اللاتي سبق أن حملن بغض النظر عن نتيجة الحمل. ". . . يلعب الحمل السابق دورًا رئيسيًا في تطور قصور الغدة الدرقية المناعي الذاتي لدى النساء في فترة ما قبل انقطاع الطمث ، ويجب أخذ عدد حالات الحمل السابقة في الاعتبار عند تقييم خطر الإصابة بقصور الغدة الدرقية لدى النساء الشابات."[59]
تؤدي التغيرات الهرمونية والتعبير عن الأرومة الغاذية للجزيئات الرئيسية المعدلة للمناعة إلى تثبيط المناعة وتحمل الجنين. اللاعبون الرئيسيون في تنظيم الاستجابة المناعية هم الخلايا التائية التنظيمية . يتم إضعاف كل من الاستجابات المناعية الخلطية والمتواسطة بالخلايا ، مما يؤدي إلى التحمل المناعي وقمع المناعة الذاتية. تم الإبلاغ عن أنه خلال فترة الحمل ، تنخفض مستويات بيروكسيداز الغدة الدرقية والأجسام المضادة للثيروجلوبولين. بعد الولادة ، تنخفض الخلايا التائية المنتظمة بسرعة وتستعيد الاستجابات المناعية. قد يؤدي إلى حدوث مرض الغدة الدرقية المناعي الذاتي أو تفاقمه.[60] في ما يصل إلى 50٪ من الإناث المصابات بأجسام مضادة لبيروكسيداز الغدة الدرقية في بداية الحمل ، تتفاقم المناعة الذاتية للغدة الدرقية في فترة ما بعد الولادة في شكل التهاب الغدة الدرقية بعد الولادة..[61] تم الإبلاغ عن زيادة إفراز إنترفيرون-جاما و إنترلوكين-4 ، وانخفاض تركيز الكورتيزول في البلازما أثناء الحمل في الإناث المصابات بالتهاب الغدة الدرقية بعد الولادة مقارنة بالإناث الأصحاء. يشير إلى أن ضعف كبت المناعة أثناء الحمل يمكن أن يساهم في ضعف الغدة الدرقية بعد الولادة.[62]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الكيمرية الدقيقة الجينية
بعد عدة سنوات من الولادة ، يمكن اكتشاف الخلايا الذكرية الكيميرية في الدم المحيطي للأم أو الغدة الدرقية أو الرئة أو الجلد أو العقد الليمفاوية. قد يتم تنشيط الخلايا المناعية للجنين في الغدة الدرقية للأم وتعمل كمحفز قد يبدأ أو يبالغ في مرض الغدة الدرقية المناعي الذاتي. في مرضى هاشيموتو ، تم اكتشاف خلايا خيمرية دقيقة في الغدة الدرقية بأعداد أعلى بكثير من الإناث الأصحاء..[63]
انظر أيضاً
المصادر
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ "Hashimoto's Disease". NIDDK. May 2014. Archived from the original on 22 August 2016. Retrieved 9 August 2016.
- ^ أ ب Noureldine, SI; Tufano, RP (January 2015). "Association of Hashimoto's thyroiditis and thyroid cancer". Current Opinion in Oncology. 27 (1): 21–5. doi:10.1097/cco.0000000000000150. PMID 25390557. S2CID 32109200.
- ^ أ ب ت Hiromatsu, Yuji; Satoh, Hiroshi; Amino, Nobuyuki (January 2013). "Hashimoto's Thyroiditis: History and Future Outlook". Hormones. 12 (1): 12–18. doi:10.1007/BF03401282. PMID 23624127. S2CID 38996783.
- ^ أ ب ت ث ج Pyzik, A; Grywalska, E; Matyjaszek-Matuszek, B; Roliński, J (2015). "Immune disorders in Hashimoto's thyroiditis: what do we know so far?". Journal of Immunology Research. 2015: 979167. doi:10.1155/2015/979167. PMC 4426893. PMID 26000316.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب ت ث ج Akamizu, T; Amino, N; Feingold, KR; Anawalt, B; Boyce, A; Chrousos, G; de Herder, WW; Dungan, K; Grossman, A; Hershman, JM; Hofland, J; Kaltsas, G; Koch, C; Kopp, P; Korbonits, M; McLachlan, R; Morley, JE; New, M; Purnell, J; Singer, F; Stratakis, CA; Trence, DL; Wilson, DP (2000). "Hashimoto's Thyroiditis". In Akamizu, Takashi; Amino, Nobuyuki (eds.). Endotext. MDText. PMID 25905412.
- ^ "Hashimoto's disease". Office on Women’s Health, U.S. Department of Health and Human Services. 12 June 2017. Archived from the original on 28 July 2017. Retrieved 17 July 2017.
 هذا المقال يضم نصاً من هذا المصدر، الذي هو مشاع.
هذا المقال يضم نصاً من هذا المصدر، الذي هو مشاع.
- ^ "Hashimoto Thyroiditis – Endocrine and Metabolic Disorders". Merck Manuals Professional Edition (in الإنجليزية الكندية). July 2016. Retrieved 30 December 2017.
- ^ "Hashimoto Thyroiditis – Hormonal and Metabolic Disorders". Merck Manuals Consumer Version (in الإنجليزية الكندية). Retrieved 30 December 2017.
- ^ Shoenfeld, Yehuda; Cervera, Ricard; Gershwin, M. Eric (2010). Diagnostic Criteria in Autoimmune Diseases. Springer Science & Business Media. p. 216. ISBN 978-1-60327-285-8.
- ^ أ ب Moore, Elaine A.; Wilkinson, Samantha (2009). The Promise of Low Dose Naltrexone Therapy: Potential Benefits in Cancer, Autoimmune, Neurological and Infectious Disorders. McFarland. p. 30. ISBN 978-0-7864-5258-3.
- ^ "Hashimoto's disease – Symptoms and causes". Mayo Clinic (in الإنجليزية). Retrieved 2018-10-05.
- ^ "Hashimoto's disease fact sheet". Office on Women's Health, U.S. Department of Health and Human Services, womenshealth.gov (or girlshealth.gov). 16 July 2012. Archived from the original on 2 December 2014. Retrieved 23 November 2014.
- ^ Page 56 in: Staecker, Hinrich; Thomas R. Van De Water; Van de Water, Thomas R. (2006). Otolaryngology: basic science and clinical review. Stuttgart: Thieme. ISBN 978-0-86577-901-3.
- ^ "Pathogenesis of Hashimoto's thyroiditis (chronic autoimmune thyroiditis)". UpToDate.
- ^ "Hashimoto Thyroiditis". NCBI StatPearls. 2019.
- ^ Dayan, Colin M.; Daniels, Gilbert H. (11 July 1996). "Chronic Autoimmune Thyroiditis". New England Journal of Medicine. 335 (2): 99–107. doi:10.1056/NEJM199607113350206. PMID 8649497.
- ^ Chistiakov, Dimitry A (2005). "Immunogenetics of Hashimoto's thyroiditis". Journal of Autoimmune Diseases. 2 (1): 1. doi:10.1186/1740-2557-2-1. PMC 555850. PMID 15762980.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب ت ث ج Surks, Martin I.; Sievert, Rubens (1995-12-21). Wood, Alastair J.J. (ed.). "Drugs and Thyroid Function". New England Journal of Medicine (in الإنجليزية). 333 (25): 1688–1694. doi:10.1056/NEJM199512213332507. ISSN 0028-4793.
- ^ Jacobson, Eric M.; Huber, Amanda; Tomer, Yaron (2008). "The HLA gene complex in thyroid autoimmunity: From epidemiology to etiology". Journal of Autoimmunity. 30 (1–2): 58–62. doi:10.1016/j.jaut.2007.11.010. PMC 2244911. PMID 18178059.
- ^ Tendon, N.; Zhang, L.; Weetman, A. P. (May 1991). "HLA Associations with Hashimoto's thyroiditis". Clinical Endocrinology. 34 (5): 383–386. doi:10.1111/j.1365-2265.1991.tb00309.x. PMID 1676351. S2CID 28987581.
- ^ Bogner, U.; Badenhoop, K.; Peters, H.; Schmieg, D.; Mayr, W. R.; Usadel, K. H.; Schleusener, H. (January 1992). "Hla-Dr/Dq Gene Variation in Nongoitrous Autoimmune Thyroiditis at the Serological and Molecular Level". Autoimmunity. 14 (2): 155–158. doi:10.3109/08916939209083135. PMID 1363895.
- ^ Zaletel, Katja; Gaberšček, Simona (December 2011). "Hashimoto's Thyroiditis: From Genes to the Disease". Current Genomics. 12 (8): 576–588. doi:10.2174/138920211798120763. PMC 3271310. PMID 22654557.
- ^ Tomer, Yaron; Greenberg, David A.; Barbesino, Giuseppe; Concepcion, Erlinda; Davies, Terry F. (March 2001). "CTLA-4 and Not CD28 Is a Susceptibility Gene for Thyroid Autoantibody Production 1". The Journal of Clinical Endocrinology & Metabolism. 86 (4): 1687–1693. doi:10.1210/jcem.86.4.7372. PMID 11297604.
- ^ Ban, Y; Davies, T F; Greenberg, D A; Kissin, A; Marder, B; Murphy, B; Concepcion, E S; Villanueva, R B; Barbesino, G; Ling, V; Tomer, Y (December 2003). "Analysis of the CTLA-4, CD28, and inducible costimulator (ICOS) genes in autoimmune thyroid disease". Genes & Immunity. 4 (8): 586–593. doi:10.1038/sj.gene.6364018. PMID 14647199. S2CID 6920190.
- ^ Burn, Garth L.; Svensson, Lena; Sanchez-Blanco, Cristina; Saini, Manoj; Cope, Andrew P. (1 December 2011). "Why is PTPN22 a good candidate susceptibility gene for autoimmune disease?". FEBS Letters. 585 (23): 3689–3698. doi:10.1016/j.febslet.2011.04.032. PMID 21515266. S2CID 21572847.
- ^ Ito, Chisato; Watanabe, Mikio; Okuda, Noriko; Watanabe, Chikami; Iwatani, Yoshinori (2006). "Association between the Severity of Hashimoto's Disease and the Functional +874A/T Polymorphism in the Interferon-.GAMMA. Gene". Endocrine Journal. 53 (4): 473–478. doi:10.1507/endocrj.k06-015. PMID 16820703.
- ^ Nanba, Takashi; Watanabe, Mikio; Akamizu, Takashi; Iwatani, Yoshinori (1 March 2008). "The −590CC Genotype in the IL4 Gene as a Strong Predictive Factor for the Development of Hypothyroidism in Hashimoto Disease". Clinical Chemistry. 54 (3): 621–623. doi:10.1373/clinchem.2007.099739. PMID 18310157.
- ^ Yamada, H.; Watanabe, M.; Nanba, T.; Akamizu, T.; Iwatani, Y. (March 2008). "The +869T/C polymorphism in the transforming growth factor-β1 gene is associated with the severity and intractability of autoimmune thyroid disease: TGF-β1 SNP and autoimmune thyroid disease". Clinical & Experimental Immunology. 151 (3): 379–382. doi:10.1111/j.1365-2249.2007.03575.x. PMC 2276968. PMID 18190611.
- ^ Inoue, N.; Watanabe, M.; Morita, M.; Tomizawa, R.; Akamizu, T.; Tatsumi, K.; Hidaka, Y.; Iwatani, Y. (December 2010). "Association of functional polymorphisms related to the transcriptional level of FOXP3 with prognosis of autoimmune thyroid diseases: FoxP3 SNP and autoimmune thyroid disease". Clinical & Experimental Immunology. 162 (3): 402–406. doi:10.1111/j.1365-2249.2010.04229.x. PMC 3026543. PMID 20942809.
- ^ Inoue, N.; Watanabe, M.; Nanba, T.; Wada, M.; Akamizu, T.; Iwatani, Y. (May 2009). "Involvement of functional polymorphisms in the TNFA gene in the pathogenesis of autoimmune thyroid diseases and production of anti-thyrotropin receptor antibody". Clinical & Experimental Immunology. 156 (2): 199–204. doi:10.1111/j.1365-2249.2009.03884.x. PMC 2759465. PMID 19250279.
- ^ Saranac, L.; Zivanovic, S.; Bjelakovic, B.; Stamenkovic, H.; Novak, M.; Kamenov, B. (2011). "Why Is the Thyroid So Prone to Autoimmune Disease". Hormone Research in Paediatrics. 75 (3): 157–165. doi:10.1159/000324442. PMID 21346360.
- ^ Rose, Noel R.; Bonita, Raphael; Burek, C.Lynne (February 2002). "Iodine: an environmental trigger of thyroiditis". Autoimmunity Reviews. 1 (1–2): 97–103. CiteSeerX 10.1.1.326.5700. doi:10.1016/s1568-9972(01)00016-7. PMID 12849065.
- ^ Burek, C. Lynne; Talor, Monica V. (November 2009). "Environmental triggers of autoimmune thyroiditis". Journal of Autoimmunity. 33 (3–4): 183–189. doi:10.1016/j.jaut.2009.09.001. PMC 2790188. PMID 19818584.
- ^ Fountoulakis, S; Philippou, G; Tsatsoulis, A (January 2007). "The role of iodine in the evolution of thyroid disease in Greece: from endemic goiter to thyroid autoimmunity". Hormones. 6 (1): 25–35. PMID 17324915.
- ^ Yu, Xiujie; Li, Lanying; Li, Qingxin; Zang, Xiaoyi; Liu, Zebing (November 2011). "TRAIL and DR5 Promote Thyroid Follicular Cell Apoptosis in Iodine Excess-Induced Experimental Autoimmune Thyroiditis in NOD Mice". Biological Trace Element Research. 143 (2): 1064–1076. doi:10.1007/s12011-010-8941-5. PMID 21225479. S2CID 10926594.
- ^ Pedersen, Inge Bülow; Knudsen, Nils; Jørgensen, Torben; Perrild, Hans; Ovesen, Lars; Laurberg, Peter (January 2003). "Thyroid peroxidase and thyroglobulin autoantibodies in a large survey of populations with mild and moderate iodine deficiency: Thyroid autoantibodies and iodine deficiency". Clinical Endocrinology. 58 (1): 36–42. doi:10.1046/j.1365-2265.2003.01633.x. PMID 12519410. S2CID 23758580.
- ^ Hansen, Pia S; Brix, Thomas H; Iachine, Ivan; Kyvik, Kirsten O; Hegedüs, Laszlo (January 2006). "The relative importance of genetic and environmental effects for the early stages of thyroid autoimmunity: a study of healthy Danish twins". European Journal of Endocrinology. 154 (1): 29–38. doi:10.1530/eje.1.02060. PMID 16381988.
- ^ McCombe, P. A.; Mackay, J. M. Greer and I. R.; Mackay, IR (30 November 2009). "Sexual Dimorphism in Autoimmune Disease". Current Molecular Medicine. 9 (9): 1058–1079. doi:10.2174/156652409789839116. PMID 19747114.
- ^ Invernizzi, Pietro; Miozzo, Monica; Selmi, Carlo; Persani, Luca; Battezzati, Pier Maria; Zuin, Massimo; Lucchi, Simona; Meroni, Pier Luigi; Marasini, Bianca; Zeni, Silvana; Watnik, Mitchell; Grati, Francesca R.; Simoni, Giuseppe; Gershwin, M. Eric; Podda, Mauro (1 July 2005). "X Chromosome Monosomy: A Common Mechanism for Autoimmune Diseases". The Journal of Immunology. 175 (1): 575–578. doi:10.4049/jimmunol.175.1.575. PMID 15972694. S2CID 40557667.
- ^ Radetti, Giorgio (2014). "Clinical Aspects of Hashimoto's Thyroiditis". Paediatric Thyroidology. Endocrine Development. Vol. 26. pp. 158–170. doi:10.1159/000363162. ISBN 978-3-318-02720-4. PMID 25231451.
- ^ أ ب ت ث ج Maitra, Anirban (2014). "The Endocrine System". In Kumar, Vinay; Abbas, Abul K.; Aster, Jon C. (eds.). Robbins and Cotran Pathologic Basis of Disease. Elsevier Health Sciences. pp. 1073–1140. ISBN 978-0-323-29635-9.
- ^ Grani, Giorgio; Carbotta, Giovanni; Nesca, Angela; D’Alessandri, Mimma; Vitale, Martina; Del Sordo, Marianna; Fumarola, Angela (June 2015). "A comprehensive score to diagnose Hashimoto's thyroiditis: a proposal". Endocrine. 49 (2): 361–365. doi:10.1007/s12020-014-0441-5. PMID 25280964. S2CID 23026213.
- ^ Giannini, AJ (1986). The Biological Foundations of Clinical Psychiatry. New Hyde Park, NY: Medical Examination Publishing Company. pp. 193–198. ISBN 978-0-87488-449-4.
- ^ Hashimoto Thyroiditis at eMedicine
- ^ Weiner, M. J.; Kennedy, C. (March 1988). "Prasad's Syndrome". British Journal of Psychiatry. 152 (3): 438–439. doi:10.1192/bjp.152.3.438b. PMID 3167392.
- ^ "Does Your Doctor Know About the New TSH Lab Standards?". Archived from the original on 4 December 2010.
- ^ أ ب ت Fabrizio Monaco (2012). Thyroid Diseases. Taylor and Francis. p. 78. ISBN 978-1-4398-6839-3.
- ^ Boyles, Salynn (23 May 2013). "Hypothyroidism Hikes Death Risk in Blacks". MedPage Today.
- ^ McLeod, Donald S. A.; Caturegli, Patrizio; Cooper, David S.; Matos, Peter G.; Hutfless, Susan (16 April 2014). "Variation in Rates of Autoimmune Thyroid Disease by Race/Ethnicity in US Military Personnel". JAMA. 311 (15): 1563–1565. doi:10.1001/jama.2013.285606. PMID 24737370.
{{cite journal}}: Unknown parameter|lay-url=ignored (help) - ^ Natri, Heini; Garcia, Angela R.; Buetow, Kenneth H.; Trumble, Benjamin C.; Wilson, Melissa A. (July 2019). "The Pregnancy Pickle: Evolved Immune Compensation Due to Pregnancy Underlies Sex Differences in Human Diseases". Trends in Genetics. 35 (7): 478–488. doi:10.1016/j.tig.2019.04.008. PMC 6611699. PMID 31200807.
- ^ Hakaru Hashimoto at Who Named It?
- ^ أ ب ت ث ج ح Hiromatsu, Yuji; Satoh, Hiroshi; Amino, Nobuyuki (January 2013). "Hashimoto's Thyroiditis: History and Future Outlook". Hormones (in الإنجليزية). 12 (1): 12–18. doi:10.1007/BF03401282. ISSN 1109-3099.
- ^ Hashimoto, Hakaru (1912). "Zur Kenntnis der lymphomatösen Veränderung der Schilddrüse (Struma lymphomatosa)" [Knowledge of lymphomatous changes in the thyroid gland (goiter lymphomatosa)]. Archiv für Klinische Chirurgie (in الألمانية). 97: 219–248. قالب:NAID.
- ^ أ ب ت ث ج Lepoutre, Thibault; Debiève, Frederic; Gruson, Damien; Daumerie, Chantal (2012-01-01). "Reduction of Miscarriages through Universal Screening and Treatment of Thyroid Autoimmune Diseases". Gynecologic and Obstetric Investigation. 74 (4): 265–273. doi:10.1159/000343759. PMID 23147711.
- ^ أ ب Gaberšček, Simona; Zaletel, Katja (September 2011). "Thyroid physiology and autoimmunity in pregnancy and after delivery". Expert Review of Clinical Immunology. 7 (5): 697–707. doi:10.1586/eci.11.42. PMID 21895480.
- ^ Budenhofer, Brigitte K.; Ditsch, Nina; Jeschke, Udo; Gärtner, Roland; Toth, Bettina (January 2013). "Thyroid (dys-)function in normal and disturbed pregnancy". Archives of Gynecology and Obstetrics. 287 (1): 1–7. doi:10.1007/s00404-012-2592-z. PMID 23104052. S2CID 24969196.
- ^ Balucan, Francis S.; Morshed, Syed A.; Davies, Terry F. (2013). "Thyroid Autoantibodies in Pregnancy: Their Role, Regulation and Clinical Relevance". Journal of Thyroid Research. 2013: 182472. doi:10.1155/2013/182472. PMC 3652173. PMID 23691429.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ "Endocrine Experts Support Screening for Thyroid Dysfunction in Pregnant Women". Endocrine Society. Endocrine Society. 26 March 2015. Archived from the original on 8 October 2015. Retrieved 4 October 2015.
- ^ Carlé, Allan; Pedersen, Inge Bülow; Knudsen, Nils; Perrild, Hans; Ovesen, Lars; Rasmussen, Lone Banke; Laurberg, Peter (1 June 2014). "Development of Autoimmune Overt Hypothyroidism Is Highly Associated With Live Births and Induced Abortions but Only in Premenopausal Women". The Journal of Clinical Endocrinology & Metabolism. 99 (6): 2241–2249. doi:10.1210/jc.2013-4474. PMID 24694338.
- ^ Weetman, Anthony P. (June 2010). "Immunity, thyroid function and pregnancy: molecular mechanisms". Nature Reviews Endocrinology. 6 (6): 311–318. doi:10.1038/nrendo.2010.46. PMID 20421883. S2CID 9900120.
- ^ Lazarus, John H. (1 March 2011). "The Continuing Saga of Postpartum Thyroiditis". The Journal of Clinical Endocrinology & Metabolism. 96 (3): 614–616. doi:10.1210/jc.2011-0091. PMID 21378224.
- ^ Kokandi, A. A.; Parkes, A. B.; Premawardhana, L. D. K. E.; John, R.; Lazarus, J. H. (March 2003). "Association of Postpartum Thyroid Dysfunction with Antepartum Hormonal and Immunological Changes". The Journal of Clinical Endocrinology & Metabolism. 88 (3): 1126–1132. doi:10.1210/jc.2002-021219. PMID 12629095.
- ^ Koopmans, Marije; Kremer Hovinga, Idske C.L.; Baelde, Hans J.; Harvey, Mark S.; de Heer, Emile; Bruijn, Jan A.; Bajema, Ingeborg M. (June 2008). "Chimerism occurs in thyroid, lung, skin and lymph nodes of women with sons". Journal of Reproductive Immunology. 78 (1): 68–75. doi:10.1016/j.jri.2008.01.002. PMID 18329105.
| Classification | |
|---|---|
| External resources |
- CS1 maint: unflagged free DOI
- CS1 الإنجليزية الكندية-language sources (en-ca)
- CS1 errors: unsupported parameter
- CS1 الألمانية-language sources (de)
- الصفحات بخصائص غير محلولة
- Short description is different from Wikidata
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- Articles with unsourced statements from March 2021
- Articles with unsourced statements from February 2017
- Articles with unsourced statements from August 2013
- Articles with unsourced statements from August 2020
- أمراض مرتبطة بالشيخوخة
- أمراض مناعة ذاتية
- أمراض الغدد الصماء
- RTTNEURO
- أمراض الغدة الدرقية
