الگلوبولين المناعي م
| الگلوبين المناعي م Immunoglobulin M | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (pentamer) | |||||||||||||
 | |||||||||||||
| نوع الپروتين | جسم مضاد | ||||||||||||
| |||||||||||||
الگلوبولين المناعي م (اختصاراً IgM) هو واحد من العديد من الانماط الإيسوية للجسم المضاد (المعروف أيضًا باسم الگلوبولين المناعي) التي تنتجها الفقاريات . IgM هو أكبر جسم مضاد ، وهو أول جسم مضاد يظهر في الاستجابة للتعرض الأولي لمستضد .[1][2] في حالة البشر والثدييات الأخرى التي تمت دراستها ، فإن الطحال ، حيث الارومة البلازمية المسؤولة عن إنتاج الأجسام المضادة ، هي الموقع الرئيسي لإنتاج IgM محدد [3][4]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
بدأت دراسة IgM مع التقرير في عام 1937 بأن الخيول التي تم تحصينها بشكل كبير مع المكورات الرئوية عديد السكاريد أنتجت أجسامًا مضادة أكبر بكثير من غاما-الگلوبولين النموذجي للارانب ,[5] بوزن جزيئي قدره 990.000 دالتون .[6] وفقًا لحجمه الكبير ، تمت الإشارة إلى الجسم المضاد الجديد في الأصل باسم غاما-ماكروگلوبولين ، ثم في المصطلحات اللاحقة باسم IgM-M لـ "الماكرو". نطاقات V للگلوبولين المناعي الطبيعي غير متجانسة للغاية ، مما يعكس دورها في الحماية ضد مجموعة كبيرة من الميكروبات المعدية ، وأعاق هذا التغاير التحليل الهيكلي التفصيلي لـ IgM. تم اكتشاف مصدرين من IgM متجانسين في وقت لاحق. أولاً ، تم التعرف على بروتين الوزن الجزيئي المرتفع الذي ينتجه بعض مرضى الورم النقوي المتعدد على أنهغاما-ماكروگلوبولين ينتج من الورم ، ونحن نعلم الآن أنه نظرًا لأن الورم هو استنساخ فإن IgM الذي ينتجه متجانس.[7] في الستينيات ، تم تطوير طرق للحث الأورام المنتجة للگلوبولين المناعي (الأورام البلازمية) في الفئران ، مما يوفر أيضًا مصدرًا للگلوبولين المناعي المتجانس من مختلف الانماط الإيسوية ، بما في ذلك IgM (تمت مراجعته في[8].)في الآونة الأخيرة ، يمكن استخدام التعبير عن جينات الگلوبولين المناعي المهندسة في زراعة الأنسجة لإنتاج IgM مع بدائل محددة وبالتالي تحديد المتطلبات الجزيئية للميزات ذات الأهمية. .
البُنية
ويشمل الگلوبولين المناعي سلاسل خفيفة وسلاسل ثقيلة. السلسلة الخفيفة (λ أو κ) عبارة عن بروتين يحتوي على ~ 220 من الأحماض الأمينية ، ويتكون من نطاق متغير ، VL (جزء من 110 أحماض أمينية تقريبًا) ، ونطاق ثابت ، CL (أيضًا ما يقرب من 110 من الأحماض الأمينية طويلة). سلسلة µ الثقيلة من IgM عبارة عن بروتين يحتوي على 576 من الأحماض الأمينية ، ويتضمن نطاقاً متغيرًا (VH ~ 110 من الأحماض الأمينية) ، وأربعة نطاقات منطقة ثابتة متميزة (Cµ1 ، Cµ2 ، Cµ3 ، Cµ4 ، كل ~ 110 من الأحماض الأمينية) و "ذيل" من 20 أحماض أمينية. تحمل السلسلة µ الثقيلة سكريات قليلة في خمسة مخلفات أسبراجين. تم تمييز جزئيات السكريات القليلة على الفئران و IgM البشري بشكل جزئي من خلال مجموعة متنوعة من التقنيات ، بما في ذلك الرنين المغناطيسي النووي ، وربط الليكتين ، وأنظمة الكروماتوگرافيا المختلفة والحساسية الإنزيمية. (تمت مراجعتها في[9]).يختلف هيكل السكريات قليلة في كل موقع في التفاصيل ، وتختلف السكريات قليلة الغالب - biantennary ، triantennary ،مانوز عالي - بين المواقع .
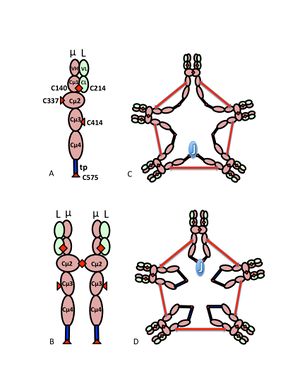
A) النطاقات المغايرة µL ، التي تسمى أحيانًا النصف النصف ، مع نطاقات متغيرة (VH ، VL) ومنطقة ثابتة (Cµ1 ، Cµ2 ، Cµ3 ، Cµ4tp ؛ CL) اللنطاقات. تظهر السيستين الذي يتوسط روابط ثنائي كبريتيد بين السلاسل على شكل رؤوس سهام حمراء ، بحيث تظهر رابطة ثاني كبريتيد السيستين على شكل رأس سهم أحمر مزدوج (الماس الأحمر)).
B) مونومر IgM (µL) 2. يتم تمثيل روابط ثاني كبريتيد بين مجالات Cµ2 برأس سهم مزدوج أحمر.
C, D) نموذجان ل IgM الخماسي يحتوي على سلسلة J التي ظهرت في منشورات مختلفة في أوقات مختلفة. كما في (ب) ، يتم تمثيل روابط ثاني كبريتيد بين مجالات C بينn2 وروابط ثاني كبريتيد بين مجالات Cµ4tp برأس سهم أحمر مزدوج ؛ يتم تمثيل روابط ثاني كبريتيد Cµ3 (للتوضيح) بواسطة سهام طويلة برأسين. يُشار إلى الاتصال ، أي ارتباط ثنائي كبريتيد السلاسل بين سلاسل ، مثل الاتصال الكهربائي. في (C) ، ترتبط روابط ثاني كبريتيد Cµ3 بالسلاسل بالتوازي مع روابط ثاني كبريتيد Cµ4tp ، وتربط روابط ثاني كبريتيد هذه بالسلاسل على التوالي مع روابط ثاني كبريتيد Cµ2. في (D) ترتبط روابط ثنائي كبريتيد Cµ2 و Cµ4tp بسلاسل متوازية وينضم كلا النوعين إلى سلاسل في سلاسل مع روابط ثاني كبريتيد Cµ3. (تم استنساخ الشكل بإذن من الناشر والمؤلفين[10]).
يظهر الشكل متعدد الهيكل IgM بشكل تخطيطي في الشكل. يوضح الشكل 1 أ "المتغاير" المكون من سلسلة خفيفة واحدة ، تدل على L ، وسلسلة ثقيلة واحدة ، تدل على µ. يتم ربط السلاسل الثقيلة والخفيفة معًا بواسطة روابط ثنائي الكبريتيد (يتم تصويرها على شكل مثلثات حمراء) وبالتفاعلات غير التساهمية.
يوضح الشكل 1 ب وحدتين µL مرتبطتين برابطة كبريتيد في نطاقات Cµ2 ؛ غالبًا ما يُشار إلى بنية (µL) (2) هذه باسم "مونومر" IgM ، حيث إنه مماثل في بعض النواحي لبنية الگلوبولين المناعي ج .
على أساس سرعة الترسيب وظهوره في الميكروغراف الإلكتروني ، استنتج أن IgM هو في الغالب "خماسي" ، أي بوليمر يتكون من خمسة "مونومرات" µL) 2] 5]، وقد تم تصويره أصلاً بواسطة النماذج في الأشكال 1C و 1 D ، مع روابط ثنائي كبريتيد بين مجالات Cµ3 وبين قطع الذيل .[11][12] يظهر أيضًا أن IgM الخماسي يحتوي على بروتين ثالث ، سلسلة J. تم اكتشاف سلسلة J) J للانضمام) كمكون مرتبط تساهميًا من البوليمر IgA و IgM .[13][14] Jسلسلة J عبارة عن بروتين حمضي صغير (~ 137 من الأحماض الأمينية). كما هو موضح ، تربط سلسلة J سلسلتين عبر روابط ثنائي كبريتيد تشتمل على السيستين في الذيل .[15]
المتطلبات الجزيئية لتشكيل IgM الپوليميري
كان من المتوقع في البداية أن سلسلة J ستكون مهمة لتشكيل الگلوبولينات المناعية البوليمرية ، بل إن بلمرة IgA تعتمد بشدة (ولكن ليس على الإطلاق) على سلسلة J.[16][17] في المقابل ، يتشكل IgM البوليمري بكفاءة في غياب سلسلة J.[18][19]
الشكل السائد من IgM البشري والفأري هو خماسي. على سبيل المقارنة ، IgM من الضفدع (Xenopus) هو في الغالب سداسي ,[20][21] IgM في الأسماك العظمية هو رباعي في الغالب ، و IgM من الأسماك الغضروفية (سمك القرش) هو في الغالب خماسي.[22][23] على الرغم من هيمنة الخماسي في الفئران وإيجام IgM البشري ، كان من الواضح أن هذه IgM يمكن أن توجد أيضًا كسداسي .[24][25] S أشارت الدراسات اللاحقة باستخدام أنظمة التعبير الحمض النووي المؤشب إلى أن السداسي هو شكل رئيسي من أشكال IgM للفأر ، عندما يتم إنتاج IgM في ظروف يمنع فيها دمج سلسلة J ، إما عن طريق إنتاج IgM في الخلايا التي تفتقر إلى سلسلة J .[26][27] باختصار ، IgM السداسي لا يحتوي أبداً على سلسلة J ؛ يمكن تشكيل IgM الخماسي بحيث يشمل أو لا يشمل سلسلةJ .[28]
فرق مهم بين السلاسل الثقيلة γ و µ هو توافر السيستين لتشكيل روابط ثنائي كبريتيد بين السلاسل الثقيلة. في حالة السلسلة الثقيلة ، تتكون الروابط الداخلية الوحيدة بواسطة السيستين في المفصلة ، وبالتالي ترتبط كل سلسلة بسلسلة أخرى فقط. على النقيض من ذلك ، يشمل كل من نطاقات Cµ2 و Cµ3 والذيل كل من السيستين الذي يشكل رابطة ثنائي كبريتيد مع سلسلة أخرى. تتوسط السيستئين في مجالات Cµ2 في تكوين IgM أحادي Iµ) 2). إن الذيل مع السيستين المتضمن ضروري وكافٍ لتشكيل االگلوبولينات المناعية البوليمرية. أي أن حذف الذيل من السلسلة الثقيلة يمنع تكوين IgM البوليمر .[29] على العكس من ذلك ، فإن الخلايا التي تعبر عن سلسلة ثقيلة تم تعديلها لتشمل الذيل تنتج البوليمر IgG. .[30][31][32]
دور السيستين في مجال Cµ3 أكثر دقة. تمثل الأشكال 1C و 1 D النماذج الممكنة لـ IgM الخماسي. في هذه النماذج ، يُتوخى من كل سلسلة ربط سلسلتين أخريين. ومع ذلك ، لا يمكن لأي نموذج بمفرده أن يراعي تمامًا بنية IgM البوليمرية. على سبيل المثال ، يتنبأ النموذج في الشكل 1 ج بأن رابطة ثاني كبريتيد بين مجالات Cµ2 ضرورية لصنع IgM البوليمري المرتبطة بالكبريتيد. يتنبأ النموذج في الشكل 1 د بأن رابطة الكبريتيد بين مجالات Cµ3 ضرورية. في الواقع ، لا يزال من الممكن صنع IgM المرتبط ثنائي كبريتيد ، البوليمر إذا كان أي من السيستين الثلاث غائبًا. في سياق النماذج التي تتفاعل فيها كل سلسلة مع سلسلتين أخريين فقط ، تشير هذه النتائج إلى أن بعض الجزيئات تشبه الشكل 1 ج والبعض الآخر مثل الشكل 1 د. ومع ذلك ، فإن توافر ثلاثة السيستين للربط بين السلاسل يشير إلى أن السلاسل ربما قد تربط كل ثلاث سلاسل أخرى ، كما هو موضح في الشكل 2. وبنفس الروح ، يقدم الشكل 2 ج نموذجًا لخماسي يحتوي على سلسلة J يعكس دليلًا على أن سلسلة J تنضم إلى سلاسل غير مرتبطة بالسلاسل الأخرى بواسطة السيستين في مجالات Cµ3. تتم مناقشة هذه النماذج وغيرها ، سواء العادية أو غير المنتظمة في مكان آخر .[27][33]

A,B) توضح هذه الأشكال نموذجين من العديد من النماذج الممكنة لربط ثنائي كبريتيد بين السلاسل في IgM سداسي. كما في الشكل 1 ، يتم تمثيل روابط ثاني كبريتيد Cµ2 وروابط ثاني كبريتيد Cµ4t برأس سهم مزدوج أحمر ، وتمثل روابط ثاني كبريتيد Cµ3 بواسطة الأسهم الطويلة برأسين. في كلا النموذجين A و B ، يرتبط كل نوع من روابط ثنائي الكبريتيد (Cµ2-Cµ2 ؛ Cµ3-Cµ3 ؛ Cµ4tp-Cµ4tp) بسلسلة µ في تسلسل مع كل من الأخرى. تتم مناقشة طرق التمييز بين هذه النماذج وغيرها في المرجع [28]. C) يوضح هذا التمثيل لـ IgM الخماسي كيف يمكن ربط سلسلة J بسلاسل µ غير مرتبطة عبر روابط C23 ثنائي الكبريتيدs
عادة ما يتم تمثيل الخماسي IgM على أنه يحتوي على سلسلة J واحدة لكل بوليمر ، ولكن في الواقع تراوحت قياسات القياس المتكافئ لسلسلة J من جزيء J واحد لكل بوليمر إلى ثلاثة جزيئات J لكل بوليمر .[34][35][36][37] قد يكون النطاق الواسع ناتجًا عن مشاكل فنية ، مثل عدم اكتمال التعريف الإشعاعي أو تحديد خط اوختزلوني بشكل غير دقيق. ومع ذلك ، قد يكون الاختلاف أيضًا بسبب عدم التجانس في تحضيرات IgM ، أي أن التحضيرات المختلفة قد تكون اختلفت بشكل كبير في محتواها من البوليمرات المحتوية على J و J-المعيوبة.
البُنية الثلاثية والرباعية لمنطقة الثابت µ
للحصول على نظرة ثاقبة للبنية التفصيلية ثلاثية الأبعاد للسلسلة µ ، تم إنتاج نطاقات Cµ2 و Cµ3 و Cµ4tp الفردية بشكل منفصل في الإشريشيا المعوية ثم تم تحليلها من خلال مجموعة متنوعة من الطرق ، بما في ذلك معدل الترسيب ، وبلورات الأشعة السينية ، ومطيافية الرنين المغناطيسي النووي. كما هو الحال في الگلوبولين المناعي الآخر ، فإن نطاقات السلسلة الثقيلة لها صفائح متراكبة مميزة تشتمل على سبعة خيوط ، مثبتة بواسطة روابط ثاني كبريتيد داخل النطاق. بشكل عام ، تحتوي منطقة IgM الثابتة على بنية "تشبه الفطر" ، حيث تكون نطاقات Cµ2-Cµ3 قرصًا مشابهًا لرأس الفطر ونطاقات Cµ4tp بارزة مثل ساق قصيرة .[38]
الوظيفة
يتفاعل IgM مع العديد من الجزيئات الفسيولوجية الأخرى:
- يمكن لـ IgM ربط المتممة C1 وتنشيط المسار الكلاسيكي ، مما يؤدي إلى طهاية المستضدات والتحلل الخلوي .
- يرتبط IgM بمستقبل الگلوبولين المناعي (pIgR) في عملية تجلب IgM إلى الأسطح المخاطية ، مثل تجويف الأمعاء وفي حليب الثدي. يعتمد هذا الربط على سلسلة J..[39]
- تم الكشف عن اثنين من مستقبلات Fc الأخرى التي تربط IgM - Fcα / µ-R و Fcµ-R. Fcα / µ-R ، مثل pIgR ، يربط IgM البوليمر و IgA. Fcα / μ-R يمكن التوسط الادخال الخلوي ، والتعبير عنها في الأمعاء يشير إلى وجود دور في المناعة المخاطية. Fcµ-R (المعروف سابقًا باسم Toso / Faim3) يربط IgM حصريًا ويمكنه التوسط في امتصاص الخلايا للمستضد المترافق IgM.[40] ينتج عن تعطيل الجينات المقابلة في الفئران المقلدة نمطًا ظاهريًا ، لكن الوظائف الفسيولوجية لهذه المستقبلات لا تزال غير مؤكدة
تنظيم الاستجابة المناعية
يمكن أن يؤثر الگلوبولين المناعي المحدد الذي يتم حقنه في الحيوانات مع مستضدها على استجابة الجسم المضاد لهذا المستضد نفسه..[42] يمكن أن تؤثر الأجسام المضادة الذاتية المنتجة بعد التمنيع الأساسي أيضًا على استجابة الأجسام المضادة للتمنيع المعزز ، مما يشير إلى حدوث تأثيرات مماثلة أثناء الظروف الفسيولوجية. يمكن أن تكون الآثار "التنظيمية" إيجابية أو سلبية. بمعنى ، اعتمادًا على نوع المستضد والنمط الإيسوي للجسم المضاد ، يمكن أن يكون التأثير قمعًا أو تعزيزًا لاستجابة الجسم المضاد. يتم توضيح هذه الآثار بشكل جيد من خلال التجارب التي تنطوي على التحصين مع كريات الدم الحمراء الغريبة (الأجنبية) (الخلايا الحمراء). على سبيل المثال ، عندما يتم إعطاء IgG مع كريات الدم الحمراء الغريبة ، يؤدي هذا المزيج إلى قمع شبه كامل لاستجابة الأجسام المضادة الخاصة بالكريات الحمراء. يستخدم هذا التأثير سريريًا لمنع الأمهات السلبية Rh من التحصين ضد كريات الدم الحمراء الجنينية إيجابية Rh ، وقد أدى استخدامه إلى انخفاض كبير في الإصابة بمرض انحلال الدم لدى الأطفال حديثي الولادة .[43] على عكس تأثير IgG ، يمكن لـ IgM الخاص بمستضد أن يعزز بشكل كبير استجابة الأجسام المضادة ، خاصة في حالة المستضدات الكبيرة. .[44] وبالتالي ، عندما يتم حقن IgM المحدد لخلايا الدم الحمراء في الحيوانات (بما في ذلك البشر) جنبًا إلى جنب مع كريات الدم الحمراء ، يتم تحفيز استجابة الأجسام المضادة القوية لخلايا الدم الحمراء أكثر مما يتم عند إعطاء كريات الدم الحمراء وحدها. تشير العديد من خطوط الأدلة إلى أن قدرة IgM على تنشيط المتممة مطلوبة لتأثيرها المعزز. أي أن التحسين بوساطة IgM لا يحدث في الحيوانات التي تم استنفادها للمكون المتمم C3 ، ولا في الحيوانات المشتركة التي تفتقر إلى المستقبلات التكميلية 1 و 2. وبالمثل ، فإن IgM المشترك الذي لا يمكنه تنشيط المكمل لا يعزز الاستجابة المناعية. هناك تفسير محتمل للتحسين بوساطة IgM هو أن الخلايا الليمفاوية البائية تلتقط مركبات مكملة للمستضد IgM وتنقل المجمعات إلى مناطق في الطحال حيث يتم إنشاء استجابات مناعية فعالة. نظرًا لأن IgM يتم إنتاجه مبكرًا في الاستجابة المناعية ، فقد يكون هذا مهمًا في بدء استجابات الأجسام المضادة
التخليق
في خط خلايا التناسلية (الحيوانات المنوية والبويضات) ، الجينات التي ستشفر في نهاية المطاف الگلوبولين المناعي ليست في شكل وظيفي (انظر تأشب V (D) J ). في حالة السلسلة الثقيلة ، يتم ربط ثلاثة أجزاء من الخط التناسلي ، المشار إليها بـ V و D و J معًا ومجاورة للحمض النووي المشفر لمنطقة ثابت السلسلة الثقيلة µ. في وقت مبكر من تطور الجنين ، تعبر الخلايا بيتا عن السلاسل µ و δ الثقيلة ؛ التعبير المشترك عن هاتين السلسلتين الثقيلتين ، كل منهما يحمل نفس النطاق V يعتمد على الربط البديل ومواقع إضافة عديد الادنين البديلة. يتم التعبير عن الأنماط الإيسوية الأخرى (γ و ε و α) عن طريق نوع آخر من إعادة ترتيب الحمض النووي ، وهي عملية تسمى تبديل فئة الگلوبولين المناعي.[45]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الأهمية السريرية
IgMهو أول گلوبولين مناعي يتم التعبير عنه في الجنين البشري (حوالي 20 أسبوعًا)[46] وهو من أول الأجسام المضادة التي يتم تطويره .[47]
تظهر الأجسام المضادة لـ IgM في وقت مبكر من مسار العدوى وعادة ما تظهر مرة أخرى ، بدرجة أقل ، بعد التعرض الإضافي. لا تمر الأجسام المضادة لـ IgM عبر المشيمة البشرية (فقط نمط إيسوي IgG ).
هاتان الخاصيتان البيولوجيتان لـ IgM تجعلها مفيدة في تشخيص الأمراض المعدية. يشير إظهار الأجسام المضادة IgM في مصل المريض إلى الإصابة الحديثة ، أو في مصل الوليد يشير إلى العدوى داخل الرحم (على سبيل المثال متلازمة الحصبة الألمانية الخلقية ).
لا يرتبط تطور IgM المضاد للتبرع بعد زرع الأعضاء برفض التطعيم ولكن قد يكون له تأثير وقائي .[48]
غالبًا ما يتم العثور على IgM في المصل الطبيعي لربط مستضدات معينة ، حتى في غياب التحصين المسبق .[49] لهذا السبب يطلق على IgM أحيانًا اسم "الجسم المضاد الطبيعي". من المحتمل أن تكون هذه الظاهرة ناتجة عن الرغابة العالية لـ IgM التي تسمح لها بالربط حتى الكشف عن مستضدات التفاعل المتصالب الضعيف الذي يحدث بشكل طبيعي. على سبيل المثال ، قد تتشكل الأجسام المضادة لـ IgM التي ترتبط بخلايا الدم الحمراء A و B في بداية العمر نتيجة التعرض للمواد A و B الشبيهة الموجودة على البكتيريا أو ربما أيضًا على المواد النباتية
الأجسام المضادة لـ IgM مسؤولة بشكل رئيسي عن تكتل ( تراص ) خلايا الدم الحمراء إذا تلقى المتلقي لنقل الدم دمًا لا يتوافق مع فصيلة دمه .
انظر أيضاً
المصادر
- ^ "Immunoglobulin M". The American Heritage Dictionary of the English Language (Fourth ed.). Houghton Mifflin Company. 2004. ISBN 978-0618082308.
- ^ Alberts, B.; Johnson, A.; Lewis, J.; Walter, P.; Raff, M.; Roberts, K. (2002). "Chapter 24". Molecular Biology of the Cell (4th ed.). Routledge. ISBN 978-0-8153-3288-6.
- ^ Capolunghi, F.; Rosado, M. M.; Sinibaldi, M.; Aranburu, A.; Carsetti, R. (2013). "Why do we need IgM memory B cells?". Immunology Letters. 152 (2): 114–20. doi:10.1016/j.imlet.2013.04.007. PMID 23660557.
- ^ Williams, N.; O'Connell, P. R. (2008). "Chapter 62". Bailey & Love's Short Practice of Surgery (25th ed.). CRC Press. p. 1102. ISBN 9780340939321.
- ^ Heidelberger, M.; Pedersen, K. O. (1937). "The molecular weight of antibodies". Journal of Experimental Medicine. 65 (3): 393–414. doi:10.1084/jem.65.3.393. PMC 2133497. PMID 19870608.
- ^ Kabat, E. A. (1939). "The molecular weight of antibodies". Journal of Experimental Medicine. 69 (1): 103–118. doi:10.1084/jem.69.1.103. PMC 2133729. PMID 19870830.
- ^ Waldenström, J. (1943). "Incipient myelomatisis or "essential" hyoerglobulinemis with fibrinogenopenia—a new syndrome?". Acta Medica Scandinavica. 142 (3–4): 216–247. doi:10.1111/j.0954-6820.1944.tb03955.x.
- ^
Potter, M. (2007). The early history of plasma cell tumors in mice, 1954-1976. Vol. 98. pp. 17–51. doi:10.1016/S0065-230X(06)98002-6. ISBN 9780123738967. PMID 17433907.
{{cite book}}:|journal=ignored (help) - ^ Monica, T. J.; Williams, S. B.; Goochee, C. F.; Maiorella, B. L. (1995). "Characterization of the glycosylation of a human IgM produced by a human-mouse hybridoma". Glycobiology. 5 (2): 175–185. doi:10.1093/glycob/5.2.175. PMID 7780192.
- ^ Heyman, B.; Shulman, M. J. (2016). "Structure, Function, and Production of Immunoglobulin M (IgM)". In Ratcliffe, M. (ed.). Encyclopedia of Immunobiology. Vol. 2. Elsevier. pp. 1–14. doi:10.1016/B978-0-12-374279-7.05001-3. ISBN 978-0-12-374279-7.
- ^ Beale, D.; Feinstein, A. (1969). "Studies on the Reduction of a Human 19S Immunoglobulin M". Biochemical Journal. 112 (2): 187–194. doi:10.1042/bj1120187. PMC 1187691. PMID 4979347.
- ^ Milstein, C.P.; et al. (1975). "Interchain disulfide bridges of mouse Immunoglobulin M". Biochemical Journal. 151 (3): 615–624. doi:10.1042/bj1510615. PMC 1172409. PMID 766753.
- ^ Halpern, M. S.; Koshland, M. E. (1970). "Novel subunit of secretory IgA". Nature. 228 (5278): 1276–1278. Bibcode:1970Natur.228.1276H. doi:10.1038/2281276a0. PMID 5530654.
- ^ Mestecky, J.; Zikin, J.; Butler, W. T. (1971). "Immunoglobulin M an secretory immunoglobulin A: presence of common polypeptide chain different from light chains". Science. 171 (3976): 1163–1165. Bibcode:1971Sci...171.1163M. doi:10.1126/science.171.3976.1163. PMID 5544873.
- ^ Frutiger, S.; et al. (1992). "Disulfide bond assignment in human J chain and its covalent pairing with immunoglobulin M". Biochemistry. 31 (50): 12643–12647. doi:10.1021/bi00165a014. PMID 1472500.
- ^ Johansen, F. E.; Braathen, R.; Brandtzaeg, P. (2000). "Role of J chain in secretory immunoglobulin formation". Scandinavian Journal of Immunology. 52 (3): 240–8. doi:10.1046/j.1365-3083.2000.00790.x. PMID 10972899.
- ^ Sørensen, V.; et al. (2000). "Structural requirements for incorporation of J chain into human IgM and IgA". International Immunology. 12 (1): 19–27. doi:10.1093/intimm/12.1.19. PMID 10607746.
- ^ Cattaneo, A.; Neuberger, M. S. (1987). "Polymeric immunoglobulin M is secreted by transfectants of non-lymphoid cells in the absence of immunoglobulin J chain". The EMBO Journal. 6 (9): 2753–2758. doi:10.1002/j.1460-2075.1987.tb02569.x. PMC 553699. PMID 3119328.
- ^ Fazel, S.; Wiersma, E. J.; Shulman, M. J. (1997). "Interplay of J chain and disulfide bonding in assembly of polymeric IgM". International Immunology. 9 (8): 1149–1158. doi:10.1093/intimm/9.8.1149. PMID 9263012.
- ^ Parkhouse, R.; Askonas, B. A.; Dourmashkin, R. R. (1970). "Electron microscopic studies of mouse immunoglobulin M; structure and reconstitution following reduction". Immunology. 18 (4): 575–584. PMC 1455497. PMID 5421036.
- ^ Schwager, J.; Hadji-Azlmi, I. (1984). "Mitogen-induced B-cell differentiation in Xenopus laevis". Differentiation. 27 (3): 182–188. doi:10.1111/j.1432-0436.1984.tb01426.x. PMID 6334001.
- ^
Fillatreau, S.; et al. (2013). "The astonishing diversity of Ig classes and B cell repertoires in teleost fish". Frontiers in Immunology. 4: 1–14. doi:10.3389/fimmu.2013.00028. PMC 3570791. PMID 23408183.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Getahun, A.; et al. (1999). "Influence of the μ-chain C-terminal sequence on polymerization of immunoglobulin M". Immunology. 97 (3): 408–413. doi:10.1046/j.1365-2567.1999.00797.x. PMC 2326861. PMID 10447761.
- ^ Dolder, F. (1971). "Occurrence, Isolation and Interchain Bridges of Natural 7-S Immunoglobulin M in Human Serum". Biochimica et Biophysica Acta. 236 (3): 675–685. PMID 4997811.
- ^ Eskeland, T.; Christensen, T. B. (1975). "IgM molecules with and without J chain in serum and after purification, studied by ultracentrifugation, electrophoresis, and electron microsopy". Scandinavian Journal of Immunology. 4 (3): 217–228. doi:10.1111/j.1365-3083.1975.tb02620.x. PMID 807966.
- ^ Davis, A. C.; Roux, K. H.; Shulman, M. J. (1988). "On the structure of polymeric IgM". European Journal of Immunology. 18 (7): 1001–1008. doi:10.1002/eji.1830180705. PMID 3136022.
- ^ أ ب Davis, A. C.; et al. (1989). "Intermolecular disulfide bonding in IgM: effects of replacing cysteine residues in the µ heavy chain". The EMBO Journal. 8 (9): 2519–2526. doi:10.1002/j.1460-2075.1989.tb08389.x. PMC 401247. PMID 2511005.
- ^ Collins, C.; Tsui, F. W.; Shulman, M. J. (2002). "Differential activation of human and guinea pig complement by pentameric and hexameric IgM". European Journal of Immunology. 32 (6): 1802–1810. doi:10.1002/1521-4141(200206)32:6<1802::AID-IMMU1802>3.0.CO;2-C. PMID 12115664.
- ^ Davis, A. C.; et al. (1989). "Mutations of the mouse m H chain which prevent polymer assembly". Journal of Immunology. 43 (4): 1352–1357. PMID 2501393.
- ^ Smith, R. I. F.; Coloma, M. J.; Morrison, S. L. (1995). "Addition of a mu-tailpiece to IgG results in polymeric antibodies with enhanced effector functions including complement-mediated cytolysis by IgG4". Journal of Immunology. 154 (5): 2226–2236. PMID 7868896.
- ^ Sørensen, V.; et al. (1996). "Effect of the IgM and IgA secretory tailpieces on polymerization and secretion of IgM and IgG". Journal of Immunology. 156 (8): 2858–2865. PMID 8609405.
- ^ Smith, R.; Morrison, S. L. (1994). "Recombinant polymeric IgG: An approach to engineering more potent antibodies". Nature Biotechnology. 12 (7): 683–688. doi:10.1038/nbt0794-683. PMID 7764912.
- ^ Wiersma, E. J.; Shulman, M. J. (1995). "Assembly of IgM: role of disulfide bonding and noncovalent interactions". Journal of Immunology. 154 (10): 5265–5272. PMID 7730630.
- ^ Chapuis, R. M.; Koshland, M. E. (1974). "Mechanism of IgM polymerization". Proc. Natl. Acad. Sci. U.S.A. 71 (3): 657–661. Bibcode:1974PNAS...71..657C. doi:10.1073/pnas.71.3.657. PMC 388071. PMID 4207070.
- ^ Mihaesco, C.; Mihaesco, E.; Metzger, H. (1973). "Variable J-chain content in human IgM". FEBS Letters. 37 (2): 303–306. doi:10.1016/0014-5793(73)80483-1. PMID 4202824.
- ^ Brandtzaeg, P. (1976). "Complex formation between secretory component and human immunoglobulin related to their content of J chain". Scandinavian Journal of Immunology. 5 (4): 411–419. doi:10.1111/j.1365-3083.1976.tb00295.x. PMID 821140.
- ^ Grubb, A. O. (1978). "Quantitation of J chain in human biological fluids by a simple immunochemical procedure". Acta Medica Scandinavica. 204 (1–6): 453–465. doi:10.1111/j.0954-6820.1978.tb08473.x. PMID 104551.
- ^ Müller, R.; et al. (2013). "High-resolutiion structures of the IgM Fc domainsreveal principles of its hexamer formation". Proc. Natl. Acad. Sci. U.S.A. 110 (25): 10183–10188. Bibcode:2013PNAS..11010183M. doi:10.1073/pnas.1300547110. PMC 3690842. PMID 23733956.
- ^ Johansen, F. E.; Braathen, R.; Brandtzaeg, P. (2000). "Role of J chain in secretory immunoglobulin formation". Scandinavian Journal of Immunology. 52 (3): 240–8. doi:10.1046/j.1365-3083.2000.00790.x. PMID 10972899.
- ^ Shima, H.; et al. (2010). "Identification of TOSO/FAIM3 as an Fc receptor for IgM". Int. Immunol. 22 (3): 149–56. doi:10.1093/intimm/dxp121. PMID 20042454.
- ^ Ouchida, R.; et al. (2012). "Critical role of the IgM Fc receptor in IgM homeostasis, B-cell survival, and humoral immune responses". Proc. Natl. Acad. Sci. U.S.A. 109 (40): E2699–706. Bibcode:2012PNAS..109E2699O. doi:10.1073/pnas.1210706109. PMC 3479561. PMID 22988094.
- ^ Heyman, B (2013). Antibody mediated regulation of humoral immunity. in Nimmerjahn, F. (ed.) Molecular and cellular mechanisms of antibody activity: Springer.
- ^ Urbaniak, S. J. & Greiss, M. A. (2000). "RhD haemolytic disease of the fetus and the newborn". Blood Rev. 14 (1): 33–61. doi:10.1054/blre.1999.0123. PMID 10805260.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Sörman A, Zhang L, Ding Z, Heyman, B. (2014). "How antibodies use complement to regulate antibody responses". Mol. Immunol. 61 (2): 79–88. doi:10.1016/j.molimm.2014.06.010. PMID 25001046.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Murphy, K.; Weaver, C. (2016). Janeway's Immunobiology. New York, NY: Garland Science/Taylor and Francis. p. 195. ISBN 9780815345053.
- ^ van Furth, R.; Schuit, H. R.; Hijmans, W. (1965). "The immunological development of the human fetus". Journal of Experimental Medicine. 122 (6): 1173–88. doi:10.1084/jem.122.6.1173. PMC 2138097. PMID 4159036.
- ^ Review of Medical Physiology by William Francis Ganong
- ^ McAlister, C. C.; et al. (2004). "Protective anti-donor IgM production after crossmatch positive liver-kidney transplantation". Liver Transplantation. 10 (2): 315–9. doi:10.1002/lt.20062. PMID 14762873.
- ^ Jayasekera, J. P.; Moseman, E. A.; Carroll, M. C. (2007). "Natural antibody and complement mediate neutralization of influenza virus in the absence of prior immunity". Journal of Virology. 81 (7): 3487–94. doi:10.1128/JVI.02128-06. PMC 1866020. PMID 17202212.
وصلات خارجية
| Classification | |
|---|---|
| External resources |
- MeSH Immunoglobulin+M
- Immunoglobulin M Deficiency Reference from Medscape.com