حمض كربوكسيلي
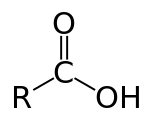
الأحماض الكربوكسيلية Carboxylic acids (![]() /ˌkɑrbɒkˈsɪlɪk/) هي أحماض عضوية تصنف في ظل وجود مجموعة الكربوكسيل الفعالة COOH)). كما أنها تندرج تحت تصنيف العالمين (برونشتد ولاوري) للأحماض ، حيث تقوم بمنح البروتون. صيغتها العامة هي R-COOH، حيث R من الممكن أن تكون إما جذر ألكيلي أو ذرة هيدروجين، وهي منتشرة في الطبيعة بشكل كبير.
/ˌkɑrbɒkˈsɪlɪk/) هي أحماض عضوية تصنف في ظل وجود مجموعة الكربوكسيل الفعالة COOH)). كما أنها تندرج تحت تصنيف العالمين (برونشتد ولاوري) للأحماض ، حيث تقوم بمنح البروتون. صيغتها العامة هي R-COOH، حيث R من الممكن أن تكون إما جذر ألكيلي أو ذرة هيدروجين، وهي منتشرة في الطبيعة بشكل كبير.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخصائص الفيزيائية
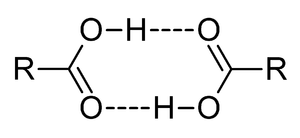 ثنائيات الوحدات في الأحماض الكربوكسيلية. |
|
نقطة الغليان
الحموضة
| الحمض الكربوكسيلي | pKa |
|---|---|
| حمض الفورميك (HCO2H) | 3.75 |
| حمض الخليك (CH3COOH) | 4.76 |
| حمض الكلوروخليك (CH2ClCO2H) | 2.86 |
| حمض ثنائي كلوروخليك (CHCl2CO2H) | 1.29 |
| حمض ثلاثي كلوروخليك (CCl3CO2H) | 0.65 |
| حمض ثلاثي فلوروخليك (CF3CO2H) | 0.5 |
| حمض الأكساليك (HO2CCO2H) | 1.27 |
| حمض البنزويك (C6H5CO2H) | 4.2 |
الرائحة
التواجد والتطبيقات
استقرارية الحمض
- إذا تمعنا في التأثير الحثي Inductive effect))، نجد أن تفسير حمضية الأحماض الكربوكسيلية يعود إلى ذرة الأكسجين ذات السالبية الكهربائية.
- والتي بدورها تقوم بتدمير السحابة الإلكترونية المحيطة على الرابطة O-H وبالتالي إضعافها.
- هذي الرابطة الضعيفة تجعل الجزيء أقل استقرارًا، كما تجعل ذرة الهيدروجين أقل استقرارًا وثباتيةً.
- وبالتالي يسهل تفكها ليعطينا بروتونًا موجبًا H+ . ( تعريف برونشتد ولاوري للمركبات الحمضية).
- وبما أن الحمض غير مستقر، هذا سيؤدي إلى أن التوازن سيتجه لجهة اليمين أكثر.
- في حال إضافة ذرات أو مجموعات ذات سالبية كهربائية عالية للمركب مثل الكلور وذرة الهيدروكسيل ، تزيد من الحامضية بالتأثير الحثي.
- على سبيل المثال، ثلاثي كلورو حمض الخل (3 ذرات كلور) أقوى حامضية من حمض اللبن ( ذرة هيدروكسيل واحدة)، والذي بدوره يعتبر أقوى حامضية من حمض الخل (لا يحتوي على إضافات).
استقرارية القاعدة المقترنة
- يمكن تفسير حمضية الأحماض الكربوكسيلية عن طريق التـأثـيـر الـرنيني (resonance effect) .
- فبعد تفكك الحمض الكربوكسيلي ينتج مركب ذات تأثير رنيـــني ثابت.
- بحيث يتم التشارك بالإشارة السالبة بين ذرتي الأكسجيــن.
- ويتواجد في الرابطة بين الكربون والأكسجين ما يعرف بـ (خصائص الرابطة المزدوجة).
- فبما أن القاعدة المقترنة مستقرة، إذن فإن سهم التوازن الأعلى يميل إلى جهة اليمين من التفاعل.
المسميات والأمثلة
| الاسم الشائع | اسم أيواپك | الصيغة الكيميائية | الصيغة الهيكلية |
|---|---|---|---|
| حمض الأوكساليك | ethanedioic acid | HOOC-COOH | |
| حمض المانوليك | propanedioic acid | HOOC-(CH2)-COOH | |
| حمض السوكسنيك | butanedioic acid | HOOC-(CH2)2-COOH | 
|
| حمض الگلوتاريك | pentanedioic acid | HOOC-(CH2)3-COOH | |
| حمض الأديپيك | hexanedioic acid | HOOC-(CH2)4-COOH | 
|
| حمض الپيمليك | heptanedioic acid | HOOC-(CH2)5-COOH | |
| حمض السوبريك | octanedioic acid | HOOC-(CH2)6-COOH | 
|
| حمض الأزليك | nonanedioic acid | HOOC-(CH2)7-COOH | |
| حمض السباسيك | decanedioic acid | HOOC-(CH2)8-COOH | 
|
| حمض الأندكانديويك | HOOC-(CH2)9-COOH | ||
| حمض الدودكانديويك | HOOC-(CH2)10-COOH |
| الاسم الشائع | اسم إيواپك | الصيغة الكيميائية | الصيغة الهيكلية |
|---|---|---|---|
| (Ortho-)حمض الفتاليك | benzene-1,2-dicarboxylic acid o-phthalic acid |
C6H4(COOH)2 | 
|
| حمض الأيزوفتاليك | benzene-1,3-dicarboxylic acid m-phthalic acid |
C6H4(COOH)2 | 
|
| حمض الترفتاليك | benzene-1,4-dicarboxylic acid p-phthalic acid |
C6H4(COOH)2 | 
|
| الاسم الشائع | اسم إيواپك | الصيغة الكيميائية | الصيغة الهيكلية | |
|---|---|---|---|---|
| Monounsaturated: two isomeric forms: cis and trans | Maleic acid (cis form) and Fumaric acid (trans form) | (Z)-Butenedioic acid and (E)-Butenedioic acid | HO2CCH=CHCO2H | |
| Glutaconic acid | Pent-2-enedioic acid | HO2CCH=CHCH2CO2H | ||
| حمض التروماتيك | Dodec-2-enedioic acid | HO2C(CH2)8CH=CHCO2H | ||
| Diunsaturated: three isomeric forms: trans,trans, cis,trans and cis,cis | Muconic acid | (2E,4E)-Hexa-2,4-dienedioic acid | HO2CCH=CHCH=CHCO2H |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
طرق تحضير وتصنيع هذه المركبات
يمكن تحضير هذه المركبات بعدة طرق، منها:
- أكسدة الكحول الأولية مع الألدهيدات بمؤكسدات قوية. مثل (كاشف تولن، برمنغنات البوتاسيوم).
- الأكسدة الكلية لذرة ألكيل مرتبطة مع حلقة بنزين. وذلك بغض النظر عن طول سلسلة ذرة الألكيل.
- تميؤ الإسترات أو الأميدات أو النيترات بإضافة قاعدة أو حمض.
- تفاعل كاشف جرينيارد مع ثاني أكسيد الكربون ( على الرغم من عدم انتشار هذه الطريقة تجاريًا).
تفاعلاتها
هنا نذكر البعض من تفاعلات الأحماض الكربوكسيلية.
- تتفاعل الأحماض الكربوكسيلية مع القواعد لتكون أملاح الحمض. بحيث يتم استبدال ذرة الهيدروجين المتواجدة على الرابطة O-H بمعدن.
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O
- كما تتفاعل مع الكحول والأمينات لتنتج الإسترات والأميدات.
- تفاعلات آرندت إيستيرت ، حيث يتم إدخال مجموعة α – ميثيلين للحمض الكاربوكسيلي.
- تفاعلات إعادة ترتيب كورتيس ، تحول الحمض الكاربوكسيلي إلى أيزو سيانيت.
- تفاعلات شميديت، تحول الأحماض الكربوكسيلية إلى أمينات.
- في تفاعلات هندسديكر، يتم انتزاع ذرة كربوكسيل.
- تفاعلات ديكون ويست، تحول الأحماض الأمينية إلى كيتون أمين مماثــل.
طرق تحضيره
الطرق الصناعية
الطرق المعملية
التفاعلات الأقل شيوعاً
الأحماض الكحولية
هي الحموض الغولية acides - alcools وهي مركبات تحتوي على الأقل على وظيفة حمضية واحدة وعلى وظيفة غولية واحدة؛ وتشمل مركبات طبيعية متعددة كحمض اللبن acide lactique وحمض التفاح acide malique وحمض الطرطير acide tartrique وحمض الليمون acide citrique، وأبسطها حمض الغليكوليك acide glycolique.
تحضيرها
تختلف طريقة تحضير الحموض الغولية بحسب بعد الوظيفتين الحمضية والغولية عن بعضهما، فالحموض الغولية - ألفا يمكن تحضيرها بإحدى الطرق الآتية:
أ - بتحويل الحموض إلى مشتقات هالوجينية وتحويل هذه المشتقات بعد ذلك بالحلمهة hydrolyse إلى حموض غولية - ألفا:
ب - بإرجاع الحموض الكيتونية - ألفا؛ فحمض البيروفي acide pyruvique مثلاً يتحول بالإرجاع إلى حمض اللبن:
جـ - بالاصطناع وذلك بتأثير حمض سيانور الماء (NCH) في الألدهيدات أو الخلونات cétones وحلمهة الناتج:
أما الحموض الغولية - بيتا فتُحضّر بحلمهة الحموض الإيتيلينية - ألفا:
وأما الحموض الغولية گاما ودلتا فتحضر بالحلمهة القلوية للحموض الهالوجينية گاما أو دلتا:
خواصها الفيزيائية والكيمياوية
هي مركبات ذوابة في الماء، طعمها حامض، وحموضتها أشد قليلاً من الحموض العادية التي لها السلسلة الكربونية نفسها.
تتمتع الحموض الغولية بصفات الحموض وبصفات الأغوال معاً، فهي إما أن تتحد مع الحموض بوظيفتها الغولية أو مع الأغوال بوظيفتها الحمضية. وتختلف صفاتها باختلاف موضع الوظيفة الغولية بالنسبة للوظيفة الحمضية، فإذا كانت هاتان الوظيفتان بالوضع ألفا فإنه يتأستر جُزيئان من الحمض الغولي معاً ويتكون إستر حلقي Cyclique مضاعف يدعى لاكتيد Lactide:
أما إذا كانت الوظيفتان الحمضية والغولية بالوضع بيتا فإن جُزيئاً من الحمض الغولي يفقد بالتسخين جُزيئاً من الماء ويتكون حمض إيتيليني:
وأما إذا كانت الوظيفتان الحمضية والغولية بالوضع غاما أو دلتا أو أكثر من ذلك فإن جُزيْئاً من الحمض الغولي يفقد جُزيئاً من الماء ويتكون جسم يدعى لاكتون Lactone:
الحموض الغولية الرئيسية
إن أشهر الحموض الغولية هي حمض اللبن وحمض التفاح وحمض الطرطير وحمض الليمون.
أ - حمض اللبن: صيغته الكيمياوية CH3.CHOH.COOH ويدعى أيضاً حمض ألفا - هيدروكسي بروبيونيك A-hydroxy propionique، وقد اكتشفه الكيمياوي شيل Sheele عام 1780. يحضر حمض اللبن بتخمير المواد السكرية بالعصيّات اللبنية الموجودة في الجبن المتفسخ، فالغلوكوز مثلاً يتحول بالاختمار المذكور إلى حمض اللبن.
ويُجرى العمل بدرجة 45-55 ْ بوجود كربونات الكالسيوم التي تُعدّل حمض اللبن كلما تكوَّن.
ويحضَّر حمض اللبن بالاصطناع من حمض البروبيونيك acide propionique وذلك بتحويله بالبروم إلى حمض (ألفا - بروموبروبيونيك) وهذا يسخن مع محلول قلوي ممدد فيتحول إلى لَبَنات Lactate.
خواصه الفيزيائية والكيميائية: هو سائل عديم اللون أو أصفر قليلاً، عديم الرائحة، طعمه حامض شديد، كثافته (1.22غ/سم3) في الدرجة 15 ْ س، وهو كثير الانحلال في الماء والغول.
إذا ترك حمض اللبن مدة من الزمن فإنه يتأستر جُزيئان منه مع بعضهما ويتكون حمض لاكتيل لاكتيك acide Lactyl lactique، ويحتوي هذا الحمض المتكون على وظيفة حمضية وأخرى غولية ثانوية، يمكن أن تتأستر هاتان الوظيفتان بالحرارة فيتكون جسم يدعى لاكْتيد.
وإذا سُخِّن حمض اللبن مع حمض الكبريت المركّز فإنه ينشر غاز أول أُكْسيد الكربون:
وإذا سخِّن حمض اللبن مع حمض الكبريت الممدد لدرجة 130 ْس فإنه يتحول إلى أستاليدهيد وحمض النمل acide formique:
ويكوِّن حمض اللبن مع القلويات أملاحاً تدعى لَبَنات منها لبنات الصوديوم ولبنات البوتاسيوم ولبنات الكالسيوم.
ب - حمض التفاح: صيغته COOH.CHOH.CH2.COOH ويدعى حمض أُوكسي سوكسينيك acide oxysuceinique.
يوجد هذا الحمض في كثير من الفواكه كالتفاح والعنب والكرز، ويستحصل من عُصارات هذه الفواكه، وهو بشكل بلورات إبرية تنحل في الماء وفي الغول، وينصهر بدرجة 100 ْ، وإذا سُخن لدرجة 150 ْ فإنه يفقد جزيئاً من الماء متحولاً إلى حمض الفوماريك acide fumarique.
ويتحول بفعل حمض الآزوت إلى حمض الحمّاض acide oxalique. ويكوِّن حمض التفاح مع القلويات نوعين من الأملاح أحدهما معتدل والثاني حامض.
جـ - حمض الطرطير: صيغته COOH.CHOH.CHOH.COOH ويدعى حمض دي أوكسي سوكسينيك acide dioxysuceinique.
يوجد هذا الحمض في العنب وفي التمر الهندي وفي الرواسب المتجمعة في أسفل دِنان الخمر بحالة طرطرات البوتاس الحامضة، ويستحصل من هذه الرواسب. ويحتوي حمض الطرطير على ذرتي كربون غير متناظر ولذلك فإن له عدة مماكبات isomeres.
خواصه الفيزيائية والكيميائية: هو بلورات شفافة عديمة اللون والرائحة، طعمها حامض شديد، كثافتها (1.76غ/سم3) وتنصهر بدرجة 170 ْ س، وينحل حمض الطرطير في الماء وفي الغول. وإذا سخن حمض الطرطير إلى أعلى من درجة انصهاره فإنه يتحلل ناشراً غاز ثاني أكسيد الكربون وبخار الماء وأبخرة قابلة للاشتعال؛ وإذا أُرجع بحمض يود الماء (IH) فإنه يتحول إلى حمض التفاح وحمض الكهرباء؛ ويتحلل بتأثير المؤكسدات الشديدة إلى غاز أكسيد الكربون وحمض النمل وماء. ويكوّن حمض الطرطير مع القلويات نوعين من الأملاح أحدهما معتدل والثاني حامض.
د - حمض الليمون: اكتشفه الكيمياوي شيل Scheele عام 1784، وهو يوجد في عصارات الفواكه الحامضة، ويحضر من عصير الليمون أو بتخمير الغلوكوز ببعض الفطور:
خواصه الفيزيائية والكيمياوية: هو بلورات شفافة، عديمة اللون والرائحة، طعمها حامض شديد، كثافتها (1.542غ/سم3). وهو ذواب في الماء وفي الغول، ولايحرف الضوء المستقطب.
إذا سُخِّن حمض الليمون لدرجة 100 ْ س فإنه يفقد كامل مائه، ويتحول بدرجة 175 ْ س إلى حمض الأكونيت acide aconitique، ويتحول بدرجة أعلى من ذلك إلى حموض متماكبة منها حمض إيتاكونيك acide itaconique وحمض سِيتراكونيك acide citraconique ويحترق أخيراً دون ترك بقية. ويكوّن حمض الليمون مع القلويات أملاحاً تدعى ليمونات Citrates منها ليمونات الصوديوم وليمونات البوتاسيوم.[1]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
انظر أيضاً
المصادر
- ^ راتب محملجي. "الحموض الغولية". الموسوعة العربية.
وصلات خارجية
- Carboxylic acids synthesis - Collection of links pertaining to synthesis of Carboxylic acid
- Carboxylic acids pH and titration - freeware for calculations, data analysis, simulation, and distribution diagram generation