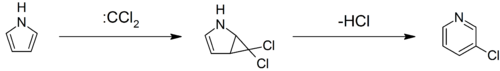پيريدين
|
| |||
|
| |||

| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
الپيريدين
| |||
| أسماء أخرى
أزين
أزابنزين | |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.464 | ||
| رقم EC |
| ||
| KEGG | |||
PubChem CID
|
|||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| الخصائص | |||
| الصيغة الجزيئية | C5H5N | ||
| كتلة مولية | 79.1 g mol-1 | ||
| المظهر | سائل عديم اللون إلى أصفر[1] | ||
| الرائحة | مقززة، تشبه رائحة السمك[1] | ||
| الكثافة | 0.9819 گ/مل[2] | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | قابل للامتزاج | ||
| ضغط البخار | 16 mmHg (20°C)[1] | ||
| الحموضة (pKa) | 5.25 (for the conjugate acid)[3][4] | ||
| معامل الانكسار (nD) | 1.5093 | ||
| اللزوجة | 0.88 cP | ||
| Dipole moment | 2.2 D[5] | ||
| المخاطر | |||
تبويب الاتحاد الاوروپي (DSD)
|
قابل للاشتعال (F) مضر(Xn) | ||
| توصيف المخاطر | R20 R21 R22 R34 R36 R38 | ||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | 21 °C (70 °F; 294 K) | ||
| حدود الانفجار | 1.8%-12.4%[1] | ||
| 5 ppm (TWA) | |||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
891 mg/kg (rat, oral) 1500 mg/kg (mouse, oral) 1580 mg/kg (rat, oral)[6] | ||
LC50 (التركيز الأوسط)
|
9000 ppm (rat, 1 hr)[6] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
TWA 5 ppm (15 mg/m3)[1] | ||
REL (الموصى به)
|
TWA 5 ppm (15 mg/m3)[1] | ||
IDLH (خطر عاجل)
|
1000 ppm[1] | ||
| مركبات ذا علاقة | |||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
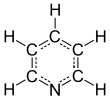
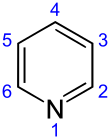
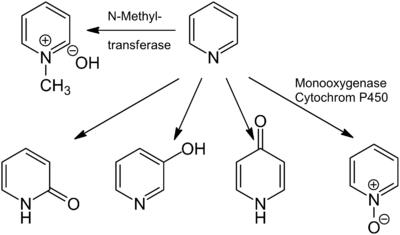
الپيردين Pyridine، هو مركب عضوي حلقي غير متجانس أساسي صيغته الكيميائية C5H5N. وهو مرتبط هيكلياً بالبنزين، بمجموعة مثين واحدة (=CH-) مستبدلة بذرة نتروجين. توجد حلقة الپيردين في الكثير من المركبات الهامة، ومنها الأزينات مع فيتامينات النياسين والپيريدوكسال.
أكتشف الپيردين عام 1849 بواسطة الكيميائي الاكستنلدي توماس أندرسون كأحد مكونات زيت العظام. بعد سنتين، عزل أندرسون الپيردين النقي بتقطيره بالتجزئة من الزيت. وهو سائل عديم اللون، قابل للاشتعال بدرجة كبيرة، قلوي ضعيف، قابل للذوبان في الماء وذو رائحة ميزة، غير مستحبة تشبه رائحة السمك.
الخصائص
الخصائص الفيزيائية
- البيريدين سائل عديم اللون، له رائحة كريهة.
الخصائص الكيميائية
- يمتزج البيريدين مع الماء، كما أنه يمتزج مع أغلب المحلات العضوية مثل الإيثانول والكلوروفورم وثنائي إيثيل الإيثر والأسيتون.
- يعد البيريدين من الحلقات العطرية القاعدية، حيث يتفاعل البيريدين مع الأحماض القوية مثل حمض كلور الماء مشكلاً ملح هيدرو الكلوريد الذي ينصهر عند 145°س .
- نتيجة وجود ذرة النيتروجين الكهرسلبية (الساحبة للإلكترونات) فإن الحلقة البيريدينية فقيرة بالإلكترونات نسبياً، مما يثبط بالتالي حدوث تفاعلات الاستبدال المحبة للإلكترونات (الاستبدال الإلكتروفيلي) النمطية للمركبات العطرية.
الخصائص الجزيئية
 Bond lengths and angles of benzene, pyridine, phosphorine, arsabenzene, stibabenzene, and bismabenzene |
|
التاريخ
التواجد
التسمية
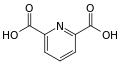
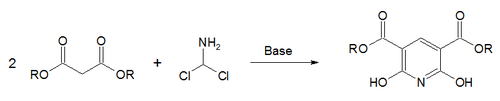
pyridine-2,6-dicarboxylic acid (dipicolinic acid)
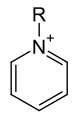
General form of the pyridinium cation
التحضير
يوجد البيريدين طبيعياً في قطران الفحم. كما يمكن اصطناع البيريدين من الأسيت ألدهيد والفورمالدهيد والأمونياك. تدعى هذه العملية اصطناع تشيتشيبابين للبيريدين.
- CH2O + NH3 + 2 CH3CHO → C5H5N + 3 H2O + H2
تخليق چيچيبابين
إزالة ألكلة الألكيلپيريدين
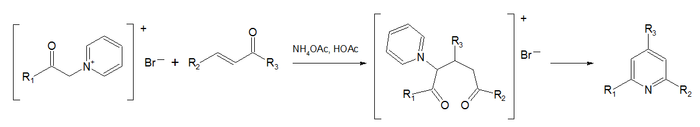
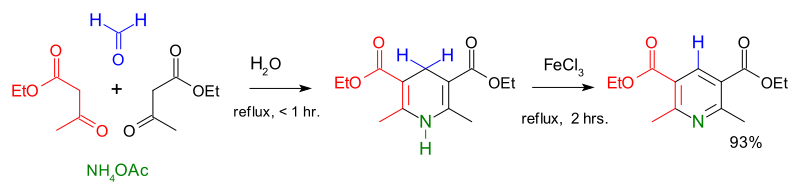
تخليق هانتزتش
تدوير بونمان
طرق أخرى
التخليق الحيوي
التفاعلات
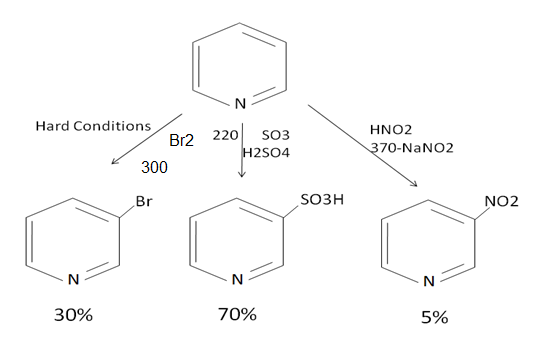
حلقة الپيريدين البسيطة (لا تملك متبادلات) خاملة أو ضعيفة التفاعل أي لا تتم تفاعلات التبادل الالكتروفيلي إلا بشروط قاسية ومثالية( مثلاً حرارة مرتفعة تزيد الطاقة وتفرض على المركب التفاعل) والمردود يختلف من تفاعل إلى تفاعل وقليل نسبياً لأن المتفاعل سوف يتجه نحو N بدل اتجاهه نحو الحلقة بسبب مزدوج N. وفي حال حدوث التفاعل على الحلقة سوف يحصل بالموقع 3 حصراً وتم الاستفادة من الپيريدين (تفاعلاته خاملة أو صعبة) باستخدامه كمحل لا يتفاعل مع المواد المتفاعلة.[8]
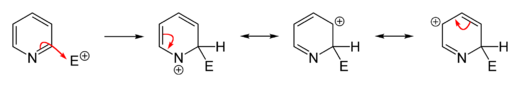
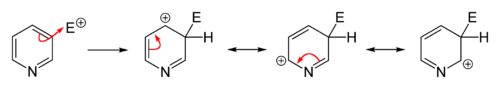
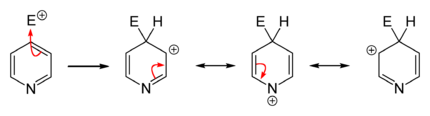
الاستبدال المحب للإلكترون
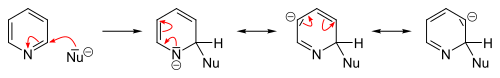
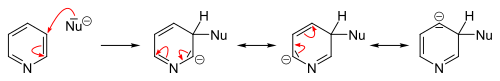
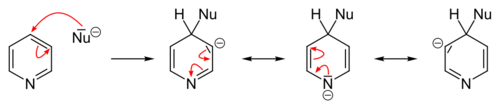
التبادل المحب للنواة
التفاعلات المحبة للنواة تتم بسهولة عكس الإلكتروفيلية سواءً على البسيط أو الذي يحوي متبادلات إلا أننا نقوم بها عادة على مشتقات البيريدين (المستبدل). التبادل المحب يحدث (2 أو 4).
التفاعلات الأساسية
التفاعلات على ذرة النتروجين
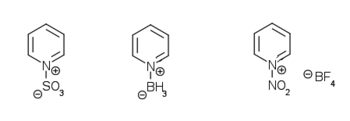
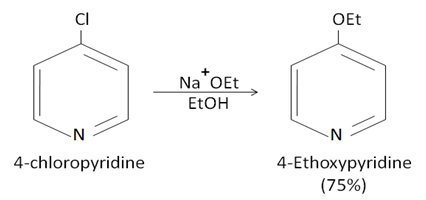
كيف نقوم بعملية النترجة لنحصل على مردود أعلى (أو غيرها)؟ (طريقة غير مباشرة)
i.إعاقة ذرة النتروجين Blocking وذلك بمفاعلتها بمادة أخرى (كي لا تتجه المواد المتفاعلة نحوها)
ii.بماأن الحلقة <unreactive> نفعل الحلقة بإضافة متبادل غني بالإلكترونات (أفضلها الأكسجين) حيث تتوزع الإلكترونات الحرة حول الحلقة فيتفاعل بسهولة(حالة عدم توضع) على أن نكون قادرين على حذف المجموعة بعد انتهاء التفاعل.
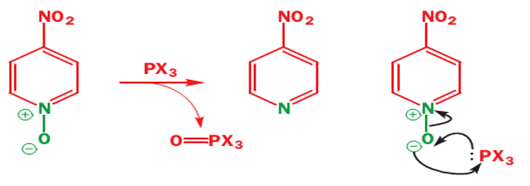
ونلاحظ أنه بالأكسدة على ذرة النتروجين يتشكل N-oxide وهو stable dipolar (مركبات ثابتة والرابطة قطبية وهذه المركبات فعالة للتبادل الالكتروفيلي والنوكليوفيلي), وبالتالي أغلقنا ذرة الأزوت ومنعناها من الارتباط بالمتبادلات الالكتروفيليةكما أصبحت الالكترونات غير متوضعة وتميل للتفاعل ....
علماً أن بهذه الطريقة غيرالمباشرة: المتبادل سوف يرتبط إما بـ 2 أو 4 (غالباً(4 أما المباشر كان بالموقع 3
[[ملف:]Pp.png]
ولنزع الأوكسجين من ذرة النتروجين نضيف المركبات PX3 ومثالها PCl3 وبالتالي نحصل على المركب المطلوب بنسبة عالية.
الهدرجة والاختزال
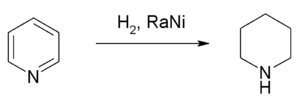
إشباع البيريدين يتشكل لدينا مركب مشبع هو البيبريدين Piperidine ويتحول شكله إلى كرسي (لم تعد مستوية)
التطبيقات
- بستخدم البيريدين بكثرة في الاصطناع العضوي كمحل (مذيب) وكمادة متفاعلة [9].
- يدخل البيريدين في صناعة العديد من الصناعات الكيميائية مثل الصناعات الدوائية، وصناعة المبيدات الحشرية والعشبية، وصناعة المطاط واللواصق.
المبيدات
المحاليل
بادئ الپيپريدين
الكواشف الخاصة للپيريدين

قاعدة ليگاند ولويس
مشتقات الپيريدين
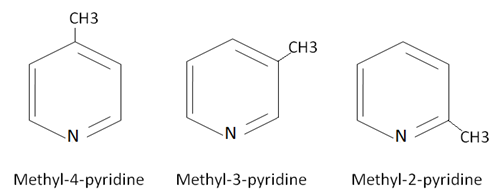
- ميتيل الپيريدين (الپيكولين Methyl-pyridine (Picoline ممكن في أي من المواقع (2,3,4)
- هيدروكسي الپيريدين ممكن في أي من المواقع (2,3,4)، من مشتقات الـHydroxypyridine:
من مشتقاته الپيريدوكسال وفوفسات الپيريدوكسال والمركب الأخير هو الـCo-Enzyme الهام جداً في العمليات الحيوية في الجسم.
- حمض الپيريديل الكربوكسيلي:
المخاطر
المخاوف الصحية
{-}}
انظر أيضاً
- 6-membered aromatic rings with one carbon replaced by another group: borabenzene, benzene, silabenzene, germabenzene, stannabenzene, phosphorine, arsabenzene, pyrylium salt
- 6-membered rings with two nitrogen atoms: diazines
- 6-membered rings with three nitrogen atoms: triazines
- 6-membered rings with four nitrogen atoms: tetrazines
- 6-membered rings with six nitrogen atoms: hexazine
المصادر
- ^ أ ب ت ث ج ح خ NIOSH Pocket Guide to Chemical Hazards 0541
- ^ Lide, p. 3-474
- ^ Linnell, Robert (1960). Journal of Organic Chemistry. 25 (2): 290. doi:10.1021/jo01072a623.
{{cite journal}}: Missing or empty|title=(help) - ^ Pearson, Ralph G.; Williams, Forrest V. (1953). Journal of the American Chemical Society. 75 (13): 3073. doi:10.1021/ja01109a008.
{{cite journal}}: Missing or empty|title=(help) - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةroempp - ^ أ ب "Pyridine". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Pyridine MSDS. fishersci.com
- ^ بيريدين، موسوعة العلوم العربية
- ^ Sherman, A. R. “Pyridine” in e-EROS (Encyclopedia of Reagents for Organic Synthesis) (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289X.rp280 Article Online Posting Date: April 15, 2001.
- ^ Environmental and health criteria for paraquat and diquat, World Health Organization, Geneva, 1984
المراجع
- Joule, J. A. and Mills, K. (2010). Heterocyclic Chemistry (5th ed.). Chichester: Blackwell Publishing. ISBN 1-4051-3300-7.
{{cite book}}: CS1 maint: multiple names: authors list (link) - Lide, D. R., ed. (2009). Handbook of Chemistry and Physics (90th ed.). Boca Raton: CRC Press. ISBN 978-1-4200-9084-0.
وصلات خارجية
- CS1 errors: missing title
- Articles with changed EBI identifier
- ECHA InfoCard ID from Wikidata
- Chemical articles with unknown parameter in Chembox
- Articles containing unverified chemical infoboxes
- Short description is different from Wikidata
- Use dmy dates from June 2013
- پيريدينات
- محاليل أمينية
- Foul-smelling chemicals
- قواعد عطرية
- مركبات عطرية
- حلقات عطرية بسيطة