إثيلين

| |||
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
Ethene
| |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.742 | ||
| KEGG | |||
PubChem CID
|
|||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| الخصائص | |||
| الصيغة الجزيئية | C2H4 | ||
| كتلة مولية | 28.05 g/mol | ||
| المظهر | colorless gas | ||
| الكثافة | 1.178 kg/m3 at 15 °C, gas[1] | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | 3.5 mg/100 mL (17 °C)[بحاجة لمصدر] ; 2.9 mg/L[2] | ||
| قابلية الذوبان في ethanol | 4.22 mg/L[2] | ||
| قابلية الذوبان في diethyl ether | good[2] | ||
| الحموضة (pKa) | 44 | ||
| البنية | |||
| الشكل الجزيئي | D2h | ||
| Dipole moment | zero | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
+52.47 kJ/mol | ||
| Standard molar entropy S |
219.32 J K−1·mol−1 | ||
| المخاطر | |||
تبويب الاتحاد الاوروپي (DSD)
|
Extremely flammable (F+) | ||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | -136 °C | ||
| مركبات ذا علاقة | |||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
الإثيلين أو الإيثين هو أبسط الألكينات الهيدروكربونية، يتكون من ذرتى كربون، وأربعة ذرات هيدروجين. وتوجد رابطة مزدوجة بين ذرتي الكربون. ونظرا لوجود هذه الرابطة فإن الإيثين يطلق عليه "هيدروكربون غير مشبع" أو "أولفين".
ولا يمكن لجزيء الإثيلين أن يلف حول الرابظة المزدوجة، وجميع الذارات تقع في نفس المستوي. الزاوية رابطتين من روابط كربون-هيدروجين تقيبا 117°، وهى قريبة للغاية من 120° التى يمكن توقعها من التهجين sp2.
تعريف
الإتلين ethylene فحم هدروجيني صيغته ((C2H4، وهو الحد الأول في سلسلة الألكنات أو الأولفينات، ويحتوي على رابطة مزدوجة بين ذرتي الكربون CH2= CH2 وتجعل منه فعاليته - التي تعزى إلى صفة عدم الإشباع - المنتج الرئيسي في البتروكيمياء
التسمية
منذ عام 1795، يرجع للإثيلين على أنه "غاز منتج للوقود"، لأنه عندما يرتبط مع الكلور لينتج "زيت الكيميائي الهولندي" (2،1-ثنائي كلور ميثان)، والذى تم تصنيعه لأول مرة عام 1795 بتعاون أربعة كيميائين هولنديين.
وفى منتصف القرن التاسع عشر، بدأ استخدام اللاحقة "ين" (لها أصل إغريقي وهى لاحقة تضاف في نهاية أسمائ الإناث وتعنى "ابنة ") بكثرة لترجع إلة جزيء أو جزء منه يحتوى على عدد ذرات هيديوجين أقل من الجزيء قبل إضافة اللاحقة. وعلى هذا، جزيئات "الإثيلين" (C2H4) "ابنة للإيثيل" (C2H5). وكان يستخدم الإسم بهذه الطريقة منذ 1852.
وفى عام 1866، إقترح الكيميائي الألماني أغسطس فون هوفمان نظام لتسمية الهيدروكربونات بإستخدام اللاحقات : -انو –ين، -اين، -ون، -يون لتمييز الهيدروكربونات التى لها صفر، 2، 4، 6، 8 ذرات كربون أقل من أصلها األكاني. وفى هذا النظام، أصبح الإثيلين "إيثين". وأصبح النظام الذى إقترحه هوفمان الأساس "لتسمية جينيف التى تم الموافقة عليها من "مؤتمر الكيماء الدولي" عام 1892، والتى ظلت القلب لتسمية IUPAC. وعموما، فإنه بحلول هذا الوقت أصبح الإسم إثيلين منتشر بكثرة، وظل بهذا الإنتشار إلى اليوم، وخاصة في الصناعات الكيميائية.
خواصه الفيزيائية
الإتلين غاز في الحالة الطبيعية لا يتسيل إلا عند الدرجة -104ْس، وهو قليل السمية، يسبب استنشاقه نوماً عميقاً، لذلك يعطى في العمليات الجراحية القصيرة الأمد ممزوجاً بالهواء أو الأكسجين. تنفجر مزائجه بالهواء، عندما تراوح نسبته فيها بين 3٪ و34٪، معطية غاز الكربون وبخار الماء، لذلك يُعد خطراً في الأماكن المغلقة ولاسيما بحضور الأدوات الحارة أو الأجهزة الكهربائية المعرضة لإطلاق الشرر. وهو يُسرعُ نضج الفواكه لذلك يستعمل تجارياً في مخازن الفواكه.
كيمياء الإثيلين
الرابطة المزدوجة هى منطقة كثافة إلكترونية عالية قليلا، ومعظم كيمياء الإثيلين تتضمن تفاعل الجزيئات الأخرى مع هذه الرابطة. فمثلا يتفاعل الإثيلين مع البروم، الكلور، والهالوجينا تالأخرى، لينتج هيدروكربونات مهلجنة. ويمكن للإثيلين أيضا أن يتفاعل مع الماء لينتج الإيثانول ولكن معدل هذا التفاعل يكون بطيئ للغاية ما لم يستخدم حفاز مناسب مثل حمض الفوسفوريك، أو حمض الكبريتيك. وتحت الضغط العالي، وفى وجود عامل حفز فلزي مثل (البلاتين، الروديوم، النيكل)، يتفاعل الهيدروجين مع الإثيلين، ليحدث له تشبع. تنفتح الرابطة المزدوجة الواقعة في مركز جزيء الإتلين بسهولة كبيرة لتضم جزيئات الأكسجين أو الكلور، أو لتضم جزيئات إتلين أخرى (التماثر) polymerization.
ويحصل أكسيد الإتلين (CH2)2O بأكسدة الإتيلين رأساً بالهواء أو بالأكسجين. وهو غاز عديم اللون، سهل التسيل، يتبخر في الدرجة 10.7ْس، وهو خطر التداول جداً لأنه يكون مزيجاً صاعقاً في الجو. وهو منتج وسطي عظيم الأهمية يستعمل مادةً أولية في الكثير من الطرائق التي تؤدي إلى نسق كامل من شتى المصنعات كمضادات التجمد والمنظفات والمذيبات والألياف النسيجية التركيبية والموائع الهدرولية للمكابح وناقلات الحركة وغيرها. ويكون الإتلين مع الكلور مركباً وسطياً هو ثنائي كلور الإتان أو كلور الإتلين C2H4Cl2 الذي يعطي كلور الفينيل CH2= CHCl، ويعد هذا الأخير أكثر المواد الأولية في صنع اللدائن أهمية كمتعدد كلور الفينيل (PVC) والراتنجات الفينيلية (الزجاج العازل أو البرانيق أو الجلود الاصطناعية).
يتحد الإتلين بسهولة ويسر بالبنزين C6H6 بحضور كلوريد الألمنيوم وسيطاً لإعطاء إتيل البنزن C6H5 - C2H5، ويعطي هذا بدوره الستيرين C6H5 ـ CH= CH2 بنزع الهدروجين، والستيرين ذو دور أساسي في صناعة المواد اللدنة (متعدد الستيرين polystyrene) والمطاط (مطاط البوتاديين).
يزداد ميل الإتلين يوماً بعد يوم ليحل محل الأستيلين نقطة انطلاق لكيمياء الأستالدهيد ((CH3- CHO والخلات acetates. وقد نافست إماهة الإتلين إلى الغول الإتيلي التخمر الغولي منافسة شديدة.
وتُصنف متماثرات الإتلين في نوعين مختلفين:
- متعدد الإتلين العالي الكثافة (0.96 تقريباً) والذي يُعرف بالمنخفض الضغط أيضاً لأنه يحصل بتفاعل وساطي في الضغط الجوي أو في ضغط قريب من الجوي، وهو يتألف من جزيئات مستقيمة ذات سلاسل طويلة تحوي 500-1000 ذرة كربون.
ويستعمل لقولبه الأشياء الحسنة المتانة والمقاومة للماء في حالة الغليان. وتتم القولبة بالبثق extrusion (القوارير، والصفيحات، والأنابيب، والأفلام والأكياس والكييسات للرزم والتغليف)، أو بالحقن injection (اللعب، وقطع السيارات، والأجهزة المنزلية والصحية)، أو بالانضغاط compression (الصفائح).
- متعدد الإتلين المنخفض الكثافة (0.93 تقريباً) والذي يُعرف بالعالي الضغط أيضاً لأنه يُماثَر في مفاعلات تعمل في ضغوط قد تبلغ عدة آلاف البارات، وقوامه سلسلة طويلة متفرعة تتألف من 800 إلى 2500 ذرة كربون، وهو أكثر ليونة وأقل مقاومة للحرارة من النمط العالي الكثافة، ويتيح بالقولبة الحصول على أشياء متعددة كثيرة الاستهلاك في المنازل أو الصناعات.
بلغ الإنتاج العالمي لمتعدد الإتلين رتبة الخمسة ملايين طن عام 1970، ثم تجاوز إنتاجه إنتاج متعدد كلور الفينيل. كما بلغ إنتاج الولايات المتحدة في عام 1977 من متعدد الإتلين المنخفض الكثافة 2935000 طناً، واستهلك من متعدد الإتلين العالي الكثافة 1657000 طناً.
التخزين والنقل
يتطلب تنوع استعمال الإتلين وانخفاض سعر تكلفته وحدات تكسير ببخار الماء عملاقة قادرة على أن ينتج كل منها 500000 طناً من الإتلين في العام. وقد استكملت عدة تقنيات لتخزين هذا الغاز في الحالة السائلة:
- خزان الضغط، وهو مكلف جداً لما يتطلبه من أوعية فولاذية ثخينة الجدران، لذلك لا يلجأ إليه إلا لتخزين مقادير صغيرة في المعمل.
- خزان الضغط الجوي، وفيه يحصل العزل الحراري الضروري لتجنب التبخر بغلاف مزدوج يصنع جداره الداخلي من سبيكة خليطة بالنيكل أو الألومنيوم، ويصنع الجدار الخارجي من الفولاذ أو الخرسانة، أما العازل الوسطي فهو من أسفنج متعدد الأورتان.
- الخزن القري في أرض مجمدة: لما كان الإتلين سائلاً في نقطة غليانه (-104ْس) فإن تبريده لجدران كهف التخزين يكفي لضمان عدم تسربه.
- الخزن في الملح، وقوامه إيجاد مكمن ملح على عمق يزيد على 250م، فيجوف ويُملأ بعد ذلك يالإتلين السائل.
ويتم نقل الإتلين بالقاطرة والشاحنة والسفينة، علماً بأن نقله بالأنابيب يزداد يوماً بعد يوم؛ وقد أخذت تنتشر في أوروبا والولايات المتحدة شبكات تصل ما بين منتجي مختلف المناطق.
منشأ الإتلين
يوجد الإتلين بكميات ضئيلة في غازات الأفران العالية ومصانع الكوك، وقد حصل عليه بادئ الأمر بتسخين مزيج من الغول الإتيلي وحمض الكبريت المركز إلى الدرجة 160ْس. وحددت خواصه بعد اكتشافه في غازات الأفران العالية.
أخذ الإتلين في الأربعين سنة الأخيرة مكاناً مرموقاً بين أكثر صناعات تكرير النفط أهمية، إذ يحصل عليه بالتحلل الحراري (التكسير في درجة حرارة مرتفعة من غير وسيط) للغاز والبنزين (الغازولين) وحتى للمازوت (الغازويل)؛ كما يحصل عليه بالتكسير البخاري. ولما كان المادة الأولية المتزايدة النصيب في الصناعة الكيمياوية وفي صناعة اللدائن، فقد غدا ممكناً نقله من المصافي إلى معامل التحويل بخطوط السكك الحديدية أو الشاحنات أو السفن أو بخطوط الأنابيب، وغدا يُخزن بكميات كبيرة لمجابهة زيادة الإنتاج ولدعم التوزيع والاستهلاك.
إنتاج الإيثيلين
يتم إنتاج الإثيلين في الصناعات البتروكيماوية خلال تكسير البخار. وفى هذه العملية، يتم تسخين الهيدروكربونات الغازية أو السائلة الخفيفة يتم تسخينها من 750 إلى 950 C °، ويسبب هذا تكول أعداد هائلة من الجذور الحرة. وبصفة عامة، أثناء حدوث هذه التفاعلات، تتكسر الهيدروكربونات الكبيرة لهيدروكربونات أصغر وتصبح الهيدروكربونات المشبعة غير مشبعة.
وناتج هذه العملية يكون خليط معقد من الهيدروكربونات ويكون الإثيلين مكون رئيسي فيها. ويتم فصل مكونات هذا الخليط عن طريق الضغط والتقطير المتكرر.
إستخدامات الإيثيلين
في الكيمياء: يستخدم الإثيلين أساسا كمركب وسيط في إنتاج الكيماويات الأخرى، وخاصة اللدائن. ويمكن أن تتم بلمرة الإثيلين مبتشرة لإنتاج البولي إثيلين (يطلق عليه أيضا "بولي إيثين" أو "بولي ثين")، وهو أكثر اللدائن إستخداما في العالم. ويمكن أيضا كلورة الإثيلين لإنتاج 2،1-ثنائي كلورو إيثان، وهو أساس تصنيع البولي فينيل كلوريد، أو يمكن للإثيلين أن يتحد مع البنزين لإنتاج إيثيل بنزين، والذى يستخدم لتصنيع البولي ستيرين، وهو أيضا أحد اللدائن المهمة.
كما أنه يمكن أكسدة كميات قليلة من الإثيلين لإنتاج كيماويات أخرى منها أكسيد الإثيلين، إيثانول، بولي فينيل خلات.
كما يستخدم الإيثيلين بتوسع كمبرد في أنظمة التبريد التجارية نظرا لإنخفاض نقطة غليانه.
في الأحياء كان الإثيلين يستخدم كمخدر، ولكن تم إستبداله الآن بمواد أخرى غير قابلة للإشتعال.
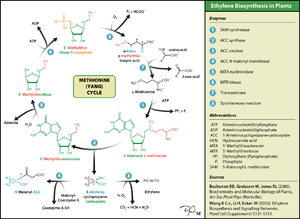
الإثيلين من أحد هرمونات النبات المهمة. كما يستخدم كميات قليلة من الإثيلين في الزراعة لإنضاج الفاكهة التى تم قطفها. وقد بدأ تصنيعه حيويا من الميثيونين مع 1-أمينو بروبان حلقي-1-حمض كربوكسيليك (AAC 1-aminocyclopropane-1-carboxylic acid). شاهد إثيلين (هرمون نبات)
المصادر
- ^ قالب:GESTIS
- ^ أ ب ت Нейланд О. Я. Органическая химия: Учебник для хим. спец. вузов.— Москва: Высшая школа, 1990.— с. 128
Appendix: ethylene production facilities
- Fort Saskatchewan, Fort Saskatchewan, (Dow Chemical
- Joffre, Joffre, (Dow Chemical and Nova Chemicals), 2165 kta ethylene
- Sarnia, Sarnia, (Nova Chemicals),
- Hahnville, Hahnville, (Dow Chemical),
- Lake Charles, Lake Charles, (Westlake Chemical),
- Norco, Norco, (Shell Chemical), 1500 kta ethylene
- Alvin, Alvin, (Ineos),
- Corpus Christi, Corpus Christi, (LyondellBasell),
- Deer Park, Deer Park, (Shell Chemical), 1200 kta ethylene
- Orange, Orange, (DuPont),
- Port Arthur, Port Arthur, (BASF and Total Petrochemical),
Nanhai, China
- Nanhai, Nanhai, (Shell Chemical), not available kta ethylene
Ras Laffan Industrial City, Qatar
- Ras Laffan Industrial City, Ras Laffan Industrial City, (QAPCO), 1300 kta ethylene
- Channelview, Channelview, (LyondellBasell), 1450 kta ethylene
- National Iranian Petrochemical Company, 1320 kta ethylene
- Baytown, (Chevron Chemicals Company), Cedar Bayou Plant, not available kta ethylene
قراءات أخرى
Ethylene hormone receptor action in Arabidopsis. Chang C, Stadler R. Bioessays. 2001 Jul;23(7):619-27. Review. PMID 11462215
Differential petiole growth in Arabidopsis thaliana: photocontrol and hormonal regulation. Millenaar FF, van Zanten M, Cox MC, Pierik R, Voesenek LA, Peeters AJ. New Phytol. 2009 Jun 24. [Epub ahead of print] PMID 19558423
وصلات خارجية
- Pages using Chembox with unknown parameters
- ECHA InfoCard ID from Wikidata
- Articles with changed KEGG identifier
- Articles with unsourced statements from May 2011
- Chemical articles with unknown parameter in Chembox
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Short description is different from Wikidata
- مقالات مختارة في de
- ألكينات
- هرمونات نباتية
- مونومرات
- أدوية تخدير عام
- كيماويات سلعية