أزيد الصوديوم
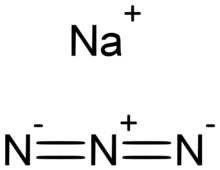
| |
| |
| الأسماء | |
|---|---|
| أسماء أخرى
Sodium trinitride
Smite | |
| المُعرِّفات | |
| رقم CAS | |
| ECHA InfoCard | 100.043.487 |
| رقم EC |
|
| رقم RTECS |
|
| UN number | 1687 |
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | NaN3 |
| كتلة مولية | 65.0099 g/mol |
| المظهر | white solid |
| الرائحة | odorless |
| الكثافة | 1.846 g/cm3 (20 °C) |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | 41.7 g/100 mL (17 °C) |
| قابلية الذوبان في alcohol | 0.316 g/100 mL (16 °C) |
| قابلية الذوبان في ammonia | soluble |
| البنية | |
| البنية البلورية | Hexagonal, hR12[1] |
| الزمرة الفراغية | R-3m, No. 166 |
| المخاطر | |
تبويب الاتحاد الاوروپي (DSD)
|
Highly toxic (T+) Dangerous for the environment (N) |
| توصيف المخاطر | R28, R32, R50/53 |
| تحذيرات وقائية | (S1/2), S28, S45, S60, S61 |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | 300 °C |
| الجرعة أو التركيز القاتل (LD, LC): | |
LD50 (الجرعة الوسطى)
|
27 mg/kg (oral, rats/mice)[1] |
| مركبات ذا علاقة | |
كاتيونات أخرى
|
أزيد البوتاسيوم |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
أزيد الصوديوم هو مركب كيميائي له الصيغة NaN3، ويكون على شكل مسحوق بلوري أبيض، ينحل بالماء بشكل جيد، لكنه بالكاد ينحل بالإيثانول، وهو غير منحل في ثنائي إيثيل الإيثر،
ومحاليله في الماء قلوية.
التحضير
يتم الحصول على أزيد الصوديوم بمردود جيد من تفاعل أميد الصوديوم مع غاز الضحك (أكسيد النتروس).
+
الخواص
يتفكك أزيد الصوديوم عند درجات حرارة أعلى من 300°س إلى الصوديوم وغاز النيتروجين حسب المعادلة:
وعلى أساس هذا التفاعل يعتمد عمل الوسائد الهوائية (Airbags) في السيارات (انظر ← الاستخدامات)
الاستخدامات
- له تطبيق مهم في الوسائد الهوائية للسيارات.
يعتمد عمل الوسادة الهوائية من وجهة نظر كيميائية على ثلاثة مكونات رئيسية
- أزيد الصوديوم NaN3
- نترات البوتاسيوم KNO3
- ثاني أكسيد السيليكون SiO2
لحظة حدوث التصادم يتم إشعال أزيد الصوديوم كهربائياً حيث يتقكك بشكل متفجر مولداً غاز النيتروجين خلال ما يقارب 40 ميلي ثانية فيملأ بالتالي كيس البولي أميد فينتفخ بسرعة.
أكثر من ذلك فإن الصوديوم الناتج يتفاعل مع نيترات البوتاسيوم المتواجدة في الكيس فيعطي أكسيد الصوديوم وأكسيد البوتاسيوم بالإضافة إلى كمية أخرى من غاز النيتروجين
أكسيدا المعدنين القلويين يتفاعلان بالنهاية مع أكسيد السيليكون ليعطي السيليكات الموافقة.
المصادر
- Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
- [1]
