ألدهيد
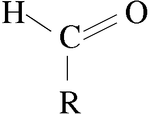
الألدهيد Aldehyde هو مركب عضوي يحوي زمرة وظيفية كربونيلية مع بديل واحد، فتكون الصيغة العامة للألدهيدات R-CHO، وبهذا يتميز عن الكيتونات التي تحوي بديلين. ويمثل R في الصيغة ذرة هيدروجين أو جذراً ألكيلياً. وتسمى الألدهيدات باسم الألكان الموافق لها مع اضافة المقطع "ال" في نهاية الاسم.
الألدهايد مجموعة من المركبات الكيميائية العضوية المهمة تستخدم في العديد من المنتجات الصناعية. ويعتبر الفورمالدهيد والفيرفورألدهايد من الألدهيدات. وتستخدم في صناعة اللدائن (البلاستيك). وتأتي نكهة الفانيليا الصناعية من الڤانيلين، وهو من الألدهيدات. والصيغة العامة للألدهايدات هي RCHO، حيث تمثل R مجموعات الكربون الأخرى. فمثلاً الرمز الكيميائي للأستالدهيد هو CH3CHO. تتميز الألدهيدات بوجود مجموعة الكاربونيل {C=O}. يمكن إنتاج الألدهيد بالأكسدة البطيئة للكحول، إذ إن المزيد من الأكسدة ينتج حمضاً.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التسمية
أسماء أيوپاك للألدهيدات
أيوپاك تحدد المسميات التالية للألدهيدات:[1][2][3]
- Acyclic aliphatic aldehydes are named as derivatives of the longest carbon chain containing the aldehyde group. Thus, HCHO is named as a derivative of methane, and CH3CH2CH2CHO is named as a derivative of butane. The name is formed by changing the suffix -e of the parent alkane to -al, so that HCHO is named methanal, and CH3CH2CH2CHO is named butanal.
- In other cases, such as when a -CHO group is attached to a ring, the suffix -carbaldehyde may be used. Thus, C6H11CHO is known as cyclohexanecarbaldehyde. If the presence of another functional group demands the use of a suffix, the aldehyde group is named with the prefix formyl-. This prefix is preferred to methanoyl-.
- If the compound is a natural product or a carboxylic acid, the prefix oxo- may be used to indicate which carbon atom is part of the aldehyde group; for example, CHOCH2COOH is named 3-oxopropanoic acid.
- If replacing the aldehyde group with a carboxyl (-COOH) group would yield a carboxylic acid with a trivial name, the aldehyde يمكن أن يـُسمى بإحلال اللاحقة حمض ...-يك أو حمض ...-ويك في هذا الاسم البسيط باللاحقة -الدهايد. فعلى سبيل المثال:
- HCHO يمكن أن تسمى formaldehyde.
- CH3CHO يمكن أن تسمى acetaldehyde.
- C6H5CHO يمكن أن تسمى benzaldehyde.
الاستخدام والتواجد
Important aldehydes and related compounds. The aldehyde group (or formyl group) is colored red. From the left: (1) formaldehyde and (2) its trimer 1,3,5-trioxane, (3) acetaldehyde and (4) its enol vinyl alcohol, (5) glucose (pyranose form as α-D-glucopyranose), (6) the flavorant cinnamaldehyde, (7) the visual pigment retinal, and (8) the vitamin pyridoxal.
الألدهيدات المتواجدة طبيعيا
Traces of many aldehydes are found in essential oils and often contribute to their favorable odors, e.g. cinnamaldehyde, cilantro, and vanillin. Possibly because of the high reactivity of the formyl group, aldehydes are not common in several of the natural building blocks: amino acids, nucleic acids, lipids. Most sugars, however, are derivatives of aldehydes. These aldoses exist as hemiacetals, a sort of masked form of the parent aldehyde. For example, in aqueous solution only a tiny fraction of glucose exists as the aldehyde.
التخليق
هناك عدة طرق لتحضير الألدهيدات:
الوسائل الخاصة
| اسم التفاعل | Substrate | تعليق |
|---|---|---|
| Ozonolysis | Alkenes | Ozonolysis of non-fully-substituted alkenes yield aldehydes upon a reductive work-up. |
| اختزال عضوي | Esters | Reduction of an ester with diisobutylaluminium hydride (DIBAL-H) or sodium aluminium hydride. |
| Rosenmund reaction | Acyl chlorides | Acyl chlorides selectively reduced to aldehydes. Lithium tri-t-butoxyaluminium hydride (LiAlH(OtBu)3) is an effective reagent.[بحاجة لمصدر] |
| Wittig reaction | Ketones | A modified Wittig reaction using methoxymethylenetriphenylphosphine as a reagent. |
| Formylation reactions | Nucleophilic arenes | Various reactions, for example the Vilsmeier-Haack reaction. |
| Nef reaction | Nitro compounds | The acid hydrolysis of a primary nitro compound to form an aldehyde. |
| Kornblum oxidation | Haloalkanes | The oxidation of primary halide with dimethyl sulfoxide to form an aldehyde. |
| Zincke reaction | Pyridines | Zincke aldehydes formed in a reaction variation. |
| Stephen aldehyde synthesis | Nitriles | Hydrolysis of an iminium salt generated by tin(II) chloride and HCl to form an aldehyde. |
| Geminal halide hydrolysis | Geminal dihalides | Hydrolysis of primary geminal dihalides to yield aldehydes. |
| Meyers synthesis | Oxazines | Hemiaminal oxazine hydrolysis with water and oxalic acid to yield an aldehyde. |
| Hofmann rearrangement variation[4][5] | unsaturated or α-hydroxy amides | Aldehydes via the hydrolysis of an intermediate carbamate. |
| McFadyen-Stevens reaction | Hydrazides | Base-catalyzed thermal decomposition of acylsulfonylhydrazides. |
| Biotransformation | Alkenes | Lyophilized cell cultures of Trametes hirsuta in the presence of oxygen.[6] |
التفاعلات الشائعة
تفاعل ثنائي الكبريتيت
Aldehydes characteristically form "addition compounds" with sodium bisulfite:
- RCHO + HSO−3 → RCH(OH)SO−3
This reaction is used as a test for aldehydes.[7]
تفاعلات أكثر تعقيداً
| Reaction name | Product | Comment |
|---|---|---|
| Wolff–Kishner reduction | Alkane | If an aldehyde is converted to a simple hydrazone (RCH=NHNH2) and this is heated with a base such as KOH, the terminal carbon is fully reduced to a methyl group. The Wolff–Kishner reaction may be performed as a one-pot reaction, giving the overall conversion RCH=O → RCH3. |
| Pinacol coupling reaction | Diol | With reducing agents such as magnesium |
| Wittig reaction | Alkene | Reagent: an ylide |
| Takai reaction | Alkene | Diorganochromium reagent |
| Corey–Fuchs reactions | Alkyne | Phosphine-dibromomethylene reagent |
| Ohira–Bestmann reaction | Alkyne | Reagent: dimethyl (diazomethyl)phosphonate |
| Johnson–Corey–Chaykovsky reaction | Epoxide | Reagent: a sulfonium ylide |
| Oxo-Diels–Alder reaction | Pyran | Aldehydes can, typically in the presence of suitable catalysts, serve as partners in cycloaddition reactions. The aldehyde serves as the dienophile component, giving a pyran or related compound. |
| Hydroacylation | Ketone | In hydroacylation an aldehyde is added over an unsaturated bond to form a ketone. |
| decarbonylation | Alkane | Catalysed by transition metals |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
أمثلة للألدهيدات
- مثانال (فورمالدهيد)
- إثانال (أسيتالدهيد)
- پروپانال (پروپيونالدهيد)
- بيوتانال (بيوتيرألدهيد)
- بنزالدهيد
- سينامالدهيد
- تولوألدهيد
أمثلة ألدهيدات ثنائية
مركبات ذات علاقة
تحتوي أنواع أخرى من المركبات العضوية على المجموعة الكربونيلية، ومنها:
المصادر
- ^ Short Summary of IUPAC Nomenclature of Organic Compounds, web page, University of Wisconsin Colleges, accessed on line August 4, 2007.
- ^ §R-5.6.1, Aldehydes, thioaldehydes, and their analogues, A Guide to IUPAC Nomenclature of Organic Compounds: recommendations 1993, IUPAC, Commission on Nomenclature of Organic Chemistry, Blackwell Scientific, 1993.
- ^ §R-5.7.1, Carboxylic acids, A Guide to IUPAC Nomenclature of Organic Compounds: recommendations 1993, IUPAC, Commission on Nomenclature of Organic Chemistry, Blackwell Scientific, 1993.
- ^ Weerman, R.A. (1913). "Einwirkung von Natriumhypochlorit auf Amide ungesättigter Säuren". Justus Liebigs Annalen der Chemie. 401 (1): 1–20. doi:10.1002/jlac.19134010102.
- ^ Everett, Wallis; Lane, John (1946). "The Hofmann Reaction". Organic Reactions. 3 (7): 267–306. doi:10.1002/0471264180.or003.07. ISBN 9780471005285.
- ^ Sutton, Peter; Whittall, John (2012). Practical Methods for Biocatalysis and Biotransformations 2. Chichester, West Sussex: John Wiley & Sons, Ltd. pp. 199–202. ISBN 9781119991397.
- ^ Shriner, R. L.; Hermann, C. K. F.; Morrill, T. C.; Curtin, D. Y.; Fuson, R. C. (1997). The Systematic Identification of Organic Compounds. John Wiley & Sons. ISBN 0-471-59748-1.
وصلات خارجية
- Aldehyde synthesis – Synthetic protocols from organic-reaction.com