بنزالدهيد
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
بنزالدهيد
| |||
| اسم أيوپاك النظامي
Benzenecarbaldehyde Phenylmethanal | |||
| أسماء أخرى
Benzoic aldehyde
| |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.002.601 | ||
| KEGG | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | C7H6O | ||
| كتلة مولية | 106.12 g mol-1 | ||
| المظهر | عديم اللون أو سائل أصفر يتفتت بقوة | ||
| الرائحة | شبيه باللوز | ||
| الكثافة | 1.0415 گ/مل، سائل | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | 0.3 گ/100 مل (20 °س)[1] | ||
| قابلية الذوبان | يذوب في سائل الأمونيا | ||
| قابلية الذوبان | .695 گ/100 مل | ||
| log P | 1.48 | ||
| الحموضة (pKa) | 14.90 | ||
| معامل الانكسار (nD) | 1.5456 | ||
| اللزوجة | 1.321 cP (25 °س) | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
−36.8 كج/مول | ||
| الانتالبية المعيارية للاحتراق ΔcH |
−3525.1 كج/مل | ||
| المخاطر | |||
تبويب الاتحاد الاوروپي (DSD)
|
مضر (Xn) | ||
| توصيف المخاطر | R22 | ||
| تحذيرات وقائية | (S2), S24 | ||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | 64 °C (147 °F; 337 K) | ||
| 192 °C (378 °F; 465 K) | |||
| حدود الانفجار | 1.4-8.5% | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
1300 mg/kg (rat, oral) | ||
| مركبات ذا علاقة | |||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
البنزالدهيد Benzaldehyde (C6H5CHO)، هو مركب عضوي يتكون من حلقة بنزين ومجموعة فورميل معوضة. وهو أبسط الألديهيدات العطرية وأكثرها فائدة في المجالات الصناعية. لهذا السائل عديم اللون رائحة مميزة تشبه رائحة اللوز، وفي الواقع فإن البنزالدهيد هو المركب الأساسي في زيت اللوز المر، ويمكن استخلاصه من عدد من المصادر الطبيعية الأخرى.
الانتاج
استخلص البنزالدهيد من اللوز المر سنة 1803 على يد الصيدلاني الفرنسي مارتيرز، وفي سنة 1832 تمكن الكيميائيان الألمانيان فريدرش فولر ويوستوس فون ليبيگ من تصنيع البنزالدهيد لأول مرة.
التواجد
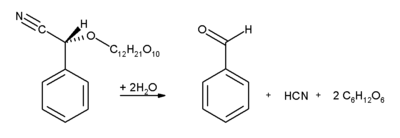
يحتوي اللوز والمشمش والتفاح ونواة الكرز على كميات جيدة من الأميگدالين، ويتكسر هذا الگليكوزيد بتحفيز إنزيمي إلى بنزالدهيد وسيانيد الهيدروجين وجزيئتي جلوكوز.
التفاعلات
يتأكسد البنزالدهيد إلى حمض البنزويك عديم الرائحة وهو شائبة شائعة في النماذج المختبرية. ويمكن تحضير كحول البنزيل عن طريق هدرجة البنزالدهيد. وينتج حمض السيناميك من تفاعل البنزالدهيد مع خلات الصوديوم اللامائية وأنهدريد الخليك، بينما يستخدم سيانيد البوتاسيوم الكحولي لتحفيز تفاعل تكاثف البنزالدهيد إلى البنزوين. يتفاعل البنزالدهيد بشكل غير متكافئ عند معاملته بقلوي مركز تفاعل كانيزارو حيث تختزل إحدى جزيئتي الألديهيد إلى الكحول المقابل، وتتأكسد الجزيئة الأخرى في نفس اللحظة إلى بنزوات الصوديوم.
الاستخدامات
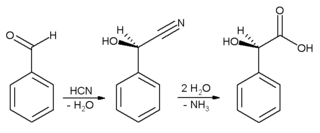
عادة ما يستخدم للحصول على نكهة اللوز. يستخدم البنزالدهيد بشكل رئيسي كمركب طليعي لمركبات عضوية أخرى، تتنوع من الأدوية إلى إضافات اللدائن. يحضر صباغ الملكيت الأخضر الأنيليني من البنزالدهيد وثنائي ميثيل الأنيلين. وهو أيضاً مركب طليعي لبعض صبغات الأسريدين. عن طريق التكاثفات الألدولية، يتحول البنزالدهيد إلى مشتقات السينامالديهيد والستايرين. تحضير حمض المندليك يبدأ من البنزالدهيد:
الأمان
تم تصنيف البنزالديهد كمادة خطرة من قبل الوكالة الأمريكية لحماية البيئة.[2]
يستخدم البنزالدهيد كمادة منهكة ومعطرة في الأغذية، مستحضرات التجميل، الأدوية والصابون و"يعتبر آمن عموماً" (GRAS) حسب ادارة الغذاء والدواء.[3]
المصادر
- ^ "GESTIS Substance database". Institute for Occupational Safety and Health of the German Social Accident Insurance. Retrieved 21 August 2012.
- ^ http://www.epa.gov/iris/subst/0332.htm
- ^ Friedrich Brühne; Elaine Wright (2007), "Benzaldehyde", Ullmann's Encyclopedia of Industrial Chemistry (7th ed.), Wiley, p. 11