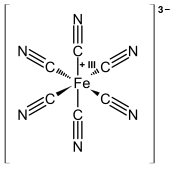
أزرق پروسيا

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
حديد(II,III) سداسي سيانيد الحديد(II,III)
| |
أسماء أخرى
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.034.418 |
| رقم EC |
|
| مرجع Gmelin | 1093743 |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | C18Fe7N18 |
| كتلة مولية | 859.23 g mol-1 |
| المظهر | بلورات زرقاء غير شفافة |
| قابلية الذوبان في الماء | غير قابل للانحلال |
| البنية | |
| البنية البلورية | مكعب مركزي السطوح، cF43 |
| الزمرة الفراغية | Fm3m, No. 225[1] |
| علم الأدوية | |
| V03AB31 (WHO) | |
| طرق التناول |
عن طريق الفم |
| المخاطر | |
| صفحة بيانات السلامة | MSDS Prussian blue |
| مركبات ذا علاقة | |
كاتيونات أخرى
|
حديدوسيانيد الپوتاسيوم |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
أزرق پروسيا إنگليزية: Prussian blue (يُعرف أيضاً باسم أزرق برلين أو أزرق براندنبورگ أو في الرسم، أزرق پاريس) هو خضاب أزرق داكن ينتج عن أكسدة أملاح الحديدوز حديدوسيانيد. صيغته الكيميائية FeIII4[FeII (CN) 6] 3. يتطابق أزرق تورنبول كيميائياً مع أزرق پروسيا، ولكنه مصنوع من كاشف كيميائي مختلف، كما يختلف لونه قليلاً بسبب الشوائب وأحجام الجزيئات المختلفة.
أزرق پروسيا هو أول صبغة اصطناعية حديثة. يُحضَّر على شكل تبديد غرواني دقيق للغاية، لأن المركب غير قابل للانحلال في الماء. يحتوي على كميات متغيرة[2] من الأيونات الأخرى ويعتمد مظهرها بشكل حساس على حجم الجسيمات الغروانية. تُستخدم الصبغة في الطلاء، وهي "الأزرق" التقليدي في الطبعات الزرقاء، وأصبحت بارزة في الطباعة بالقوالب الخشبية في اليابان في القرن التاسع عشر aizuri-e (藍摺り絵)
في الطب، يُستخدم أزرق پروسيا الذي يُتناول عن طريق الفم باعتباره ترياق لأنواع معينة من التسمم بالفلزات الثقيلة، على سبيل المثال، بواسطة الثاليوم (I) والنظائر المشعة للسيزيوم. كما يستغل العلاج خصائص التبادل الأيوني للمركب والتقارب العالي لبعض الكاتيونات المعدنية " اللينة".
أزرق پروسيا مدرج في قائمة الأدوية الأساسية حسب منظمة الصحة العالمية، وهو أهم الأدوية اللازمة في نظام الرعاية الصحية.[3] اتُخذ أزرق پروسيا اسمه إلى الحمض الپروسي (سيانيد الهيدروجين) المشتق منه. في الألمانية، يُطلق على سيانيد الهيدروجين اسم Blausäure ("الحمض الأزرق"). أعطى الكيميائي الفرنسي جوزيف لوي گي-لوساك السيانيد اسمه من كلمة اليونانية القديمة κύανος (kyanos, 'blue'/'cyan')، بسبب لونه الأزرق الپروسي.
تاريخ
صباغ أزرق پروسيا مهم لأنه كان أول خضاب أزرق مستقر نسبياً وثابت ضوئياً استُخدم على نطاق واسع بسبب قلة المعرفة بتركيب الأزرق المصري. كما استخدم الرسامون الأوروبيون في السابق عدداً من الأصباغ مثل صبغة النيلة، وسمالت، وأرجوان صور، وألترامارين المصنوع من اللازورد. بالمثل الرسامون اليابانيون و فنانو الطباعة الخشبية، لم يكن لديهم إمكانية الوصول إلى صبغة زرقاء طويلة الأمد حتى بدأوا في استيراد أزرق پروسيا من أوروبا.[4]
صُنع أزرق پروسيا Fe 7(CN) 18 (أيضاً (Fe 4[Fe(CN) 6] 3) · xH 2O) على الأرجح لأول مرة بواسطة صانع الطلاء يوهان جيكوب ديسباخ في برلين حوالي عام 1706.[5][6] يُعتقد أن الصباغ تم إنشاؤه عن طريق الخطأ عندما استخدم ديسباخ ملح القلي الملطخ بـ الدم لإنشاء الصبغة الحمراء القرمزية. تتطلب الصبغة الأصلية ملح القلي، كبريتات الحديد والدود القرمزي المجفف. بدلاً من ذلك، تفاعل الدم وملح القلي وكبريتات الحديد لتكوين مركب يعرف باسم حديدوسيانيد الحديد، والذي، على عكس الصبغة الحمراء المرغوبة، فقد تمتع بلون أزرق مميز للغاية.[7]كما سُمي Preußisch blau وBerlinisch Blau في عام 1709 من قبل تاجرها الأول.[8]
استُبدل اللازورد الغالي الثمن المشتق من ألترامارين بالصباغ الجديد وكان موضوعاً مهماً في الرسائل المتبادلة بين يوهان ليونارد فريش ورئيس الأكاديمية الپروسية للعلوم، گوتفريد لايبنتس، بين 1708 و1716.[8]كما ذُكر الصباغ لأول مرة في رسالة كتبها فريش إلى لايبنتس في 31 مارس 1708. في موعد لا يتجاوز عام 1708، بدأ فريش في الترويج للصباغ وبيعها في جميع أنحاء أوروبا. بحلول أغسطس 1709، سُمي الصباغ Preussisch blau؛ بحلول نوفمبر 1709، استُخدم فريش الاسم الألماني Berlinisch Blau لأول مرة. فريش نفسه هو مؤلف أول منشور معروف لأزرق پروسيا في الورقة البحثية Notitia Coerulei Berolinensis nuper inventi في عام 1710، كما يمكن استنتاجه من رسائله. كان ديسباخ يعمل لدى فريش منذ حوالي عام 1701.
حتى الآن، يعد عمل قبر المسيح، بتاريخ 1709 من قبل پيتر ڤان در ڤرڤ (معرض، سانسوسي، پوتسدام) أقدم لوحة معروفة حيث استُخدم أزرق پروسيا. حوالي عام 1710، كان الرسامون في البلاط الپروسي يستخدمون الصبغة بالفعل. في نفس الوقت تقريباً، وصل أزرق پروسيا إلى باريس، حيث استخدمه أنطوان واتو وبعد ذلك خلفاؤه نيكولا لانكره وجان باپتيست پاتر في لوحاتهم.[5][9]كما استخدم فرانسوا بوشيه الصباغ على نطاق واسع لكل من الأزرق والأخضر.[10]
في عام 1731، نشر گيورگ إرنست شتال تقريراً للتركيب الأول لأزرق پروسيا.[11]لا تتضمن القصة ديسباخ فحسب، بل تشمل أيضاً يوهان كونراد ديپل. كان ديسباخ يحاول تكوين صبغة ترسيب حمراء من الدود القرمزي، لكنه حصل على اللون الأزرق بدلاً من ذلك نتيجة لملح القلي الملوث الذي كان يستخدمه. استعار ملح القلي من ديپل، الذي استخدمه لإنتاج زيت الحيوان. لا يوجد مصدر تاريخي معروف آخر يذكر ديپل في هذا السياق. لذلك، من الصعب الحكم على مصداقية هذه القصة اليوم. في عام 1724، نُشرت الوصفة أخيراً عن طريق جون وودوارد.[12][13][14]
في عام 1752، اتخذ الكيميائي الفرنسي بيير ماكيه خطوة مهمة تتمثل في إظهار إمكانية اختزال أزرق پروسيا إلى ملح من الحديد وحمض جديد، والذي يمكن استخدامه لإعادة تكوين الصبغة.[15]كما عُزل الحمض الجديد سيانيد الهيدروجين لأول مرة من أزرق پروسيا في شكل نقي وتميز عام 1782 بواسطة الكيميائي السويدي كارل ڤيلهلم شيله،[16]أُطلق عليه في النهاية الاسم Blausäure (حرفياً "الحمض الأزرق") بسبب اشتقاقه من لون أزرق پروسيا، وأصبح يُعرف في اللغة الإنگليزية شعبياً باسم حمض الپروسيك. السيانيد، أنيون عديم اللون يتشكل أثناء عملية صنع لون أزرق پروسيا، اشتق اسمه من الكلمة اليونانية التي تعني الأزرق الداكن.
في أواخر القرن التاسع عشر، قام الحاخام گيرشون هينوخ لاينر، زعيم ديني حسيدي الحسيدية رادزين، بصبغ شال الصلاة بلون أزرق پروسيا المصنوع من الحبار بني داكن، معتقدين أن هذه كانت الصبغة الحقيقية لشال الصلاة. على الرغم من أن البعض قد شكك في هويته على أنه شال صلاة بسبب إنتاجه الاصطناعي، وادعى أنه لو كان الحاخام لينر على علم بذلك لكان قد تراجع عن موقفه بأن صبغته كانت زرقاء،[17]وقد عارض آخرون هذا وادعوا أن الحاخام لينر لم يكن ليتراجع.[18]
منذ بداية القرن الثامن عشر، كان أزرق پروسيا هو لون المعطف السائد الذي ترتديه أفواج المشاة والمدفعية في جيش پروسيا.[19] كما Dunkelblau (الأزرق الداكن)، حققت هذه الدرجة من اللون أهمية رمزية واستمر في ارتدائه من قبل الجنود الألمان من أجل الاحتفالات الرسمية وفي مناسبات خارج الخدمة حتى اندلاع الحرب العالمية الأولى، عندما حل محله اللون الرمادي المخضر (Feldgrau).[20]
التحضير
ينتج أزرق پروسيا عن طريق أكسدة أملاح حديدوسيانيد الحديد. صيغة هذه المواد الصلبة البيضاء M 2Fe[Fe(CN) 6] حيث M+ = Na+ أو K+ . الحديد في هذه المادة هو كل شيء من الحديدوز، ومن ثم عدم وجود لون عميق مرتبط بالتكافؤ المختلط. ينتج عن أكسدة هذه المادة الصلبة البيضاء مع پروكسيد الهيدروجين أو كلورات الصوديوم الحديديسيانيد ويعطي أزرق پروسيا.[21]
يمكن تركيب الصيغة "القابلة للانحلال"، K[FeIIIFeII(CN) 6]، الغروانية في الواقع، يمكن أن تكون مصنوعة من حديدوسيانيد الپوتاسيوم والحديد (III):
- K+ + Fe3+ + [FeII(CN) 6]4− → KFeIII[FeII(CN) 6]
ينتج عن التفاعل المماثل لحديدوسيانيد الپوتاسيوم والحديد (II) نفس المحلول الغرواني، لأن المركب [FeIII(CN) 6]3− تم تحويله إلى حديدوسيانيد.
يُنتج أزرق پروسيا "الغير القابل للانحلال" إذا أُضيف فائض من Fe3+ :
- 4Fe3+ + 3[FeII(CN) 6]4− → FeIII[FeIIIFeII(CN) 6] 3 [22]
على الرغم من حقيقة أن المركب محضر من أملاح السيانيد، فإن أزرق پروسيا مادة غير سامة لأن مجموعات السيانيد مرابطة مع الحديد بقوة.[23] تُعتبر كلاً من حديدوسيانيد ((FeII(CN)6)4−) and حديديسيانيد ((FeIII(CN)6)3−) مركبات پوليمرية مستقرة وغير سامة بشكل خاص سيانومتالات بسبب التنسيق القوي للحديد مع أيونات السيانيد. على الرغم من ارتباط السيانيد جيداً بالمعادن الانتقالية بشكل عام مثل الكروم، فإن مركبات ربط الذرات غير الحديدية هذه ليست ثابتة مثل سيانيدات الحديد، وبالتالي تزيد من خطر إطلاق أيونات CN-، وبالتالي السمية النسبية.[24]
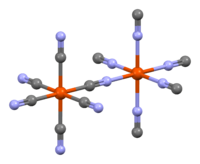
أزرق تورنبول
اعتُقد سابقاً أن إضافة أملاح الحديد (II) إلى محلول حديديسيانيد توفر مادة مختلفة عن أزرق پروسيا. سُمي تقليدياً باسم أزرق تورنبول (TB). وقد أظهرت طريقتا حيود الأشعة السينية وحيود الإلكترونات، مع ذلك، أن تركيبة PB وTB متطابقة.[25][26] تعكس الاختلافات في ألوان TB وPB اختلافات طفيفة في طرق الترسيب، والتي تؤثر بشدة على حجم الجسيمات ومحتوى الشوائب.
الخصائص
أزرق پروسيا هو مسحوق أزرق بلوري نانوي. غير قابل للانحلال، لكن البلوري منه يميل إلى تكوين مادة غروانية. يمكن أن تمر هذه الغرويات من خلال مرشحات دقيقة.[2] على الرغم من كونه أحد أقدم المركبات الاصطناعية المعروفة، إلا أن تكوين أزرق پروسيا بقي غير مؤكد لسنوات عديدة. كان تحديدها الدقيق معقداً بثلاثة عوامل:
- أزرق پروسيا غير قابل للانحلال، ولكنه يميل أيضاً إلى تكوين الغرويات
- تميل المركبات التقليدية إلى توفير تركيبات غير نقية
- حتى أزرق پروسيا النقي معقد من الناحية البنيوية، ويحتمل التحليل البلوري الروتيني
البنية البلورية
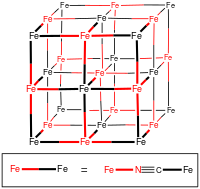

الصيغة الكيميائية لأزرق پروسيا غير القابل للانحلال هيFe 7(CN) 18 · xH 2O حيث x = 14–16. تم تحديد البنية باستخدام مطيافية الأشعة تحت الحمراء، مطيافية موسباور، دراسة البلورات بالأشعة السينية، ودراسة البلورات بالنيوترونات. نظراً لأن حيود الأشعة السينية لا يمكنه بسهولة التمييز بين الكربون والنيتروجين في وجود عناصر أثقل مثل الحديد، يتم استنتاج موقع هذه العناصر الأخف بوسائل التحليل الطيفي، وكذلك من خلال مراقبة المسافات من مراكز ذرات الحديد.
لأزرق پروسيا هيكل شبكي مكعب مركزي السطوح، مع أربع ذرات حديد III لكل وحدة خلية. تحتوي بلورات أزرق پروسيا "القابلة للانحلال" على أيونات بينية K+ ؛ بدلاً من ذلك، يحتوي أزرق پروسيا غير القابل للانحلال على ماء خلالي. في بلورات أزرق پروسيا المثالية غير القابلة للانحلال، يتم إنشاء الإطار المكعب من متواليات Fe(II)–C–N–Fe(III)، مع مسافات Fe (II)-carbon تبلغ 1.92 Å وFe (III) - نيتروجين مسافات 2.03 Å. وربع مواقع الوحدات الفرعية Fe(CN) 6 (من المفترض أنها عشوائية) شاغرة (فارغة)، مما يترك ثلاث مجموعات من هذا القبيل في المتوسط لكل وحدة خلية.[27]تمتلئ مواقع النيتروجين الفارغة بجزيئات الماء بدلاً من ذلك، والتي يتم تركيبها مع Fe (III).
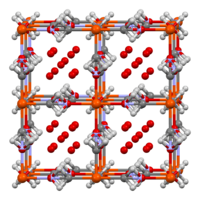
مراكز Fe (II)، منخفضة الدوران، محاطة بستة ربيطات كربون في تكوين ثماني السطوح. مراكز Fe (III)، عالية الدوران، محاطة بشكل ثماني السطوح بمتوسط 4.5 ذرة نيتروجين و1.5 ذرة أكسجين (الأكسجين من جزيئات الماء الستة المركبة). يوجد حوالي ثمانية جزيئات ماء (خلالي) في خلية الوحدة، إما كجزيئات معزولة أو رابطة هيدروجينية في الماء المركب.
من المعروف أن التركيبة متغيرة بسبب وجود ضعف شبكي، مما يسمح لها بالترطيب بدرجات مختلفة حيث يتم دمج جزيئات الماء في الهيكل لشغل مواقع شاغرة. يُعزى التباين في تكوين أزرق پروسيا إلى انخفاض الانحلالية، مما يؤدي إلى ترسيب سريع دون الزمن اللازم لتحقيق التوازن الكامل بين المادة الصلبة والسائلة.[27][28]
اللون
أزرق پروسيا ملون بقوة ويميل نحو الأسود والأزرق الداكن عند مزجه مع طلاء زيتي. يعتمد اللون الصحيح على طريقة التحضير التي تحدد حجم الجسيمات. ويرتبط اللون الأزرق المكثف لأزرق پروسيا بالطاقة الناتجة عن انتقال الإلكترون من الحديد (II) إلى الحديد (III). كما تكتص العديد من مركبات مختلطة التكافؤ أطوال موجية معينة من الضوء المرئي الناتج عن نقل شحنة الفاصل. في هذه الحالة، يتم امتصاص الضوء البرتقالي والأحمر حول 680 نانومتر في الطول الموجي، ونتيجة لذلك يظهر الضوء المنعكس باللون الأزرق.
كمعظم الألوان ذات شدة لون عالية الخضاب، لا يمكن عرض أزرق پروسيا بدقة على شاشة الحاسب. فأزرق پروسيا هو متغير اللون كهربياً - يتغير من الأزرق إلى عديم اللون عند الأكسدة والاختزال. هذا التغيير ناتج عن اختزال Fe(III) إلى Fe(II)، مما يلغي نقل شحنة الفاصل الذي يسبب لون أزرق پروسيا.
الاستخدامات
الخضاب
نظراً لأن أزرق پروسيا سهل الصنع ورخيص وغير سام وكثيف اللون، فقد اجتذب أزرق پروسيا العديد من التطبيقات، فقد اعتُمد كصبغة بعد اختراعه بفترة وجيزة، واستخدم على نطاق واسع على الفور في الدهانات الزيتية والألوان المائية والصباغة.[29]غالب استخدامات أزرق پروسيا هي للأصباغ: يتم إنتاج حوالي 12000 طن من أزرق پروسيا سنوياً لاستخدام في الحبر الأسود والمزرق. تحتوي أيضاً على مجموعة متنوعة من الأصباغ الأخرى.[21] أزرق الهندسة والصبغة المتكونة في الطباعة السماوية - مما يعطيهم الاسم الشائع الطبعة الزرقاء. كما لُوِّنت أقلام التلوين مرة واحدة أزرق پروسيا (أُعيد تسميتها لاحقاً أزرق منتصف الليل). وبالمثل، فإن أزرق پروسيا هو أساس عملية تبييض الغسيل.
تُستخدم الجسيمات النانوية من أزرق پروسيا كأصباغ في بعض مكونات مستحضرات التجميل، وفقاً لمرصد الاتحاد الأوروپي للمواد النانوية.
| Prussian Blue Color Information Box | |
|---|---|
| Hex triplet | #003152 |
| sRGBB (r, g, b) | (0, 49, 82) |
| HSV (h, s, v) | (204°, 100%, 32%) |
| CIELChuv (L, C, h) | (19, 29, 246°) |
| المصدر | No source |
| B: Normalized to [0–255] (byte) H: Normalized to [0–100] (hundred) | |
الطب
إن أزرق پروسيا على دمج موجبات الشحنة المعدنية أحادية التكافؤ (Me+) تجعله مفيداً باعتباره عامل عزل لبعض الفلزات الثقيلة السامة. يُستخدم أزرق پروسيا الدوائي على وجه الخصوص للأشخاص الذين تناولوا ثاليوم (Tl+) أو السيزيوم المشع (134Cs+, 137Cs+). ووفقاً لـ الوكالة الدولية للطاقة الذرية (IAEA)، يمكن للذكر البالغ أن يتناول ما لا يقل عن 10 g من أزرق پروسيا يومياً دون التعرض لأذى خطير. حددت إدارة الغذاء والدواء (FDA) أن "كبسولات أزرق پروسيا ذات 500 ملغ، عند تصنيعها وفقاً لشروط تطبيق دواء جديد معتمد، يمكن اعتبارها علاجاً آمناً وفعالًا" في حالات تسمم معينة.[30][31]راديوگارديز (أزرق پروسيا في كبسولات قابلة للذوبان [32]) وهو منتج تجاري لإزالة السيزيوم-137 من الأمعاء، بشكل غير مباشر من مجرى الدم عن طريق التدخل في الدورة الدموية المعوية الكبدية من السيزيوم-137،[33] مما يقلل من زمن الإقامة الداخلية (والتعرض) بنحو الثلثين. على وجه الخصوص، تم استخدامه من أجل لاشتراب وإزالة 137 Cs+ من أعضاء أولئك الذين تسمموا في حادثة گويانيا في البرازيل.[2]
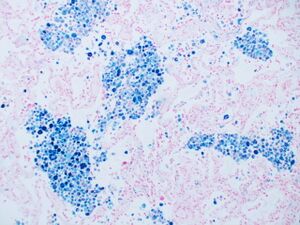
تلطيخ بالحديد
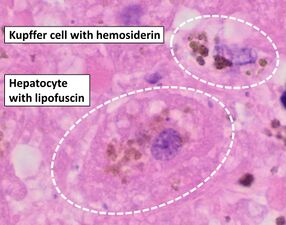
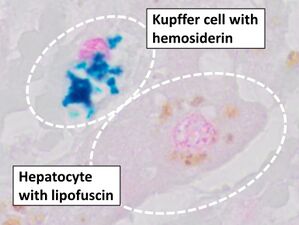
أزرق پروسيا هو صبغة علم أمراض الأنسجة الشائعة التي يستخدمها أخصائيو علم الأمراض للكشف عن وجود الحديد في عينات الخزعة، كما هو الحال في عينات نخاع العظام. استخدمت الصيغة الأصلية للطخات، المعروفة تاريخياً (1867) باسم "أزرق پروسيا پرلز" تيمناً بمخترعها، أخصائي علم الأمراض الألماني ماكس پرلز (1843-1881)، محاليل منفصلة من حديدوسيانيد الپوتاسيوم والحمض لتلطيخ الأنسجة (يتم استخدامها الآن معاً، قبل تلطيخها مباشرة). ثم تشكل رواسب الحديد في الأنسجة صبغة أزرق پروسيا الأرجوانية في مكانها، وتبدو على أنها رواسب زرقاء أو أرجوانية.[34]
التشريح المرضي للكبد، يظهر خلية كوپفر مع ترسب هيموسديرين واضح بجوار خلية كبدية مع صبغة ليپوفوسين. لطخة H&E.
من قبل الميكانيكيين مصنعي الأدوات
أزرق المهندسين، أزرق پروسيا ذي الأساس الزيتي، هو المادة التقليدية المستخدمة لاكتشاف الأسطح المعدنية مثل الألواح المسطحة و محملات مكاشط اليدوية. يتم تطبيق طبقة رقيقة من عجينة غير مجففة على سطح إسناد ويتم نقلها إلى النقاط العالية من قطعة العمل. يقوم صانع الأدوات بعد ذلك بكشط أو صقل أو إزالتها بأي طريقة أخرى. يُفضل أزرق پروسيا لأنه لن يزيل الأسطح المسندة الدقيقة للغاية كما قد تفعل العديد من الأصباغ الأساسية.
في الكيمياء التحليلية
يتكون أزرق پروسيا في اختبار أزرق پروسيا للفينولات الكلية. يتم إعطاء العينات والمعايير الفينولية كلوريد الحديديك الحمضي وحديديسيانيد، والذي يتم تقليله إلى حديدوسيانيد بواسطة الفينولات. يتفاعل كلوريد الحديديك والحديدوسيانيد ليشكلوا أزرق پروسيا. تسمح مقارنة الامتصاصية عند 700 nm من العينات بالمعايير بتحديد إجمالي الفينولات أو متعددات الفينول.[35][36]
الاستخدام المنزلي
يتواجد أزرق پروسيا في بعض مستحضرات تبييض الغسيل، مثل مستحضر السيدة ستيوارت للتبييض.[37]
مواد البطاريات
أُجريت دراسات على أزرق پروسيا (PB) لتطبيقاته في تخزين الطاقة الكهروكيميائية وتحويلها منذ عام 1978.[38]من الممكن استبدال مراكز الحديد المعدنية في أزرق پروسيا بأيونات معدنية مختلفة مثل المنجنيز، الكوبالت، النيكل، الزنك، إلخ. لتكوين نظائر أزرق پروسيا النشط كهربياً (PBAs). يمكن استخدام PB/PBAs ومشتقاتها كمواد إلكترود لإدخال واستخراج أيونات قلوية عكوسة في بطارية ليثيوم-أيون، بطارية صوديوم-أيون، وبطارية پوتاسيوم-أيون.
انظر أيضاً
- Blue billy
- Blue pigments
- أزرق كوبالت
- بنفسج بلوري
- فلورسين
- Han purple and Han blue
- List of inorganic pigments
- Midnight blue
- Phthalocyanine Blue BN
المراجع
- ^ International Tables for Crystallography, Vol. A (2016 ed.). ISBN 978-0-470-68575-4.
- ^ أ ب ت Dunbar, K. R. & Heintz, R. A. (1997). Chemistry of Transition Metal Cyanide Compounds: Modern Perspectives. Progress in Inorganic Chemistry. Vol. 45. pp. 283–391. doi:10.1002/9780470166468.ch4. ISBN 9780470166468.
- ^ "WHO Model List of Essential Medicines" (PDF). World Health Organization. October 2013. Retrieved 22 April 2014.
- ^ St. Clair, Kassia (2016). The Secret Lives of Colour. London: John Murray. pp. 189–191. ISBN 9781473630819. OCLC 936144129.
- ^ أ ب Bartoll, Jens. "The early use of prussian blue in paintings" (PDF). 9th International Conference on NDT of Art, Jerusalem Israel, 25–30 May 2008. Retrieved 2010-01-22.
- ^ Berger, J. E. (c.1730) Kerrn aller Fridrichs=Städtschen Begebenheiten. Staatsbibliothek zu Berlin – Preußischer Kulturbesitz, Handschriftenabteilung, Ms. Boruss. quart. 124.
- ^ Finlay, Victoria (2014). The Brilliant History of Color in Art. J. Paul Getty Museum. pp. 86–87. ISBN 978-1606064290.
- ^ أ ب Frisch, J. L. (1896) Briefwechsel mit Gottfried Wilhelm Leibniz L. H. Fischer (ed.), Berlin, Stankiewicz Buchdruck, reprint Hildesheim/New York: Georg Olms Verlag, 1976
- ^ Bartoll, J.; Jackisch, B.; Most, M.; Wenders de Calisse, E.; Vogtherr, C. M. (2007). "Early Prussian Blue. Blue and green pigments in the paintings by Watteau, Lancret and Pater in the collection of Frederick II of Prussia". Techné. 25: 39–46.
- ^ Mulherron, Jamie (2001). "Prussian Blue, Boucher and Newton: the Material, Practice and Theory of Rococo painting". Object. no. 3: 68–93.
- ^ Stahl, Georg Ernst (1731). Georgii Ernesti Stahlii, Experimenta, Observationes, Animadversiones, CCC Numero, Chymicae Et Physicae: Qualium alibi vel nulla, vel rara, nusquam autem satis ampla, ad debitos nexus, & veros usus, deducta mentio, commemeratio, aut explicatio, invenitur. Qualium partim, in aliis Autoris scriptis, varia mentio facta habetur; partim autem nova commemoratio hoc Tractatu exhibetur: utrimque vero, universa res uberius explicatur atque confirmatur (in اللاتينية). Haude.
- ^ Woodward, J. (1724–1725). "Praeparatio coerulei Prussiaci es Germanica missa ad Johannem Woodward." [Preparation of Prussian blue sent from Germany to John Woodward...]. Philosophical Transactions of the Royal Society of London. 33 (381): 15–17. doi:10.1098/rstl.1724.0005.
- ^ Brown, John (1724–1725). "Observations and Experiments upon the Foregoing Preparation". Philosophical Transactions. 33 (381): 17–24. Bibcode:1724RSPT...33...17B. doi:10.1098/rstl.1724.0006. JSTOR 103734.. The recipe was subsequently published in Geoffroy, Étienne-François (1727) "Observations sur la Preparation de Bleu de Prusse ou Bleu de Berlin," Mémoires de l'Académie royale des Sciences année 1725. Paris. pp. 153–172.
- ^ "The Creation of Color in Eighteenth-Century Europe: Prussian Blue". www.gutenberg-e.org. Retrieved 2022-07-28.
- ^ Macquer, Pierre-Joseph (1752) "Éxamen chymique de bleu de Prusse," Mémoires de l'Académie royale des Sciences année 1752 ... (Paris, 1756), pp. 60–77. This article was reviewed in "Sur le bleu de Prusse," Histoire de l'Académie royale des Sciences... (1752), (Paris, 1756), pp. 79–85.
- ^ Scheele, Carl W. (1782) "Försök, beträffande det färgande ämnet uti Berlinerblå" (Experiment concerning the coloring substance in Berlin blue), Kungliga Svenska Vetenskapsakademiens handlingar (Royal Swedish Academy of Science's Proceedings), 3: 264–275 (in Swedish). Reprinted in Latin as: "De materia tingente caerulei berolinensis" in: Carl Wilhelm Scheele with Ernst Benjamin Gottlieb Hebenstreit (ed.) and Gottfried Heinrich Schäfer (trans.), Opuscula Chemica et Physica (Leipzig ("Lipsiae"), (Germany): Johann Godfried Müller, 1789), vol. 2, pages 148–174.
- ^ see Tekhelet#Sepia officinalis
- ^ "Has the long lost chilazon, source of the biblical blue techeiles dye been rediscovered?". 8 April 2008. Archived from the original on 8 April 2008. Retrieved 12 May 2020.
- ^ Haythornthwaite, Philip (1991) Frederick the Great's Army – Infantry. Bloomsbury USA. p. 14. ISBN 1855321602
- ^ Bull, Stephen (2000) World War One: German Army. Brassey's. pp. 8–10. ISBN 1-85753-271-6
- ^ أ ب Völz, Hans G. et al. (2006) "Pigments, Inorganic" in Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. DOI:10.1002/14356007.a20_243.pub2.
- ^ Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: Inorganic chemistry, p.1444. Academic Press, 2001; Google books
- ^ Journal of Toxicology, Suicide Attempt by Ingestion of Potassium Ferricyanide
- ^ Jonathan R. Thurston, Scott E. Waters, Brian H. Robb, Michael P. Marshak (March 2022). "Organic and Metal-Organic RFBs". Encyclopedia of Energy Storage. 2: 423–435.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Ozeki, Toru.; Matsumoto, Koichi.; Hikime, Seiichiro. (1984). "Photoacoustic spectra of prussian blue and photochemical reaction of ferric ferricyanide". Analytical Chemistry. 56 (14): 2819. doi:10.1021/ac00278a041.
- ^ Izatt, Reed M.; Watt, Gerald D.; Bartholomew, Calvin H.; Christensen, James J. (1970). "Calorimetric study of Prussian blue and Turnbull's blue formation". Inorganic Chemistry (Submitted manuscript). 9 (9): 2019. doi:10.1021/ic50091a012.
- ^ أ ب ت Herren, F.; Fischer, P.; Ludi, A.; Haelg, W. (1980). "Neutron diffraction study of Prussian Blue, Fe4[Fe(CN)6]3·xH2O. Location of water molecules and long-range magnetic order". Inorganic Chemistry. 19 (4): 956. doi:10.1021/ic50206a032.
- ^ Lundgren, C. A.; Murray, Royce W. (1988). "Observations on the composition of Prussian blue films and their electrochemistry". Inorganic Chemistry. 27 (5): 933. doi:10.1021/ic00278a036.
- ^ Berrie, Barbara H. (1997). "Prussian Blue". In Artists' Pigments. A Handbook of their History and Characteristics, E. W. FitzHugh (ed.). Washington, DC: National Gallery of Art. ISBN 0894682563.
- ^ "Questions and Answers on Prussian Blue". Food and Drug Administration. Archived from the original on 2009-07-10. Retrieved 2020-03-20.
- ^ "Questions and Answers on Calcium-DTPA and Zinc-DTPA (Updated)". U.S. Food & Drug Administration. 3 November 2018. Retrieved 21 March 2020.
- ^ Radiogardase: Package insert with formula Archived 2011-03-20 at the Wayback Machine
- ^ Heyltex Corporation – Toxicology Archived 2007-11-12 at the Wayback Machine
- ^ Formula for Perls Prussian blue stain. Accessed April 2, 2009.
- ^ "Tannin Chemistry" (PDF). Archived from the original (PDF) on 2013-08-26. Retrieved 2009-12-19. (1.41 MB)Accessed December 19, 2009
- ^ Stabilization of the Prussian blue color in the determination of polyphenols. Horace D. Graham, J. Agric. Food Chem., 1992, volume 40, issue 5, pages 801–805, DOI:10.1021/jf00017a018
- ^ Schwarcz, Joe (January 22, 2016). "The Right Chemistry: Columbo, your laundry and liquid bluing". Montreal Gazette. Retrieved February 28, 2017.
- ^ Neff, Vernon D. (1978-06-01). "Electrochemical Oxidation and Reduction of Thin Films of Prussian Blue". Journal of the Electrochemical Society (in الإنجليزية). 125 (6): 886–887. Bibcode:1978JElS..125..886N. doi:10.1149/1.2131575. ISSN 1945-7111.
وصلات خارجية
- The FDA's page on Prussian blue
- The CDC's page on Prussian blue
- National Pollutant Inventory – Cyanide compounds fact sheet
- Heyltex Corporation distributors of Radiogardase (Prussian blue insoluble capsules)
- Sarah Lowengard, "Prussian Blue" in The Creation of Color in Eighteenth Century Europe Columbia University Press, 2006
- Prussian blue, ColourLex
- Kraft, Alexander (2008). "On the discovery and history of Prussian blue" (PDF). Bull. Hist. Chem. 33 (2): 61–67.
خطأ لوا في وحدة:Authority_control على السطر 278: attempt to call field '_showMessage' (a nil value).
- CS1 اللاتينية-language sources (la)
- Short description is different from Wikidata
- Articles with hatnote templates targeting a nonexistent page
- Articles with changed EBI identifier
- ECHA InfoCard ID from Wikidata
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- Articles containing ألمانية-language text
- Articles containing Ancient Greek (to 1453)-language text
- Articles containing لاتينية-language text
- Color articles with suppressed CMYK data
- Pages using infobox color with deprecated parameters
- درجات الأزرق
- سيانيدات
- Iron(II,III) compounds
- Inorganic pigments
- مركبات الحديد
- كيماويات التصوير الضوئي
- الأدوية الأساسية حسب منظمة الصحة العالمية