تكافؤ
التكافؤ (Valence) في علم الكيمياء هو قوة الذرة الخاصة بأى عنصر على الإتحاد مع الذرات الأخرى ويتم قياس ذلك بعدد الإلكترونات التى ستقوم الذرة بإعطاؤها أو أخذها أو مشاركتها لعمل رابطة كيميائية. وهذا راجع لعدد الفراغات الموجودة في غلاف تكافؤ الذرة. كما يتم وصف حالة الذرة بإرقام لاتينية ( مونو ، باى/داى ، تراى ، تيترا وهكذا وذلك للتكافؤ 1 ، 2 ، 3 ، 4 ) فمثلا عنصر المجموعة الرئيسي الذى يكون فلز له تكافؤ 1, وهذا يساوى عدد لعدد اللإلكترونات الموجودة في غلاف التكافؤ. الفلزات الإنتقالية غالبا ما يكون لها أكثر من تكافؤ ( راجع القائمة بالأسفل ).
التاريخ
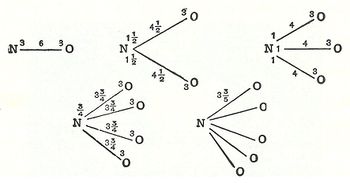
استُخدم مفهوم التكافؤ في القرن الماضي استخداماً بسيطاً جداً، إذ أخذ الهدروجين عنصراً للمقارنة، فكان تكافؤ عنصر غير معدني هو قيمته الاتحادية مع الهدروجين، وكان تكافؤ عنصر معدني هو عدد ذراته التي تحل محل الهدروجين في مركب ما. فعلى سبيل المثال: يكون تكافؤ الكلور Cl واحداً في HCl وتكافؤ الأكسجين O اثنين في H2O، وتكافؤ النتروجين N ثلاثة في NH3؛ كما أن تكافؤ الصوديوم]] Na واحد في NaCl، وتكافؤ الكلسيوم Ca اثنان في CaCl2، وتكافؤ الألمنيوم Al ثلاثة في AlCl3.
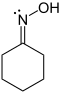 |
In cyclohexanonoxime (image left), the nitrogen atom has three valence bonds and by the first definition it has a valence of three. |
كذلك اتُّخذ الأكسجين عنصراً للمقارنة في المركبات الأكسجينية، مثل: N2O، CO، SiO2، SO3،.. حيث يُرى أن تكافؤ النتروجين يساوي واحداً وتكافؤ الكربون يساوي اثنين، وتكافؤ السيليسيوم أربعة وتكافؤ الكبريت ستة بافتراض أن تكافؤ الأكسجين اثنان.
تعريف الحد الأقصى لعدد الروابط
وتظهر الخاصية الدورية لصفات العناصر واضحة أكثر الوضوح في قيم تكافؤ العناصر الممثَّلة في المجموعات (الفصائل) A؛ فالتكافؤ الاعتيادي الأكثر شيوعاً للعنصر في كلٍ من المجموعات الأولى A حتى المجموعة A الرابعة يساوي رقم المجموعة، أما تكافؤ العنصر في كلٍ من المجموعات A الخامسة والسادسة والسابعة فيساوي حاصل طرح رقم المجموعة من العدد A. فالليثيوم Li من المجموعة الأولى A أحادي التكافؤ في مركبه LiCl، والباريوم Ba من المجموعة الثانية A ثنائي التكافؤ في BaO، والألمنيوم Al من المجموعة الثالثة A ثلاثي التكافؤ في AlCl3، والفسفورP من المجموعة الخامسة A ثلاثي التكافؤ في PCl3، والكبريت A من المجموعة السادسة A ثنائي التكافؤ في H2S.
أمثلة
(valencies according to the number of valence bonds definition and conform oxidation states)
| COMPOUND | FORMULA | VALENCE | OXIDATION STATE |
|---|---|---|---|
| Hydrogen chloride | HCl | H=1 Cl=1 | H=+1 Cl=−1 |
| Chlorine | Cl2 | Cl=1 Cl=1 | Cl=+1 Cl=−1 |
| Perchlorate * | HClO4 | H=1 Cl=7 O=2 | H=+1 Cl=+7 O=−2 |
| Sodium hydride | NaH | Na=1 H=1 | Na=+1 H=−1 |
| Ferrous oxide ** | FeO | Fe=2 O=2 | Fe=+2 O=−2 |
| Ferric oxide ** | Fe2O3 | Fe=3 O=2 | Fe=+3 O=−2 |
ولكن كل ما سبق ذكره لا يخضع لأية مبادئ نظرية في طبيعة الرابطة الكيمياوية، فمعظم العناصر في مركباتها المختلفة تظهر تكافؤات مختلفة، ولا يمكن الجزم بتحديد تكافؤ عنصر ما بقيمة واحدة. وقد أدى تطور نظريات الرابطة الكيمياوية إلى وضع أساس نظري لمفهوم التكافؤ وإلى التمييز بين التكافؤ الكهربائي electrovalence والتكافؤ المشترك cooalence والتكافؤ التساندي coordinence.
التكافؤ الكهربائي أو التكافؤ الإيوني
هو العدد الصحيح الذي يعبِّر عن شحنة الإيون إذا أُخذت شحنة الإلكترون واحدة للشحنة. فالذرة التي فقدت أحد إلكتروناتها السطحية تكون موجبة الشحنة، أما الذرة التي اكتسبت إلكتروناً فتكون سالبة الشحنة، وتكون قوى الجذب بين هذه الأيونات المتعاكسة شديدة، ويتدخل هذا التكافؤ في قوانين فارادي وفي تكوين المركبات الأيونية.
التكافؤ المشترك
يتزاوج أحد إلكترونات الطبقة السطحية لذرة مع أحد إلكترونات الطبقة السطحية لذرة أخرى ويصبح زوج الإلكترونات هذا من نصيب كلتا النواتين، وتكون السوية السطحية لكلتا الذرتين المكوِّنتين للجزيء محققة قاعدة الثمانية.
وترتبط عادة نواتا ذرتين وزوج أو زوجان أو ثلاثة أزواج من الإلكترونات في الروابط المشتركة، وتكون الرابطة أحادية في Cl:Cl وثنائية في O::O، وثلاثية في N:::N.
أمَّا التكافؤ التساندي فهو نوع من أنواع المشترك، إذ تُسهم إحدى الذرتين بكلا الإلكترونين وهي الذرة المانحة، ويتم اقتسام زوج الإلكترونات بين هاتين الذرتين لتشكيل الرابطة التساندية التي تُميَّز بسهم يتجه من الذرة المانحة. ويقوم التكافؤ التساندي بدور هام في تصنيف المركبات المعقدة ودراستها.[1]
التكافؤ أو حالة الأكسدة
ولا يتم إستخدام المصطلح تكافؤ بكثرة هذه الأيام ( حتى أن بعض الكتب لا تذكره من الأصل ) حيث ان المصطلح الأكثر دقة هو حالة التأكسد ويفضل إستخدامه. وللمركبات الأيونية البسيطة تكون حالة التأكسد للفزات مساوية لتكافؤها. وعموما فإنه للمركبات التساهمية التى تتضمن اللا فلزات غالبا ما يكون هناك فرق.
التكافؤ الأقصى للعناصر
القائمة
قائمة بالتكافؤات العامة لأول 103 عنصر مرتبة حسب العدد الذري :
| العدد الذري | إسم العنصر | التكافؤ | ||
|---|---|---|---|---|
| 1 | هيدروجين | 1 | ||
| 2 | هيليوم | 0 | ||
| 3 | ليثيوم | 1 | ||
| 4 | بيريليوم | 2 | ||
| 5 | بورون | 3 | ||
| 6 | كربون | 2, 4 | ||
| 7 | نيتروجين | 3, 5 | ||
| 8 | أكسجين | 2 | ||
| 9 | فلور | 1 | ||
| 10 | نيون | 0 | ||
| 11 | صوديوم | 1 | ||
| 12 | ماغنسيوم | 2 | ||
| 13 | ألومنيوم | 3 | ||
| 14 | سيليكون | 4 | ||
| 15 | فوسفور | 3, 5 | ||
| 16 | كبريت | 2, 4, 6 | ||
| 17 | كلور | 1, 3, 5, 7 | ||
| 18 | أرجون | 0 | ||
| 19 | بوتاسيوم | 1 | ||
| 20 | كالسيوم | 3, 5 | ||
| 21 | سكانديوم | 3 | ||
| 22 | تيتانيوم | 3, 4 | ||
| 23 | فانديوم | 2, 3, 4, 5 | ||
| 24 | كروم | 0, 2, 3, 6 | ||
| 25 | منجنيز | 2, 3, 4, 6, 7 | ||
| 26 | حديد | 0, 2, 3 | ||
| 27 | كوبالت | 2, 3 | ||
| 28 | نيكل | 0, 2, 3 | ||
| 29 | نحاس | 1, 2 | ||
| 30 | زنك | 2 | ||
| 31 | جاليوم | 2, 3 | ||
| 32 | جيرمانيوم | 4 | ||
| 33 | زرنيخ | 3, 5 | ||
| 34 | سيلينيوم | 2, 4, 6 | ||
| 35 | بروم | 1, 3, 5, 7 | ||
| 36 | كربتون | 0 | ||
| 37 | روبيديوم | 1 | ||
| 38 | سترانشيوم | 2 | ||
| 39 | إيتيريوم | 3 | ||
| 40 | زركونيوم | 4 | ||
| 41 | نيوبيوم | 3, 5 | ||
| 42 | موليبيدنيوم | 0, 2, 3, 4, 5, 6 | ||
| 43 | تكنيتيوم | 2, 3, 4, 6, 7 | ||
| 44 | روثينيوم | 0, 3, 4, 6, 8 | ||
| 45 | روديوم | 3, 4 | ||
| 46 | بلاديوم | 0, 2, 4 | ||
| 47 | فضة | 1 | ||
| 48 | كادميوم | 2 | ||
| 49 | إنديوم | 1, 3 | ||
| 50 | قصدير | 2, 4 | ||
| 51 | أنتيمون | 3, 5 | ||
| 52 | تيلوريم | 2, 4, 6 | ||
| 53 | يود | 1, 3, 5, 7 | ||
| 54 | زينون | 0 | ||
| 55 | سيزيوم | 1 | ||
| 56 | باريوم | 2 | ||
| 57 | لانثانوم | 3 | ||
| 58 | سيريوم | 3, 4 | ||
| 59 | براسيوديميوم | 3 | ||
| 60 | نيوديوم | 3 | ||
| 61 | بروميثيوم | 3 | ||
| 62 | ساماريوم | 2, 3 | ||
| 63 | يوروبيوم | 2, 3 | ||
| 64 | جادولينيوم | 3 | ||
| 65 | تريبيوم | 3 | ||
| 66 | ديسبروسيوم | 3 | ||
| 67 | هولميوم | 3 | ||
| 68 | إبريوم | 3 | ||
| 69 | ثوليوم | 2, 3 | ||
| 70 | اِيتربيوم | 2, 3 | ||
| 71 | لوتيتيوم | 3 | ||
| 72 | هافنيوم | 4 | ||
| 73 | تنتالوم | 3, 5 | ||
| 74 | تنجستين | 0, 2, 4, 5, 6 | ||
| 75 | رينيوم | 1, 4, 7 | ||
| 76 | أوزميوم | 0, 2, 3, 4, 6, 8 | ||
| 77 | إريديوم | 3, 4 | ||
| 78 | بلاتين | 0, 2, 4 | ||
| 79 | ذهب | 1, 3 | ||
| 80 | زئبق | 1, 2 | ||
| 81 | ثاليوم | 1, 3 | ||
| 82 | رصاص | 2, 4 | ||
| 83 | بزموث | 3, 5 | ||
| 84 | بولونيوم | 2, 3, 4 | ||
| 85 | أستاتين | 1, 3, 5, 7 | ||
| 86 | رادون | 0 | ||
| 87 | فرنسيوم | 1 | ||
| 88 | راديوم | 2 | ||
| 89 | اّكتينيوم | 3 | ||
| 90 | ثوريوم | 4 | ||
| 91 | بروتكتينيوم | 4, 5 | ||
| 92 | يورانيوم | 3, 4, 5, 6 | ||
| 93 | نبتونيوم | 2, 3, 4, 5, 6 | ||
| 94 | بلوتونيوم | 2, 3, 4, 5, 6 | ||
| 95 | أمريكيوم | 2, 3, 4, 5, 6 | ||
| 96 | كوريوم | 2, 3, 4 | ||
| 97 | بركليوم | 2, 3, 4 | ||
| 98 | كاليفورنيوم | 2, 3, 4 | ||
| 99 | أينشتينيوم | 2, 3 | ||
| 100 | فرميوم | 2, 3 | ||
| 101 | مندليفيوم | 2, 3 | ||
| 102 | نوبليوم | 2, 3 | ||
| 103 | لورنسيوم | 3 |
انظر أيضا
المصادر
- ويكيبيديا الإنجليزية .