لقاح مرسال الرنا
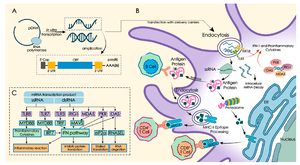
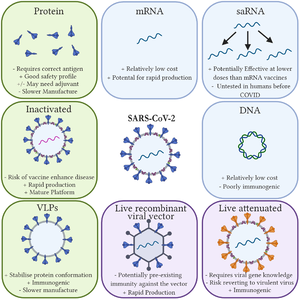
لقاح مرسال الرنا (إنگليزية: RNA Vaccine)، هو نوع من أنواع اللقاحات التي تعمل على شريط الحمض النووي الريبوزي المرسال mRNA، لتحفيز الاستجابة المناعية. حيث يحمل اللقاح مستضدات مشفرة بجزيئات الحمض النووي الريبوزي المرسال للكائن المرضي (الفيروس مثالا)، والتي يؤدي دخولها الى الجسم الى تحفيز الخلايا المناعية وتوليد استجابة ناعية. إذ تقوم الخلايا المناعية في الجسم باستخدام شريط الحمض النووي الريبوزي المرسال كقالب لتصنيع البروتينات الأجنبية (التي يقوم الجرثوم كالفيروس أو الخلايا السرطانية بتصنيعها عند تواجدها داخل الخلايا الحية. ويؤدي تصنيع هذه البروتينات الى اثارة خلايا المناعة المكتسبة في الجسم وتوليد استجابة مناعية تجعل الجسم قادرا على تمييز الأجسام المرضية المرادفة للقاح المحقون فيما بعد وتخليص الجسم منها.
يتم استخلاص الحمض النووي الريبوزي وتغليفه بجزيئات النانو الدهنية التي تحمي خيوط الحمض النووي الريبوزي وتساعد خلايا الجسم على امتصاصها.
وتعرف التأثيرات العكسية للقاح (Reactogenicity): على أنها مجموعة التأثيرات التي تحصل غالبا بعد التلقيح، ويمكن أن تشمل الألم والاحمرار أو التورم حول موضع حقن اللقاح. وقد يشعر متلقي اللقاح بالتعب أو الصداع أو ارتفاع درجة الحرارة. وتجدر الاشارة الى أن هذه التأثيرات هي علامات فعالية الاستجابة المناعية. ويعتبر الأشخاص المصابون بأمراض المناعة الذاتية كداء السكري هم الفئة المعرضة لتطوير أثر عكسي ضار بعد التطعيم.
ومن فوائد لقاحات مرسال الرنا مقارنة باللقاحات التقليدية:
- سهولة وسرعة تصنيعها.
- ذات تكلفة قليلة اذا ما قورنت باللقاحات التقليدية السابقة.
- تعمل على تحفيز كل من المناعة الخلوية والمناعة الخلطية.
- لا تتفاعل مع الحمض النووي الريبوزي منقوص الأوكسجين الدنا.
ومن عيوب بعض لقاحات مرسال الرنا كلقاح لقاح فايزر-بيونتك المضاد لفيروس كورونا كوفيد 19 أنها تتطلب وسط فائق البرودة قبل التوزيع. في حين لاتتطلب لقاحات كوفيد 19 الأخرى ذلك الوسط أمثال موديرنا، كيورفاك، ووالفاكس.
وقد حازت لقاحات الرنا المرسال mRNA اهتماما كبيرا كاستخدامها في تطوير لقاحات مضادة لفيروس كورونا كوفيد 19. ففي ديسمبر 2020 حصلت شركتا فايزر - بيونتيك و مودرينا على الموافقة على اختبار لقاحاتهما المضادة لفيروس كورونا كوفيد 19 المصنعة بتقنية استخلاص الحمض النووي الريبوزي المرسال.
وفي الثاني من ديسمبر 2020 وافقت الوكالة التنظيمية للأدوية ومنتجات الرعاية الصحية البريطانية MHRA على استخدام لقاحات الرنا المرسال المضادة لفيروس كورونا كوفيد 19، لتصبح بذلك أول منظم دوائي يوافق على ذلك، وقد أدت تلك الموافقة الى انتشار استخدام لقاح فايزر - بيونتيك على نطاق واسع.
وفي الحادي عشر من ذات الشهر، حصلت موافقة منظمة الغذاء والدواء الأمريكية FDA على الاستخدام الطارىء للقاح فايزر - بيونتيك، وبعد اسبوع صرحت بذات الموافقة بخصوص لقاح مودرينا.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
لمحة تاريخية
التجارب المبكرة
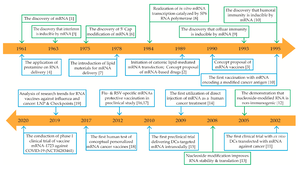
سجلت أول عملية تطعيم بجزيئات الحمض النووي الريبوري المرسال المغلف بجزيئات النانو الدهنية في العام 1989.
بينما تمت تجربة التطعيم بالجزيئات المكشوفة (غير المغلفة) بجزيئات النانو الدهنية في العام 1990، في عضلات الفئران.
وأشارت تلك الدراسات إلى أولى الدلائل التي أثبتت أمكانية التطعيم بجريئات الحمض النووي الريبوزي]] على إعطاء المعلومات الوراثية لتخليق جزيئات البروتين الأجنبية في الخلايا الحية. علماً أن تلك الدراسات قد تم تجريبها على الخلايا الحية البشرية مختبرياً (خارج الجسم)، وقد أدت نتائجها إلى خلق فكرة تصنيع لقاحات الرنا المرسال mRNA vaccines.
في العام 1993، ظهرت جزيئات الحمض النووي الريبوزي المغلفة بالجسيم الشحمي، والتي أثبت فاعليتها في تحفيز خلايا تي T المناعية في الفئران.
وفي العام التالي، تم تطوير طريقة التضخيم الذاتي للرنا المرسال عبر تضمين مستضد الفيروس والإنزيم المنشط للرنا. وقد تم تجريب هذه الدراسة على الفئران أولاً لتحفيز كلا المناعتين الخلوية والخلطية ضد الفيروسات.
ليعقب ذلك تجريب تشفير الرنا المرسال بمستضدات الأورام على الفئران أيضاً لتحفيز الخلايا المناعية ضد الخلايا السرطانية.
التطوير
في العام 2001 أجريت أول تجربة سريرية بشرية خارج الجسم الحي (مختبريا) للقاح الرنا المرسال المضاد للسرطان باستخدام الخلايا الجذعية المتغصنة المشفرة بشريط الحمض النووي الريبوزي المرسال.
وفي الأربع سنوات التالية، نجحت طريقة النيوكليوتيدات المعدلة في نقل الرنا داخل الخلايا الحية دون إثارة الخلايا المناعية الدفاعية في الجسم.
ووجهت نتائج المحاولات السريرية للقاح الرنا المرسال المضاد للخلايا السرطانية نحو حقنها المباشر داخل الجسم الحي في العام 2008. حيث طوّرت شركة بيونتيك في العام 2008، وشركة مودرينا في العام 2010 تقنيات بيو- تكنولوجية لتطوير الحمض النووي الريبوزي المرسال.
وقد طرحت وكالة البحوث الأمريكية برنامج التكنولوجيا الحيوية لتطوير تقنيات حيوية عاجلة لخدمة الجيش الأمريكي (لمنع انتشار الأوبئة والأمراض بين صفوف الجيش).
وقد تعرفت الوكالة على أهمية الأحماض الأمينية في تطوير تقنيات دفاعية مضادة للأوبئة، وبدأت الاستثمار في ذلك المجال. وقد شجعت الوكالات الحكومية الأخرى والمستثمرين في القطاع الخاص على استثمار تقنية الرنا المرسال.
وكان استخدام لقاح الكلب (المضاد لداء الكلب أو السعار) في العام 2013 أول محاولة سريرية بشرية للقاحات الرنا المرسال كمضاد للعدوى، وفي غضون سنوات قليلة اجريت تجارب أخرى حول إمكانية تصنيع لقاحات مضادة لعدد من الفيروسات كالانفلونزا، فيروس زيكا، والفيروس المضخم للخلايا.
التسريع
أدى انتشار جائحة كورونا مع مطلع عام 2020 إلى الحصول على موافقة سريعة لاستخدام أول لقاحات الرنا المرسال. وكانتا شركتا بيونتيك وموديرنا قد حصلتا على الموافقة لتطوير لقاحاتهما المضادة لفيروس كورونا في العام ذاته.
وكانت الوكالة التنظيمية للأدوية ومنتجات الرعاية الصحية البريطانية MHRA أول منظم دوائي في العالم يوافق على استخدام لقاحات الرنا، مانحة موافقة طارئة لشركة فايزر - بيونيك على إطلاق لقاحها. وقد أدت تلك الموافقة الى انتشار استخدام لقاح فايزر - بيونتيك على نطاق واسع. لتعقبها موافقة منظمة الدواء والغذاء الأمريكية.
آلية العمل
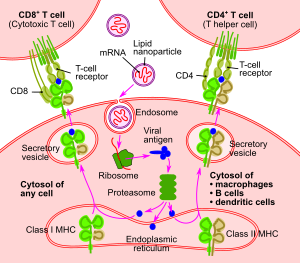
تعمل اللقاحات بشكل عام على تحفيز الخلايا المناعية على توليد أجسام مضادة للجرثوم المحقون، والذي يكون أما بشكل مستضدات أو فيروس موهن أو فيروس ميت، أو ناقل فيروسي معدل وراثياً، جميعها يتم تحضيرها وإعدادها خارج الجسم.
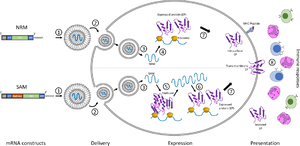
أما ميكانيكية عمل لقاحات الرنا المرسال، فهي كالآتي:
يكون اللقاح عبارة عن نسخة من شريط رنا قصير حي محضر مختبرياً من رنا الفيروس، وعندما يتم حقنه داخل الجسم يتم التعامل معه من قبل الخلايا المتغصنة المناعية والتي تقوم باستعماله كقالب وراثي لتصنيع رنا الفيروس المحقون، والذي يتعرف عليه الجسم كمستضاد غريب، وبالتالي يعمل على التخلص منه في غضون أيام قليلة عن وتوليد أجسام مضادة ضده. فبمجرد دخول اللقاح إلى الجسم تبدأ عملية الاستجابة المناعية، فتعمل البروتيزومات على تكسير شريط الرنا المحقون، ومن ثم يتصل به معقد التوافق النسيجي الكبير ويقوم بنقله إلى الغشاء البلازمي، مؤدياً بذلك إلى تنشيط الخلايا المتغصنة التي تعرض المستضد المحقون على خلايا تي (T cells) وخلايا بي (B cells) المناعية التي تؤدي إلى إنتاج أجساماً مضادة لذلك المستضد، وبالتالي توليد مناعة ضده.
كما تتمتع الخلايا غير المناعية في الجسم بقابلية امتصاص لقاح الرنا المرسال، وتوليد استجابة مناعية مشابهة للخلايا المتغصنة المناعية.
وتتم ترجمة معلومات الرنا المحقون الوراثية في السايتوبلازم، وبالتالي فهي لاتؤثر على الدنا الموجود بشكل منعزل في نواة الخلية.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الرنا المرسال
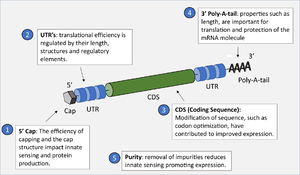
يعد الرنا المكون الرئيسي للقاح مرسال الرنا، وتتم عملية نسخ شريط الرنا مختبرياً من بلازميد الدنا المعدل وراثياً.
يتم نسخ شريط الرنا مختبرياً باستخدام بلازميد الدنا المعدل وراثياً، والحاوي على بوليمرايز الحمض النووي الريبوزي ما يجعله مرادفاً لشريط الرنا الأصلي.
وبذلك يمكن نسخ الرنا في المختبر بمزج بوليمرايز الحمض النووي الرايبوزي مع بلازميد الدنا. ويكون شريط الرنا المحضر مختبرياً مطابق لشريط الرنا الطبيعي.
تعمتد فاعلية اللقاح على تركيب ومدى ثبات شريط الرنا المرسال الذي يتم اعداده.
ويمكن تعديل نيوكليوتيدات الرنا المرسال لتقليل فاعلية المناعة الفطرية وزيادة عمر النصف الحيوي للرنا المرسال المحقون داخل الجسم.
الوصول
لكي يكون اللقاح فعالاً، لابد من دخول كمية من الرنا المرسال إلى سايتوبلازم الخلايا كافية لتحفيز الخلايا المناعية على توليد المستضدات.
يواجه دخول جزيئات الرنا المرسال إلى الخلايا العديد من المصاعب، ففضلاً عن كبر حجم جزيئات الرنا المرسال الذي يحيل دون إمكانية عبورها الغشاء البلازمي، فأن جزيئات الرنا المرسال مشحونة بشحنة كهربائية سالبة تنافر شحنة الغشاء البلازمي السالبة أيضاً.
علاوة على ذلك، فأن جزيئات الرنا المرسال يمكن أن تتحلل بسهولة داخل الجسم بوساطة الإنزيم المحلل للرنا mRNAase الموجود في الجلد والدم.
ومع ذلك، فقد تم تطوير العديد من الطرائق للتغلب على العوائق التي تعيق وصول جزيئات الرنا إلى الخلايا.
وتقسم طرق إعطاء اللقاح مرسال الرنا إلى:
١. التطعيم المباشر:
منذ اكتشاف أن حقن شريط الرنا المنسوخ إلى داخل الجسم مباشرة يؤدي إلى توليد المستضدات وتخليق استجابة مناعية، تم اعتماد هذه الطريقة كطريقة للتطعيم باللقاح. وقد أظهرت هذه الطريقة بعض الفوائد مقارنة بالطريقة السابقة (الحقن مختبرياً)، فهي أقل تكلفة من سابقتها، كما أنها تحاكي العدوى التقليدية للجرثوم المحقون.
وهناك عدة طرائق لحقن اللقاح عبر الجلد، والدم، والعضلات. وتؤدي كل طريقة منها إلى وصول كمية معينة من جزيئات الرنا المرسال إلى الخلايا.
وبالمقارنة بين طرق الحقن المختلفة، أظهرت إحدى الدراسات أن الحقن عبر العقد اللمفاوية يؤدي إلى التحفيز الأكبر لخلايا تي (T cells) المناعية.
٢. التطعيم مختبرياً:
يتم التطعيم مختبرياً عبر استخلاص الخلايا المتغصنة من خلال سحب عينة من دم المريض، وتتم معاملتها مع شريط الرنا المطلوب، ومن ثم إعادة حقنها إلى الجسم لتخليق استجابة مناعية من خلال المستضدات الموجودة على سطح الخلايا المتغصنة التي تتفاعل مع خلايا تي المناعية (T cells).
٣. حُقن الرنا غير المغلف:
يتم التطعيم بهذه الطريقة فقط في محلول متعادل. وقد تم العمل بهذه الطريقة منذ عام 1990. وتم حقن أولى المحاولات بطريقة الحقن داخل الأدمة، أما الآن فقد تم اعتماد طرائق أخرى للحقن منها: تحت الجلد، والحقن الوريدي، والحقن داخل الورم.
ومن عيوب هذه الطريقة، أنها تولد استجابة مناعية ضعيفة نسبياً، كما يتم تحلل الرنا بسرعة بعد حقنه بهذه الطريقة؛ نظراً لكون شريط الرنا المحقون غير مغلف بجزيئات النانو الدهنية التي تساعد خلايا الجسم على امتصاص الرنا.
٤. ناقلات الپوليمرز وناقلات الپپتيد:
يمكن مزج بوليمرات سالبة الشحنة مع جزيئات الرنا المرسال للحصول على ما يسمي بالپوليپليكسيس، والتي تكون مغلفة ومحمية مما يساعد خلايا الجسم على امتصاصها، وتقلل من تحلل الرنا داخل الجسم قبل امتصاصه من قبل الخلايا كما هو الحال في جزيئات الرنا غير المغلفة.
ويستخدم الپروتامين (والذي هو عبارة عن پپتيد كاتيوني (سالب الشحنة) طبيعي) لتغليف جزيئات الرنا المستخدمة في تحضير اللقاح.
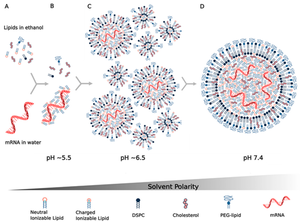
٥. جزيئات النانو الدهنية: وافقت منظمة الغذاء والدواء الأمريكية لأول مرة على استخدام جزيئات النانو الدهنية لتغليف الأدوية في العام 2018، وكانت موافقتها لتغليف دواء أونپاترو لعلاج إعتلال الأعصاب المتعددة، والذي يتركب من الحمض النووي الريبوزي المتداخل الصغير siRNA.
لقد كان تغليف جزيئات الرنا المرسال بجزيئات النانو الدهنية إنجازاً هاماً لتحضير لقاحات الرنا، والتغلب على الكثير من العوائق التي تحول دون وصول اللقاح المحقون إلى خلايا المضيف.
كما كانت الدراسات المُعدّة حول إمكانية تغليف جزيئات الحمض النووي الريبوزي المتداخل الصغير siRNA بجزيئات النانو الدهنية ونتائجها، الحجر الأساس لدراسات متعلقة بإمكانية تغليف جزيئات الرنا المرسال mRNA بذات الجزيئات. ومع ذلك، فقد تم استخدام نوع آخر من الدهون لتحضير جزيئات النانو الدهنية لتغليف شريط الرنا المرسال mRNA مختلف عن النوع المستخدم لتغليف الحمض النووي الريبوزي المتداخل الصغير siRNA؛ نظراً لكون شريط الرنا المرسال mRNA أطول بكثير من شريط الحمض النووي الريبوزي المتداخل الصغير siRNA.
توفر جزيئات النانو الدهنية بشكل أساسي حماية جزيئات الرنا من التحلل داخل الجسم قبل حصول الامتصاص الخلوي، وبالتالي تتيح للخلايا امتصاصها وتخليق استجابة مناعية.
ويمكن حقن جزيئات النانو الدهنية، بعدة طرق منها الحقن الوريدي والحقن عبر الجهاز اللمفاوي.
٦. النواقل الڤيروسية:
فضلاً عن الطرق غير الفيروسية لحقن لقاح الرنا المرسال، فأنه يمكن تعديل بعض فيروسات الحمض النووي الفيروسي جينياً واستخدامها كلقاحات لتخليق استجابة مناعية مشابهة لتلك التي تولدها الطرق غير الڤيروسية.
ومن ڤيروسات الحمض النووي الريبوزي المستخدمة كنواقل ڤيروسية: الڤيروس الراجع أو الڤيروس الرجوعي، والڤيروس البطيء، وڤيروس ألفا، والڤيروسات الربدية.
ويختلف كل منها من حيث التركيب والوظيفة. وقد أُجريت تجارب سريرية على الحيوانات كالفئران، والدجاج، والقردة باستخدام ڤيروسات مختلفة كمضادات لأمراض مختلفة.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الفوائد
اللقاحات التقليدية
تمتاز لقاحات الرنا المرسال على اللقاحات التقليدية بكونها غير معدية؛ كونها لا تستخلص من ڤيروس حي أو حتى ڤيروس موهن. بينما يتم تحضير اللقاحات التقليدية من الجرثوم المضادة له نفسه، وبذلك فأنها قد تكون معدية وتؤدي إلى جائحة وبائية إذا ما حقنت بكميات كبيرة.
ومن مزايا لقاحات الرنا المرسال الأخرى، أنها تؤدي إلى تحفيز كل من المناعة الخلوية والمناعة الخلطية؛ وذلك لكون المستضدات يتم تخليقها بشكل مباشر داخل الخلايا باستخدام هذا اللقاح.
كما أنه يمكن تحضير هذا النوع من اللقحات بسرعة عالية نسبياً، فقد تم تحضير لقاح مودرينا (mRNA 1273) المضاد لڤيروس كورونا كوڤيد - 19 في غضون يومين فقط.
وبالتالي فهو سهل وسريع التحضير، وذو تكلفة مادية منخفضة إذا ماقورنت باللقاحات التقليدية، كما أنه يتمتع بمنط عالي الثباتية (مما يقلل من أخطاء الانتاج). كل ذلك يجعله حلاً هاماً في القضاء على الجوائح الوبائية.
استغرق تحضير لقاح فايزر - بيونتيك لأول مرة 110 يوماً، ثم عملت فايزر على تسريع فترة التصنيع إلى 60 يوماً. وبذلك يكون تصنيع لقاح فايزر - بيونتيك أسرع من تحضير لقاح الإنفلونزا، ولقاح شلل الأطفال. وخلال هذا الإطار الزمني الطويل نسبياً، فإن المدة الفعلية لإنتاج اللقاح هي فقط 22 يوماً:
• إسبوعان لل استنساخ الجزيئي لپلازميد الدنا، وتنقيته.
• 4 أيام لترجمة شريط الدنا إلى شريط الرنا، وتنقية الرنا المرسال من شريط الرنا الناتج.
• 4 أيام لتغليف جزيئات الرنا المرسال بجزيئات النانو الدهنية، ويعقب ذلك عملية التعبئة.
ويتم تخصيص غالبية الأيام اللازمة لكل عملية إنتاج لمراقبة الجودة الصارمة في كل مرحلة.
لقاحات الدنا
بالإضافة إلى المزايا والفوائد المشتركة بين لقاحات الدنا والرنا المرسال المتفوقة على خصائص وفوائد اللقاحات التقليدية، فأن لقاح مرسال الرنا متفوق أيضاً على لقاحات الدنا. تتم عملية ترجمة الرنا المرسال في سيتوسول الخلية (عصارة الخلية)، وبذلك فهو لايتطلب دخول الرنا إلى نواة الخلية وما ينتج عن دخوله من مخاوف التداخل مع الجينوم في نواة الخلية.
العيوب
التخزين
نظراً لرقة وضعف تركيب شريط الحمض النووي الريبوزي المرسال، فإن بعض لقاحاته تتطلب الحفظ في درجة حرارة منخفضة جداً؛ لتجنب تحللها والتأثير على فاعليتها. فعلى سبيل المثال: يتطلب حفظ لقاح فايزر - بيونتيك درجة حرارة تتراوح بين 80 - 60 درجة مؤية تحت الصفر.
الآثار العكسية الضارة
لم تكن هناك أية تقنية أو ترخيص لتصنيع واستخدام الرنا المرسال بشرياً قبل العام 2020.
ومع اجتياح جائحة كورونا في مطلع العام 2020، باتت الحاجة ملحة إلى تحضير لقاح سريع لاحتواء الجائحة، وبالتالي تم اللجوء إلى تحضير لقاحات الرنا المرسال، واستحداث الموافقة الطارئة على ترخيص استخدامها بعد ثمانية أسابيع فقط من اختبار تجاربها السريرية النهائية.
وفيما يتعلق بتأثيرات اللقاح العكسية وآثاره العكسية الضارة، فإن آثاره العكسية مشابهة لما هي عليه في اللقاحات التقليدي غير المعتمدة على الرنا المرسال في تصنيعها. وتشمل تلك التأثيرات: الألم والاحمرار أو التورم حول موضع حقن اللقاح، كما قد يشعر المتلقي بالتعب أو الصداع أو ارتفاع درجة الحرارة.
ويعتبر الأشخاص المصابون بأمراض المناعة الذاتية هم الفئة المعرضة لتطوير أثر عكسي ضار بعد التطعيم.
الفاعلية والكفاءة
أظهرت الدراسات أن لقاحات موديرنا وفايزر - بيونيك الأمريكيين المضادين لڤيروس كورونا كوفيد - 19 فعالين بنسبة 90 - 95%.
فيما كانت جميع محاولات السابقة لاختبار الأدوية المعتمدة على الرنا المرسال في تركيبها غير فعالة، وتم إهمالها في أطوار الاختبار المبكرة. علماً أن سبب نجاح وفاعلية اللقاح مرسال الرنا الجديد غير معروف.
مغالطات حول اللقاح
هناك انتشار لشائعات ومعلومات مغلوطة حول لقاحات الرنا المرسال المضادة لڤيروس كورونا مفادها، أن لقاحات الرنا المرسال تؤدي إلى تغيير تركيب الدنا في نواة الخلية.
والواقع أن شريط الرنا يتم تحلله وترجمته بسرعة داخل عصارة الخلية قبل أن يتمكن من دخول النواة الحاوية على الدنا.
إن الڤيروس الراجع أو الرجوعي ذو الرنا أحادي السلسلة، ومثله اللقاح المضاد لڤيروس سارس كوفيد - 2 الأحادي الرنا أيضاً لهما القدرة على دخول النواة واستخدام إنزيم النسخ العكسي لتصنيع الدنا داخل النواة من شريط الرنا.
وبذلك يكون الڤيروس الراجع أو الرجوعي هو ڤيروس الحمض النووي الريبوزي الوحيد القادر على دخول النواة وتخليق الدنا، بينما لا تمتلك باقي ڤيروسات الرنا تلك القابلية؛ ويعود السبب في ذلك إلى أن عملية تخليق الدنا داخل النواة باستخدام شريط الرنا لاتتم إلا بوجود الپرايمر الموجود في الڤيروس الراجع أو الرجوعي دون بقية ڤيروسات الرنا.
الأنواع
يوجد نوعان رئيسيان من لقاحات الرنا المرسال:
• لقاح الرنا التقليدي (غير المضخم): كما في لقاحي فايزر - بيونتيك وموديرنا المضادين لڤيروس كورونا. وفي هذا النوع من اللقاحات تكون كمية الرنا الممتصة والمستخدمة من قبل الخلايا مكافئة للكمية المحقونة.
• لقاح الرنا المضخم ذاتياً: تعمل بنفس آلية عمل اللقاحات غير المضخمة، باستثناء قدرتها على مضاعفة شريط الرنا ذاتياً. وبالتالي فإن هذا النوع من اللقاحات يتطلب حقن كميات قليلة الرنا المرسال التي سيتم مضاعفتها داخل الخلايا بعد التطعيم.
وما تزال الأبحاث والدراسات جارية حول تطوير كلا النوعين، وتصنيع لقاحات جديدة مضادة لأنواع أخرى من الجراثيم والخلايا السرطانية. فهناك محاولات لتحضير لقاح مضاد للملاريا يعمل بتقنية التضخيم الذاتي.
انظر أيضاً
المصادر
قراءات إضافية
- Sahin U, Karikó K, Türeci Ö (October 2014). "mRNA-based therapeutics--developing a new class of drugs". Nat Rev Drug Discov. 13 (10): 759–80. doi:10.1038/nrd4278. PMID 25233993.
- Dolgin E (14 September 2021). "The tangled history of mRNA vaccines". Nature. 597 (9): 318–324. doi:10.1038/d41586-021-02483-w. PMID 34522017.
وصلات خارجية
- "Five things you need to know about: mRNA vaccines". Horizon.
- "RNA vaccines: an introduction". PHG Foundation. University of Cambridge.
- "Understanding mRNA COVID-19 Vaccines". Centers for Disease Control and Prevention. 4 March 2021.
- "Understanding and Explaining mRNA COVID-19 Vaccines". Centers for Disease Control and Prevention. 4 March 2021.
- M.I.T. Lecture 10: Kizzmekia Corbett, Vaccines" at YouTube
- xkcd webcomic explaining how the vaccine works using Star Wars characters and situations.