فوق منغنات الصوديوم
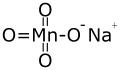
| |
| |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Sodium manganate(VII)
| |
| أسماء أخرى
Sodium permanganate, permanganate of sodium
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.030.215 |
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | NaMnO4 |
| كتلة مولية | 141.9254 g/mol 159.94 g/mol (monohydrate) |
| المظهر | Red solid |
| الكثافة | 1.972 g/cm3 (monohydrate) |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | 90 g/100 mL |
| المخاطر | |
| خطر رئيسي | Oxidizer |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
فوق منگنات الصوديوم أو برمنگنات الصوديوم مركب كيميائي له الصيغة NaMnO4 ، ويكون على شكل بلورات حمراء بنفسجية. عدد أكسدة المنگنيز في هذا المركب +7 ، وهو من المؤكسدات القوية.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص
- يشبه مركب فوق منگنات الصوديوم بخواصه المؤكسدة مركب فوق منگنات البوتاسيوم المستخدم بشكل أكبر، وذلك لانخفاض سعره بالمقارنة مع فوق منگنات الصوديوم.
- انحلالية مركب فوق منگنات الصوديوم كبيرة جداً، وله خاصة استرطاب كبيرة أيضاً.
- يتفكك فوق منگنات الصوديوم بالتسخين مطلقاً غاز الأكسجين.
التحضير
يحضر عن طريق فوق منگنات البوتاسيوم، ولا يحضر بشكل مباشر من تفاعل ثنائي أكسيد المنگنيز مع هيدروكسيد الصوديوم، وذلك بسبب عدم تشكل ملح Na2MnO4 الوسطي الضروري لعملية التحضير.
الاستخدامات
- لا يستخدم بشكل مكثف في الكيمياء التحليلية مثل فوق منگنات البوتاسيوم بسبب تميه البلورات بسبب الاسترطاب.
- بسبب خواصه المؤكسدة القوية وانحلاليته العالية تستعمل محاليله المائية في تخريش اللوح أثناء تحضير اللوحة الإلكترونية المطبوعة [1].
منگنات الصوديوم
منگنات الصوديوم وهو مركب له الصيغة Na2MnO4 حيث للمنگنيز رقم أكسدة +6، وهو على شكل بلورات خضراء وله كتلة مولية مقدارها 141.93 غ/مول. يحضر من تفاعل ثنائي أكسيد المنگنيز مع هيدروكسيد الصوديوم بدرجات حرارة مرتفعة. كما ينتج من تفاعل اختزال فوق منگنات الصوديوم بشروط قاعدية حسب المعادلة:
- 4NaOH + 4NaMnO4 → 4Na2MnO4 + 2H2O + O2
المراجع
- ^ Arno H. Reidies "Manganese Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a16_123