خلية مستقبلة للضوء
| الخلية المستقبلة للضوء | |
|---|---|
 الأجزاء الوظيفية من الخلايا العصوية والمخروطية، وهما اثنتان من الأنواع الثلاث للخلايا الحساسة للضوء في الشبكية. | |
| Identifiers | |
| MeSH | D010786 |
| NeuroLex ID | sao226523927 |
| FMA | 85613 86740، 85613 |
| المصطلحات التشريحية | |
الخلية المستقبلة للضوء (إنگليزية: photoreceptor cell)، هي نوع متخصص من الخلايا الظهارية العصبية الموجودة في شبكية العين والقادرة على النقل الضوئي البصري . تكمن الأهمية البيولوجية الكبيرة للمستقبلات الضوئية في أنها تحول الضوء ( الإشعاع الكهرومغناطيسي المرئي) إلى إشارات يمكنها تحفيز العمليات البيولوجية. لكي نكون أكثر تحديدًا ، البروتينات المستقبلة للضوء في الخلية تمتص الفوتونات ، مما يؤدي إلى حدوث تغيير في كمونات غشاء الخلية..
يوجد حاليًا ثلاثة أنواع معروفة من الخلايا المستقبلة للضوء في عيون الثدييات: الخلايا النبوتية (الخلايا العصوية) ، والمخروطية ، والخلايا العقدية الشبكية الحساسة للضوء . خليتا المستقبلات الضوئية الكلاسيكيتان هما عصوية ومخروطية ، كل منها يساهم بالمعلومات التي يستخدمها النظام البصري لتشكيل تمثيل للعالم المرئي ، البصر . تساهم النبوتية في المقام الأول في الرؤية الليلية (ظروف ليلية) بينما تساهم المخاريط بشكل أساسي في الرؤية النهارية (الظروف الضوئية) ، لكن العملية الكيميائية في كل منها التي تدعم النقل الضوئي متشابهة.[1] تم اكتشاف فئة ثالثة من الخلايا المستقبلة للضوء في الثدييات خلال التسعينيات::[2] الخلايا العقدية الشبكية الحساسة للضوء جوهريًا. يُعتقد أن هذه الخلايا لا تساهم في الرؤية بشكل مباشر ، ولكن لها دور في إيقاع الساعة البيولوجية ومنعكس الحدقة.
هناك اختلافات وظيفية كبيرة بين العصويات والمخاريط. العصويات حساسة للغاية ويمكن تحفيزها بفوتون واحد .[3][4] في مستويات الإضاءة المنخفضة للغاية ، تعتمد التجربة البصرية فقط على إشارة الخلية العصوية..
تتطلب الخلايا المخروطية ضوءًا أكثر سطوعًا (أي عددًا أكبر من الفوتونات) لإنتاج إشارة. في البشر ، هناك ثلاثة أنواع مختلفة من الخلايا المخروطية ، تتميز بنمط استجابتها للضوء ذي الأطوال الموجية المختلفة. يتم حساب تجربة اللون من هذه الإشارات الثلاث المميزة ، ربما عبر نظرية اللون المضاد ..[5] وهذا يفسر سبب عدم إمكانية رؤية الألوان عند مستويات الإضاءة المنخفضة ، عندما تكون الخلايا المستقبلة للضوء هي العصوية فقط وليس المخروطية. تستجيب الأنواع الثلاثة من الخلايا المخروطية (تقريبًا) للضوء ذي الأطوال الموجية القصيرة والمتوسطة والطويلة ، لذلك يمكن الإشارة إليها على التوالي باسم S-cones و M-cones و L-cones..
وفقًا لمبدأ التباين الأحادي ، فإن إطلاق الخلية يعتمد فقط على عدد الفوتونات الممتصة. يتم تحديد الاستجابات المختلفة للأنواع الثلاثة من الخلايا المخروطية من خلال احتمالية امتصاص البروتينات المستقبلة للضوء الخاصة بها فوتونات ذات أطوال موجية مختلفة. لذلك ، على سبيل المثال ، تحتوي الخلية المخروطية L على بروتين مستقبِل للضوء يمتص بسهولة أطوال موجية طويلة من الضوء (أي أكثر "أحمر"). يمكن أن ينتج الضوء ذو الطول الموجي الأقصر أيضًا نفس الاستجابة من خلية L مخروطية ، ولكن يجب أن يكون أكثر سطوعاً للقيام بذلك.
تحتوي شبكية العين البشرية على حوالي 120 مليون خلية نبوتية ، و 6 ملايين خلية مخروطية. يختلف عدد ونسبة العصي إلى المخاريط باختلاف الأنواع ، ويعتمد ذلك على ما إذا كان الحيوان في المقام الأول نهاريًا أم ليليًا . بعض أنواع البوم ، مثل البومة السمراء الليلية,[6] لديها عدد هائل من العصي في شبكية العين. في النظام البصري البشري ، بالإضافة إلى العصي والمخاريط الحساسة للضوء ، هناك حوالي 2.4 مليون إلى 3 ملايين خلية عقدية ، 1 إلى 2٪ منها حساسة للضوء. تشكل محاور الخلايا العقدية العصبين البصريين.
عادة ما يتم ترتيب خلايا المستقبلات الضوئية في شبكة غير منتظمة ولكنها سداسية تقريبًا ، تُعرف باسم فسيفساء الشبكية .
الغدد الصنوبرية والمجاورة للصنوبرية تستقبل الضوء في الفقاريات غير الثديية ، ولكن ليس في الثدييات. تحتوي الطيور على خلايا عصبية موصلة للسائل الدماغي الشوكي (CSF) داخل العضو المجاور للبطين والتي تستجيب للضوء في حالة عدم وجود مدخلات من العين أو الناقلات العصبية..[7] تختلف المستقبلات الضوئية اللافقارية في الكائنات الحية مثل الحشرات والرخويات في كل من تنظيمها المورفولوجي ومساراتها الكيميائية الحيوية الكامنة. توضح هذه المقالة مستقبلات الضوء البشرية
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
علم الانسجة
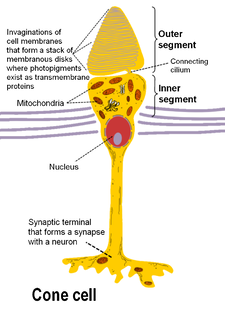
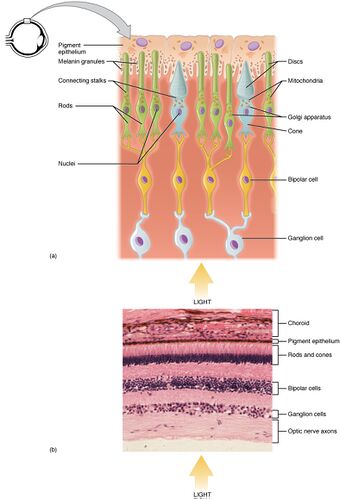
الخلايا المستقبلة للضوء النبوتية و المخروطية توجد على الطبقة الخارجية لشبكية العين . كلاهما لهما نفس البنية الأساسية. الأقرب إلى المجال البصري (والأبعد من الدماغ) هي المحطة المحورية ، التي تطلق ناقلًا عصبيًا يسمى الغلوتامات إلى الخلايا ثنائية القطب . في الخلف يوجد جسم الخلية الذي يحتوي على عضيات الخلية. في الخلف لا يزال الجزء الداخلي ، وهو جزء متخصص من الخلية مليء بالمتقدرة . تتمثل الوظيفة الرئيسية للجزء الداخلي في توفير أدينوسين ثلاثي الفوسفات (الطاقة) لمضخة الصوديوم والبوتاسيوم . أخيرًا ، الأقرب إلى الدماغ (والأبعد عن مجال الرؤية) هو الجزء الخارجي ، وهو جزء من المستقبلات الضوئية التي تمتص الضوء . الأجزاء الخارجية هي في الواقع أهداب معدلة[9][10] تحتوي على أقراص مملوءة بالأوبسين ، وهو الجزيء الذي يمتص الفوتونات ، بالإضافة إلى قنوات الصوديوم ذات الجهد الكهربائي.
يحتوي بروتين أوبسين الغشائي المستقبِل للضوء على جزيء صبغي يسمى شبكية العين . في الخلايا العصوية ، يسمى هذه معًا رودوبسين . في الخلايا المخروطية ، توجد أنواع مختلفة من الأوبسين تتحد مع شبكية العين لتكوين أصباغ تسمى فوتوبسين . تتفاعل ثلاث فئات مختلفة من الفوتوبسين في الخلايا المخروطية مع نطاقات مختلفة من تردد الضوء ، وهو تمايز يسمح للنظام المرئي بحساب اللون . تتمثل وظيفة خلية المستقبلات الضوئية في تحويل المعلومات الضوئية للفوتون إلى شكل من المعلومات التي يمكن توصيلها إلى الجهاز العصبي ويمكن استخدامها بسهولة للكائن الحي: يسمى هذا التحويل تحويل الإشارة .
يُطلق على الأوبسين الموجود في الخلايا العقدية الحساسة للضوء في شبكية العين اسم الميلانوبسين . تشارك هذه الخلايا في الاستجابات الانعكاسية المختلفة للدماغ والجسم لوجود ضوء (النهار) ، مثل تنظيم إيقاعات الساعة البيولوجية ومنعكس الحدقة وغيرها من الاستجابات غير المرئية للضوء. يشبه الميلانوبسين وظيفيًا الأوبسين اللافقاري.
عندما ينشط الضوء نظام إشارات الميلانوبسين ، تقوم الخلايا العقدية المحتوية على الميلانوبسين بإفراز النبضات العصبية التي يتم إجراؤها من خلال محاورها إلى أهداف دماغية محددة. تشمل هذه الأهداف النواة الزيتونية اما السقف (مركز مسؤول عن التحكم في حدقة العين) ، و النواة الركبية الوحشية ، ومن خلال القناة الشبكية الوريدية (RHT) ، نواة فوق التصالبة لمنطقة ما تحت المهاد (منظم ضربات القلب الرئيسي لإيقاعات الساعة البيولوجية). يُعتقد أن الخلايا العقدية المحتوية على الميلانوبسين تؤثر على هذه الأهداف من خلال إطلاق النواقل العصبية الغلوتامات وحلقية الغدة النخامية للببتيد (PACAP) من محطاتها المحورية.
البشر
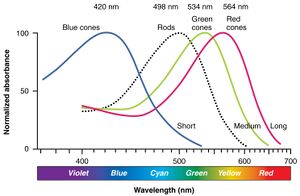

تحتوي شبكية العين البشرية على ما يقرب من 6 ملايين خلية مخروطية و 120 مليون خلية عصوية.[13] تتلاقى الإشارات من العصويات والمخاريط على الخلايا العقدية والخلايا ثنائية القطب من أجل المعالجة المسبقة قبل إرسالها إلى النواة الركبية الجانبية . في "مركز" الشبكية (النقطة الواقعة خلف العدسة مباشرة) تقع النقرة (أو النقرة المركزية) ، والتي تحتوي فقط على خلايا مخروطية ؛ وهي المنطقة القادرة على إنتاج أعلى دقة بصرية أو أعلى دقة . عبر بقية شبكية العين ، تتداخل العصويات والمخاريط. لم يتم العثور على مستقبلات ضوئية في النقطة العمياء ، وهي المنطقة التي يتم فيها تجميع ألياف الخلايا العقدية في العصب البصري وترك العين.[14]
تختلف بروتينات المستقبلات الضوئية في الأنواع الثلاثة للمخاريط في حساسيتها للفوتونات ذات الأطوال الموجية المختلفة (انظر الرسم البياني). نظرًا لأن المخاريط تستجيب لكل من الطول الموجي وشدة الضوء ، يتم قياس حساسية المخروط لطول الموجة من حيث معدل الاستجابة النسبي إذا كانت شدة المنبه ثابتة ، بينما يتنوع الطول الموجي. من هذا ، بدوره ، يتم استنتاج الامتصاص.[15] يقوم الرسم البياني بتعديل درجة الامتصاصية على مقياس مائة نقطة. على سبيل المثال ، تبلغ الاستجابة النسبية للمخروط S ذروتها حوالي 420 نانومتر (نانومتر ، مقياس الطول الموجي). يخبرنا هذا أنه من المرجح أن يمتص المخروط S فوتونًا عند 420 نانومتر عن أي طول موجي آخر. إذا كان الضوء ذو طول موجي مختلف وهو أقل حساسية ، فلنقل 480 نانومتر ، في السطوع بشكل مناسب ، ومع ذلك ، فإنه سينتج نفس الاستجابة بالضبط في مخروط S. لذا ، فإن ألوان المنحنيات مضللة. لا تستطيع المخاريط اكتشاف اللون من تلقاء نفسها ؛ بدلاً من ذلك ، تتطلب رؤية الألوان مقارنة الإشارة عبر أنواع المخروط المختلفة.
التحويل الضوئي
تحدث عملية التحويل الضوئي في شبكية العين. تحتوي شبكية العين على طبقات عديدة من أنواع مختلفة من الخلايا. تشكل الخلايا المستقبِلة للضوء ( النبوتية والمخروطية ) الأكثر عددًا الطبقة الخارجية. هذه هي المستقبلات الضوئية المسؤولة عن التواسط في الرؤية الحسية. تحتوي الطبقة الوسطى للشبكية على خلايا ثنائية القطب ، تجمع الإشارات من المستقبلات الضوئية وتنقلها إلى الخلايا العقدية للشبكية في الطبقة الداخلية للشبكية. تشكل محاور الخلايا العقدية للشبكية مجتمعة العصب البصري ، والتي من خلالها تتجه إلى الدماغ.. [13]
على عكس معظم خلايا المستقبلات الحسية ، تصبح المستقبلات الضوئية في الواقع مفرطة الاستقطاب عند تحفيزها ؛ وعلى العكس من ذلك يتم إزالة الاستقطاب عند عدم تحفيزها. وهذا يعني أن الغلوتامات يتم إطلاقها بشكل مستمر عندما لا يتم تحفيز الخلية ، ويتسبب التحفيز في توقف الإطلاق. في الظلام ، تحتوي الخلايا على تركيز مرتفع نسبيًا من الغوانوزين الحلقي 3'-5 'أحادي الفوسفات (cGMP) ، والذي يفتح قنوات أيونية ذات بوابات cGMP . هذه القنوات غير محددة ، مما تسمح بحركة أيونات الصوديوم والكالسيوم عند فتحها. حركة هذه الأيونات الموجبة الشحنة في الخلية (مدفوعة بالتدرج الكهروكيميائي الخاص بها ) تزيل استقطاب الغشاء ، وتؤدي إلى إطلاق الناقل العصبي الغلوتامات .
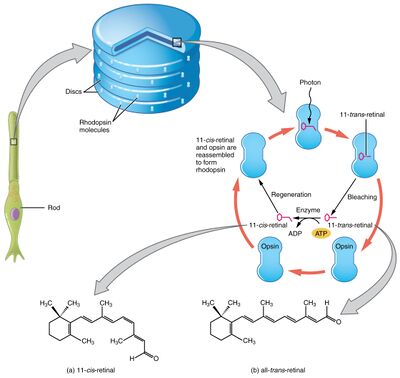
عندما يصطدم الضوء بصبغة مستقبلة للضوء داخل خلية مستقبلة للضوء ، يتغير شكل الصباغ. يتكون الصباغ ، المسمى يودوبسين أو رودوبسين ، من بروتينات كبيرة تسمى أوبسين (تقع في غشاء البلازما) ، مرتبطة بمجموعة ضميمة مرتبطة تساهميًا: جزيء عضوي يسمى شبكية (أحد مشتقات فيتامين A). توجد الشبكية في شكل ريتينال -11عندما تكون في الظلام ، ويؤدي التحفيز بالضوء إلى تغيير هيكلها إلى الريتينال المفروق. هذا التغيير الهيكلي يسبب أوبسين ( مستقبل مقترن بالبروتين ج ) لتنشيط تحويل بروتين G لها ، الذي يؤدي إلى تنشيط المركب الغوانوزين الحلقي 3'-5 'أحادي الفوسفات فسفودايستراز ، الذي يكسر المركب وصولا إلى الغوانوزين الحلقي احادي الفوسفات-5'. يسمح الانخفاض في الغوانوزين الحلقي 3'-5 'أحادي الفوسفات للقنوات الأيونية بالإغلاق ، ومنع تدفق الأيونات الموجبة ، وفرط استقطاب الخلية ، ووقف إطلاق الناقلات العصبية.[16] العملية الكاملة التي يبدأ بها الضوء استجابة حسية تسمى التحويل الضوئي البصري.
التيار المظلم
قنوات النوكليوتيدات الحلقية غير المحفزة (في الظلام) في الجزء الخارجي مفتوحة لأن الغوانوزين احادي الفوسفات الحلقي (cGMP) مرتبط بها. ومن ثم ، تدخل الأيونات الموجبة الشحنة (أي أيونات الصوديوم ) إلى المستقبلات الضوئية ، مما يؤدي إلى إزالة الاستقطاب إلى حوالي 40 ملي فولت (عادةً ما يكون جهد الراحة في الخلايا العصبية الأخرى 65 ملي فولت). غالبًا ما يُعرف التيار الكهربي إزالة الاستقطاب هذا بالتيار المظلم.
مسار تحويل الإشارة
مسار تحويل الإشارة هو الآلية التي تشير بها طاقة الفوتون إلى آلية في الخلية تؤدي إلى استقطابها الكهربائي. يؤدي هذا الاستقطاب في النهاية إما إلى نفاذية أو تثبيط الإشارة العصبية التي سيتم تغذيتها إلى الدماغ عبر العصب البصري . الخطوات ، أو مسار تحويل الإشارة ، في نبوتية العين الفقارية والمستقبلات الضوئية المخروطية هي:
- يمتص رودوبسين أو اليودوبسين الموجود في الغشاء القرصي للجزء الخارجي الفوتون ، ويغير تكوين العامل المساعد لقاعدة شيف الشبكية داخل البروتين من شكل الريتنال إلى الشكل الريتنال المفروق ، مما يتسبب في تغيير شكل الشبكية.
- ينتج عن هذا سلسلة من المتوسطات الغير المستقرة ، وآخرها يرتبط بشكل أقوى ببروتين G في الغشاء ، يسمى المحول ، وينشطه. هذه هي الخطوة الأولى للتضخيم - كل رودوبسين منشط ضوئيًا يؤدي إلى تنشيط حوالي 100 من المحولات.
- ثم ينشط كل محول إنزيم فوسفوديستيراز (PDE) الخاص بـ cGMP.
- ثم يحفز فوسفوديستيراز حلمهة الـ cGMP إلى 5 'GMP. هذه هي خطوة التضخيم الثانية ، حيث يحلل فوسفوديستيراز واحد حوالي 1000 جزيء cGMP.
- يتم تقليل التركيز الصافي لـ cGMP داخل الخلايا (بسبب تحويله إلى 5 'GMP عبر فوسفوديستيراز) ، مما أدى إلى إغلاق قنوات أيونات الصوديوم الحلقية ذات النوكليوتيدات الحلقية الموجودة في غشاء الجزء الخارجي للمستقبل الضوئي.
- ونتيجة لذلك ، لم تعد أيونات الصوديوم قادرة على دخول الخلية ، ويصبح غشاء الجزء الخارجي للمستقبلات الضوئية مفرط الاستقطاب ، نظرًا لأن الشحنة داخل الغشاء تصبح أكثر سلبية.
- يؤدي هذا التغيير في جهود غشاء الخلية إلى إغلاق قنوات الكالسيوم ذات الجهد الكهربائي. هذا يؤدي إلى انخفاض في تدفق أيونات الكالسيوم إلى الخلية وبالتالي ينخفض تركيز أيون الكالسيوم داخل الخلايا.
- يعني الانخفاض في تركيز الكالسيوم داخل الخلايا أنه يتم إطلاق كمية أقل من الغلوتامات عبر الإيماس الناجم عن الكالسيوم إلى الخلية ثنائية القطب (انظر أدناه). (يؤدي انخفاض مستوى الكالسيوم إلى إبطاء إطلاق الناقل العصبي الغلوتامات ، والذي يثير الخلايا ثنائية القطب والخلايا الأفقية بعد المشبكي. )
- يعني الانخفاض في إطلاق الغلوتامات أن مجموعة واحدة من الخلايا ثنائية القطب ستزول الاستقطاب وستكون مجموعة منفصلة من الخلايا ثنائية القطب مفرطة الاستقطاب ، اعتمادًا على طبيعة المستقبلات ( مستقبل أيونوتروبي أو مستقبل تحولي ) في النهاية ما بعد المشبكي (انظر مجال الاستقبال ).
وبالتالي ، فإن المستقبلات الضوئية النبويتة أو المخروطي تطلق فعليًا ناقلًا عصبيًا أقل عندما يحفزها الضوء. يعمل ناقل عصبي أقل في الشق المشبكي بين مستقبلات ضوئية وخلية ثنائية القطب إما على إثارة (إزالة الاستقطاب) على الخلايا ثنائية القطب أو تثبيط (فرط الاستقطاب) الخلايا ثنائية القطب. وبالتالي ، فإنه في المشبك الخلوي ثنائي القطب حيث يتم تقسيم الإشارات البصرية إلى مسارات ON و OFF.[17]
يتم توفير أدينوسين ثلاثي الفوسفات بواسطة الجزء الداخلي لتشغيل مضخة الصوديوم والبوتاسيوم. هذه المضخة ضرورية لإعادة ضبط الحالة الأولية للجزء الخارجي عن طريق أخذ أيونات الصوديوم التي تدخل الخلية وضخها للخارج.
وعلى الرغم من ان المستقبلات الضوئية هي الخلايا العصبية، فإنها لا تجري إمكانات الفعل مع استثناء من الخلايا العقدية الحساسة للضوء - التي تشارك بشكل رئيسي في تنظيم إيقاع يوماوي ، الميلاتونين، واتساع حدقة العين.
المزايا
يعد التحويل الضوئي في النبوتية والمخاريط أمرًا غير معتاد إلى حد ما من حيث أن المنبه (في هذه الحالة ، الضوء) يقلل من استجابة الخلية أو معدل الإطلاق ، وهو يختلف عن معظم الأنظمة الحسية الأخرى التي يزيد فيها المنبه من استجابة الخلية أو معدل إطلاقها. هذا الاختلاف له عواقب وظيفية مهمة:
أولاً ، يتم إزالة استقطاب المستقبل الضوئي الكلاسيكي (عصوي (نبوتي) أو مخروط) في الظلام ، مما يعني أن العديد من أيونات الصوديوم تتدفق إلى الخلية. وبالتالي ، فإن الفتح أو الإغلاق العشوائي لقنوات الصوديوم لن يؤثر على جهود غشاء الخلية ؛ فقط إغلاق عدد كبير من القنوات ، من خلال امتصاص الفوتون ، سيؤثر عليه ويشير إلى أن الضوء في المجال البصري. قد يكون لهذا النظام ضوضاء أقل بالنسبة لمخطط التحويل الحسي الذي يزيد من معدل إطلاق الأعصاب استجابةً للمحفزات ، مثل اللمس والشم .
ثانيًا ، هناك الكثير من التضخيم في مرحلتين من التحويل الضوئي الكلاسيكي: صباغ واحدة ستنشط العديد من جزيئات المحولات ، وسيقوم فوسفودايستراز واحد بتقسيم العديد من cGMPs. يعني هذا التضخيم أنه حتى امتصاص فوتون واحد سيؤثر على جهود الغشاء ويرسل إشارة إلى الدماغ بأن الضوء موجود في المجال البصري. هذه هي السمة الرئيسية التي تميز مستقبلات ضوئية عصوية عن مستقبلات ضوئية مخروطية. العصي حساسة للغاية ولديها القدرة على تسجيل فوتون واحد من الضوء ، على عكس المخاريط. من ناحية أخرى ، من المعروف أن المخاريط لها حركيات سريعة جدًا من حيث معدل تضخيم النقل الضوئي ، على عكس العصويات (النبوتيات).
الفرق بين الخلايا العصوية والمخروطية
مقارنة بين الخلايا المخروطية والعصوية ، من إريك كاندل وأخرون. في مبادئ العلوم العصبية.[16]
| العصي | المخاريط |
|---|---|
| تستخدم للرؤية الظلامية (الرؤية تحت ظروف الإضاءة المنخفضة) | تستخدم لرؤية ضيائية (الرؤية تحت ظروف الإضاءة عالية) |
| حساس جدا للضوء حساسة للضوء المتناثر | ليست حساسة جدا للضوء ؛ حساسة فقط للضوء المباشر |
| الفقد يسبب العمى الليلي | الخسارة تسبب العمى القانوني |
| انخفاض حدة البصر | حدة البصر العالية دقة مكانية أفضل |
| غير موجود في النقرة | يتركز في النقرة |
| استجابة بطيئة للضوء ، تضاف المنبهات بمرور الوقت | الاستجابة السريعة للضوء ، يمكن أن تدرك التغيرات السريعة في المنبهات |
| تحتوي على صبغة أكثر من المخاريط ، لذلك يمكنها الكشف عن مستويات الضوء المنخفضة | تحتوي على صبغة أقل من العصويات ، وتتطلب المزيد من الضوء لاكتشاف الصور |
| أكوام الأقراص المغلقة بغشاء غير مرتبطة بغشاء الخلية مباشرة | الأقراص متصلة بالغشاء الخارجي |
| حوالي 120 مليون عصوي موزعة حول الشبكية[13] | حوالي 6 ملايين مخروطية موزعة في كل شبكية[13] |
| نوع واحد من الأصباغ الحساسة للضوء | ثلاثة أنواع من الأصباغ الحساسة للضوء في البشر |
| تمنح رؤية عديمة اللون | تمنح رؤية اللون |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الوظيفة
المستقبلات الضوئية تستقبل اشارة اللون ؛ إنها تشير فقط إلى وجود الضوء في المجال البصري.
يستجيب مستقبل ضوئي معين لكل من الطول الموجي وشدة مصدر الضوء. على سبيل المثال ، يمكن أن ينتج الضوء الأحمر عند شدة معينة نفس الاستجابة الدقيقة في مستقبلات الضوء مثل الضوء الأخضر ذي الشدة المختلفة. لذلك ، فإن استجابة مستقبل ضوئي واحد غامضة عندما يتعلق الأمر باللون.
التطور
يتم تحفيز الأحداث الرئيسية التي تتوسط الخلية العصوية مقابل المخروطية S مقابل تمايز مخروط M بواسطة عدة عوامل نسخ ، بما في ذلك RORbeta و OTX2 و NRL و CRX و NR2E3 و TRbeta2. يمثل مصير مخروط S برنامج المستقبل الضوئي الافتراضي ؛ ومع ذلك ، يمكن أن يؤدي نشاط النسخ التفاضلي إلى توليد عصوي أو مخروط M. توجد مخاريط L في الرئيسيات ، ولكن لا يُعرف الكثير ببرنامجها التنموي بسبب استخدام القوارض في البحث. هناك خمس خطوات لتطوير المستقبلات الضوئية: تكاثر الخلايا السلفية الشبكية متعددة القدرات (RPCs) ؛ تقييد اختصاص RPCs ؛ مواصفات مصير الخلية ؛ التعبير الجيني للمستقبلات الضوئية. وأخيرًا نمو المحور العصبي وتشكيل المشبك ونمو الجزء الخارجي.
تحافظ إشارات الثلمة المبكرة على دورة السلف. تأتي سلائف المستقبلات الضوئية من خلال تثبيط إشارات الثلمة وزيادة نشاط العوامل المختلفة بما في ذلك متماثل achaete-scute 1. يُلزم نشاط OTX2 الخلايا بمصير المستقبل الضوئي. يحدد CRX كذلك لوحة محددة لمستقبلات الضوء من الجينات التي يتم التعبير عنها. تعبير NRL يؤدي إلى مصير العصوي. يقيد NR2E3 الخلايا أيضًا في مصير العصوي عن طريق قمع الجينات المخروطية. RORbeta مطلوب لتطوير كل من العصوي والمخروط. TRbeta2 يتوسط مصير مخروط M. إذا تم استئصال أي من وظائف العوامل المذكورة سابقًا ، فإن المستقبل الضوئي الافتراضي هو مخروط S. تحدث هذه الأحداث في فترات زمنية مختلفة لأنواع مختلفة وتتضمن نمطًا معقدًا من الأنشطة التي تؤدي إلى ظهور طيف من الأنماط الظاهرية. إذا تعطلت هذه الشبكات التنظيمية ، فقد ينتج عن ذلك التهاب الشبكية الصباغي أو الضمور البقعي أو عيوب بصرية أخرى.[18]
التأشير
تشير المستقبلات الضوئية للعصوي والمخروط إلى امتصاصها للفوتونات عن طريق انخفاض في إطلاق الناقل العصبي الغلوتامات إلى الخلايا ثنائية القطب عند محطة المحوار. نظرًا لأن المستقبلات الضوئية يتم استقطابها في الظلام ، يتم إطلاق كمية كبيرة من الغلوتامات إلى الخلايا ثنائية القطب في الظلام. سيؤدي امتصاص الفوتون إلى زيادة استقطاب المستقبلات الضوئية وبالتالي ينتج عن إطلاق كمية أقل من الغلوتامات في الطرف قبل المشبكي إلى الخلية ثنائية القطب.
يطلق كل مستقبل ضوئي عصوي أو مخروطي نفس الناقل العصبي ، الغلوتامات. ومع ذلك ، يختلف تأثير الغلوتامات في الخلايا ثنائية القطب ، اعتمادًا على نوع المستقبلات الموجودة في غشاء تلك الخلية . عندما يرتبط الغلوتامات بمستقبل أيونوتروبي ، فإن الخلية ثنائية القطب ستنزع الاستقطاب (وبالتالي ستزداد استقطابها مع الضوء مع إطلاق كمية أقل من الغلوتامات). من ناحية أخرى ، يؤدي ارتباط الغلوتامات بمستقبل تحولي إلى فرط الاستقطاب ، لذلك ستزول هذه الخلية ثنائية القطب إلى الضوء مع إطلاق كمية أقل من الغلوتامات.
مبدئياً ، تسمح هذه الخاصية لمجموعة واحدة من الخلايا ثنائية القطب التي تثيرها الضوء ومجموعة أخرى تمنعها ، على الرغم من أن جميع المستقبلات الضوئية تظهر نفس الاستجابة للضوء. يصبح هذا التعقيد مهمًا وضروريًا لاكتشاف اللون والتباين والحواف وما إلى ذلك.
ينشأ المزيد من التعقيد من الترابطات المختلفة بين الخلايا ثنائية القطب والخلايا الأفقية وخلايا الأماكرين في شبكية العين. النتيجة النهائية هي مجموعات مختلفة من الخلايا العقدية في شبكية العين ، والتي تعتبر مجموعة فرعية منها أيضًا حساسة جوهريًا للضوء ، باستخدام صبغ الميلانوبسين بالضوء.
المستقبلات الضوئية في الخلايا العقدية (غير عصوية-غير مخروطية)
تم اكتشاف مستقبلات ضوئية غير مخروطية وغير عصوية في عيون الفئران ، والتي تبين أنها تتوسط في إيقاعات الساعة البيولوجية ، في عام 1991 بواسطة Foster et al.[2] هذه الخلايا العصبية ، التي تسمى الخلايا العقدية الشبكية الحساسة للضوء (ipRGC) ، هي مجموعة فرعية صغيرة (1-3٪) من الخلايا العقدية الشبكية الموجودة في الشبكية الداخلية ، في الأمام [19]العصويات والمخاريط الموجودة في الشبكية الخارجية. هذه الخلايا العصبية الحساسة للضوء تحتوي على صباغ ضوئي، ميلانوبسين,[20][21][22][23][24] التي لديها ذروة امتصاص الضوء عند طول موجي مختلف (≈480 نانومتر[25] من العصويات والمخاريط بجانب الوظائف اليومية / السلوكية ، فإن ipRGCs لها دور في بدء انعكاس الضوء الحدقي.[26]
أظهر دينيس داسي مع زملائه في نوع من قرود العالم القديم أن الخلايا العقدية العملاقة التي تعبر عن الميلانوبسين متجهة إلى النواة الركبية الجانبية (LGN)).[27] في السابق ، تم عرض فقط الإسقاطات على الدماغ المتوسط (نواة ما قبل السقفي) وما تحت المهاد (النواة فوق التصالبية). ومع ذلك ، كان الدور البصري للمستقبل لا يزال غير متوقع وغير مثبت.
في عام 2007 ، نشر فرحان زيدي وزملاؤه عملًا رائدًا باستخدام البشرالذين ليس لديهم عصويات او مخاريط. أعلن علم الأحياء الحالي لاحقًا في مقالهم الافتتاحي والتعليق والإرساليات إلى العلماء وأطباء العيون لعام 2008 ، أن المستقبلات الضوئية غير العصوية وغير المخروطية قد تم اكتشافها بشكل قاطع في البشر باستخدام تجارب تاريخية على البشر الذين ليس لديهم عصويات او مخاريط من قبل الزيدي والزملاء [24][28][29][30] كما تم العثور عليه في الثدييات الأخرى ، تم العثور على هوية مستقبلات الضوء غير المخروطية وغير العصوية في البشر على أنها خلية عقدة في الشبكية الداخلية. كان العمال قد تعقبوا المرضى الذين يعانون من أمراض نادرة ، مما أدى إلى القضاء على وظيفة مستقبلات الضوء المخروطية والعصوية التقليدية ، ولكن مع الحفاظ على وظيفة الخلايا العقدية.[28][29][30] على الرغم من عدم وجودعصويات أو مخاريط ، استمر المرضى في إظهار التدريب الضوئي اليومي ، والأنماط السلوكية اليومية ، وقمع الميلانوبسين ، ومنعكسات الحدقة ، مع حساسية طيفية قصوى للضوء البيئي والتجريبي المطابق لتلك الخاصة بصبغ الميلانوبسين الضوئي. يمكن لأدمغتهم أيضًا أن تربط الرؤية بضوء هذا التردد.
في البشر ، يساهم المستقبل الضوئي لخلية العقدة الشبكية في البصر الواعي وكذلك في الوظائف غير المكونة للصورة مثل إيقاعات الساعة البيولوجية والسلوك ومنعكسات الحدقة.[31] نظرًا لأن هذه الخلايا تستجيب في الغالب للضوء الأزرق ، فقد اقترح أن يكون لها دور في الرؤية الغلسية.[بحاجة لمصدر] الزيدي وزملاؤه مع أشخاص بدون مخاريط او عصويات ، وبالتالي فتح الباب أيضًا لأدوار تشكيل الصورة (المرئية) لمستقبلات الخلية العقدية. تم اكتشاف أن هناك مسارات متوازية للرؤية - أحد المسارات الكلاسيكية المعتمدة علي العصوية و المخروطية ينشأ من الشبكية الخارجية ، والآخر مسار أولي للكشف عن السطوع البصري ينشأ من الشبكية الداخلية ، والذي يبدو أنه ينشط بالضوء قبل الآخر.[31] تتغذى المستقبلات الضوئية الكلاسيكية أيضًا في نظام المستقبلات الضوئية الجديد ، وقد يكون ثبات اللون دورًا مهمًا كما اقترحه فوستر. يمكن للمستقبل أن يكون مفيدًا في فهم العديد من الأمراض بما في ذلك الأسباب الرئيسية للعمى في جميع أنحاء العالم مثل الزرق ، وهو مرض يؤثر على الخلايا العقدية ، ودراسة المستقبلات توفر إمكانات كوسيلة جديدة للاستكشاف في محاولة إيجاد علاجات للعمى. في هذه الاكتشافات للمستقبلات الضوئية الجديدة في البشر وفي دور المستقبل في الرؤية ، بدلاً من وظائفها غير المكونة للصورة ، قد يكون للمستقبل أكبر تأثير على المجتمع ككل ، على الرغم من تأثير الإيقاعات اليومية المضطربة هو مجال آخر ذو صلة بالطب السريري.
تشير معظم الأعمال إلى أن ذروة الحساسية الطيفية للمستقبل تتراوح بين 460 و 482 نانومتر. ستيفن لوكلي وآخرون. في عام 2003 أظهر أن الطول الموجي 460 نانومتر من الضوء يقمع الميلاتونين ضعف ما هو أطول 555 نانومتر من الضوء. ومع ذلك ، في العمل الأحدث الذي قام به فرحان زيدي وزملاؤه ، باستخدام البشر بدون عصويات او مخاريط ، وجد أن ما أدى بوعي إلى إدراك الضوء كان منبهًا مكثفًا بقوة 481 نانومتر. هذا يعني أن المستقبل ، من الناحية المرئية ، يتيح بعض الرؤية الأولية للضوء الأزرق إلى أقصى حد..[31]
انظر أيضاً
- Visual phototransduction
- G protein-coupled receptor
- الجهاز العصبي الحسي
- Photosensitive
- خلية عقدية حساسة للضوء
- Horizontal cell
- خلية ثنائية القطب
- Amacrine cell
المصادر
- ^ "eye, human." Encyclopædia Britannica. Encyclopædia Britannica Ultimate Reference Suite. Chicago: Encyclopædia Britannica, 2010.
- ^ أ ب Foster, R.G.; Provencio, I.; Hudson, D.; Fiske, S.; Grip, W.; Menaker, M. (1991). "Circadian photoreception in the retinally degenerate mouse (rd/rd)". Journal of Comparative Physiology A. 169 (1): 39–50. doi:10.1007/BF00198171. PMID 1941717. S2CID 1124159.
- ^ Hecht, S.; Shlar, S.; Pirenne, M.H. (1942). "Energy, Quanta, and Vision". Journal of General Physiology. 25 (6): 819–840. doi:10.1085/jgp.25.6.819. PMC 2142545. PMID 19873316.
- ^ Baylor, D.A.; Lamb, T.D.; Yau, K.W. (1979). "Responses of retinal rods to single photons". The Journal of Physiology. 288: 613–634. doi:10.1113/jphysiol.1979.sp012716 (inactive 2021-01-10). PMC 1281447. PMID 112243.
{{cite journal}}: CS1 maint: DOI inactive as of يناير 2021 (link) - ^ Hurvich, Leo (1981). Color Vision. Sinauer.
- ^ "Owl Eye Information". owls.org. World Owl Trust. Retrieved 1 May 2017.
- ^ "Scientists document light-sensitive birds eye within bird brain". birdsnews.com. Birds News. Archived from the original on 2 July 2017. Retrieved 20 July 2017.
- ^ Human Physiology and Mechanisms of Disease by Arthur C. Guyton (1992) ISBN 0-7216-3299-8 p. 373
- ^ Richardson, T.M. (1969). "Cytoplasmic and ciliary connections between the inner and outer segments of mammalian visual receptors". Vision Research. 9 (7): 727–731. doi:10.1016/0042-6989(69)90010-8. PMID 4979023.
- ^ Louvi, A.; Grove, E. A. (2011). "Cilia in the CNS: The quiet organelle claims center stage". Neuron. 69 (6): 1046–1060. doi:10.1016/j.neuron.2011.03.002. PMC 3070490. PMID 21435552.
- ^ Bowmaker J.K. & Dartnall H.J.A. (1980). "Visual pigments of rods and cones in a human retina". J. Physiol. 298: 501–511. doi:10.1113/jphysiol.1980.sp013097. PMC 1279132. PMID 7359434.
- ^ Foundations of Vision, Brian A. Wandell
- ^ أ ب ت ث Schacter, Daniel L. (2011). Psychology Second Edition. 41 Madison Avenue, New York, NY 10010: Worth Publishers. pp. 136–137. ISBN 978-1-4292-3719-2.
{{cite book}}: CS1 maint: location (link) - ^ Goldstein, E. Bruce (2007). Sensation and Perception (7 ed.). Thomson and Wadswoth.
- ^ Wandell, Brian A. (1995). Foundations of Vision. Sunderland, MA: Sinauer.
- ^ أ ب Kandel, E. R.; Schwartz, J.H.; Jessell, T.M. (2000). Principles of Neural Science (4th ed.). New York: McGraw-Hill. pp. 507–513. ISBN 0-8385-7701-6.
- ^ Schiller, P. H.; Sandell, J. H.; Maunsell, J. H. (August 28 – September 3, 1986). "Functions of the ON and OFF channels of the visual system". Nature. 322 (6082): 824–825. Bibcode:1986Natur.322..824S. doi:10.1038/322824a0. ISSN 0028-0836. PMID 3748169. S2CID 4234808.
- ^ Swaroop, Anand; Douglas Kim; Douglas Forrest (August 2010). "Transcriptional Regulation of Photoreceptor Development and Homeostasis in the Mammalian Retina". Nature Reviews Neuroscience. 11 (8): 563–576. doi:10.1038/nrn2880. PMID 20648062. S2CID 6034699.
- ^ See retina for information on the retinal layer structure.
- ^ Provencio, I.; et al. (2000-01-15). "A human opsin in the inner retina". The Journal of Neuroscience. 20 (2): 600–605. doi:10.1523/JNEUROSCI.20-02-00600.2000. PMC 6772411. PMID 10632589.
- ^ Hattar, S.; Liao, HW; Takao, M; Berson, DM; Yau, KW (2002). "Melanopsin-Containing Retinal Ganglion Cells: Architecture, Projections, and Intrinsic Photosensitivity". Science. 295 (5557): 1065–70. Bibcode:2002Sci...295.1065H. doi:10.1126/science.1069609. PMC 2885915. PMID 11834834.
- ^ Melyan, Z.; Tarttelin, E. E.; Bellingham, J.; Lucas, R. J.; Hankins, M. W. (2005). "Addition of human melanopsin renders mammalian cells photoresponsive". Nature. 433 (7027): 741–5. Bibcode:2005Natur.433..741M. doi:10.1038/nature03344. PMID 15674244. S2CID 4426682.
- ^ Qiu, Xudong; Kumbalasiri, Tida; Carlson, Stephanie M.; Wong, Kwoon Y.; Krishna, Vanitha; Provencio, Ignacio; Berson, David M. (2005). "Induction of photosensitivity by heterologous expression of melanopsin". Nature. 433 (7027): 745–9. Bibcode:2005Natur.433..745Q. doi:10.1038/nature03345. PMID 15674243. S2CID 24999816.
- ^ أ ب Vangelder, R (2008). "Non-Visual Photoreception: Sensing Light without Sight". Current Biology. 18 (1): R38–R39. doi:10.1016/j.cub.2007.11.027. PMID 18177714.
- ^ Berson, David M. (2007). "Phototransduction in ganglion-cell photoreceptors". Pflügers Archiv: European Journal of Physiology. 454 (5): 849–55. doi:10.1007/s00424-007-0242-2. PMID 17351786.
- ^ Lucas, Robert J.; Douglas, Ronald H.; Foster, Russell G. (2001). "Characterization of an ocular photopigment capable of driving pupillary constriction in mice". Nature Neuroscience. 4 (6): 621–6. doi:10.1038/88443. PMID 11369943. S2CID 19906514.
- ^ Dacey, Dennis M.; Liao, Hsi-Wen; Peterson, Beth B.; Robinson, Farrel R.; Smith, Vivianne C.; Pokorny, Joel; Yau, King-Wai; Gamlin, Paul D. (2005). "Melanopsin-expressing ganglion cells in primate retina signal colour and irradiance and project to the LGN". Nature. 433 (7027): 749–54. Bibcode:2005Natur.433..749D. doi:10.1038/nature03387. PMID 15716953. S2CID 4401722.
- ^ أ ب Genova, Cathleen, Blind humans lacking rods and cones retain normal responses to nonvisual effects of light. Cell Press, December 13, 2007.
- ^ أ ب Coghlan A. Blind people 'see' sunrise and sunset. New Scientist, 26 December 2007, issue 2635.
- ^ أ ب Medical News Today. Normal Responses To Non-visual Effects Of Light Retained By Blind Humans Lacking Rods And Cones. 14 December 2007.
- ^ أ ب ت Zaidi FH, et al. (2007). "Short-wavelength light sensitivity of circadian, pupillary, and visual awareness in humans lacking an outer retina". Current Biology. 17 (24): 2122–8. doi:10.1016/j.cub.2007.11.034. PMC 2151130. PMID 18082405.
المراجع
- Campbell, Neil A. & Reece, Jane B. (2002). Biology. San Francisco: Benjamin Cummings. pp. 1064–1067. ISBN 0-8053-6624-5.
- Freeman, Scott (2002). Biological Science (2nd ed.). Englewood Cliffs, N.J: Prentice Hall. pp. 835–837. ISBN 0-13-140941-7.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
وصلات خارجية
 Media related to Photoreceptor cells at Wikimedia Commons
Media related to Photoreceptor cells at Wikimedia Commons- NIF Search – Photoreceptor Cell via the Neuroscience Information Framework
![تشريح الخلية العصوية[8]](/w/images/thumb/b/bb/Rod%26Cone.jpg/179px-Rod%26Cone.jpg)