علاج كيميائي
| علاج كيميائي | |
|---|---|
 سيدة تتلقى العلاج الكيميائي بالدوستاكل (docetaxel) لعلاج سرطان الثدي. قفازات باردة ومبرَّدات النبيذ على يديها وقدميها للحد من الضرر الذي قد يصيب أظافرها | |
| أسماء أخرى | chemo |
العلاج الكيميائي (اختصاراً chemo)، هو أحد أنواع علاجات السرطان التي تستخدم واحداً أو أكثر من الأدوية المضادة للسرطان (عوامل العلاج الكيميائي) كجزء من نظام العلاج الكيميائي القياسي. قد يُعطى العلاج الكيميائي بهدف شفائي (والذي عادة ما يكون برفقة الأدوية)، أو قد يهدف إلى إطالة الحياة أو إلى تقليل الأعراض (العلاج الكيميائي التلطيفي). العلاج الكيميائي هو واحداً من أهم الفئات الرئيسية للتخصصات الطبية المكرسة خصيصاً للمعالجة الدوائية للسرطان، والذي يسمى علم الأورام الطبي.
صيغ مصطلح العلاج الكيميائي كدلالة على الاستخدام الغير محدد للسموم الخلوية لتثبيط التفتل، الانقسام الخلوي. تستثني الدلالة أكثر العوامل انتقائية التي تمنع الإشارات خارج الخلية (توصيل الإشارة). تطوير علاجات ذات أهداف جزيئية أو جينية محددة، الذي يمنع إشارات تعزيز النمو من هرمونات الغدد الصماء التقليدية (خاصة إستروجينات سرطان الثدي وأندروجينات سرطان الپروستاتا) تسمى حالياً العلاجات الهرمونية.
في المقابل، المثبطات الأخرى لإشارات النمو مثل تلك المرتبطة مع مستقبلات كيناز التيروزين يشار إليها بالعلاج المستهدف.
والأهم من ذلك، أن استخدام العقاقير (سواء كان العلاج الكيميائي أو العلاج الهرموني أو العلاج المستهدف) يشكل "علاجاً منهجياً" للسرطان من حيث أنه يتم إدخاله في مجرى الدم وبالتالي يكون قادراً من حيث المبدأ على معالجة السرطان في أي مكان تشريحي في الجسم. عادة ما يستخدم العلاج الممنهج بالترافق مع الطرق الأخرى التي تشكل "العلاج الموضعي". (أي المعالجات التي تنحصر فعاليتها في المنطقة التشريحية حيث يتم تطبيقها) للسرطان مثل العلاج الإشعاعي، الجراحة، أو العلاج الفرط حراري.
عوامل العلاج الكيميائي التقليدية هي مواد سامة خلوياً عن طريق التدخل في الانقسام الخلوي (التفتل)، لكن الخلايا السرطانية تختلف بشكل كبير في قابليتها لهذه العوامل. إلى حد كبير، يمكن اعتبار العلاج الكيميائي وسيلة لإتلاف أو الضغط على الخلايا، مما قد يؤدي إلى موت الخلايا إذا بدأ الاستموات. يمكن تتبع العديد من الآثار الجانبية للعلاج الكيميائي الخاصة بتلف الخلايا الطبيعية التي تنقسم بسرعة وبالتالي فهي حساسة للأدوية المضادة للانقسام: خلايا النخاع العظمي، السبيل الهضمي وجريبات الشعر. يتسبب هذا في معظم الآثار الجانبية الشائعة للعلاج الكيميائي: كبت نقى الدم (تناقص إنتاج خلايا الم، ومن ثم يحدث أيضاً تثبيط مناعي، التهاب الغشاء المخاطي (التهاب بطانة السبيل الهضمي)، وفقدان الشعر). بسبب آثارها على الخلايا المناعية (خاصة الخلايا اللمفاوية)، غالباً ما تستخدم أدوية العلاج الكيميائي في مجموعة من الأمراض التي تنتج عن النشاط الزائد للجهاز المناعي الذاتي (ما يعرف بالمناعة الذاتية). ويشمل هذا التهاب المفاصل الرثياني، الذئبة الحمامية الشاملة، التصلب المتعدد، الالتهاب الوعائي، والكثير من الأمراض الأخرى.
وبسبب الآثار الجانبية الخطيرة للعلاج الكيميائي، يحاول الباحثون العثور على أدوية علاج كيميائي موجهة تؤثر فقط على الخلايا السرطانية دون تدمير الخلايا السليمة، ومن ثم الحد من الآثار الجانبية للعلاج الكيميائي.
|
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
استراتيجيات العلاج
| نوع السرطان | الأدوية | المختصر |
|---|---|---|
| سرطان الثدي | Cyclophosphamide, مثوتركسات, 5-fluorouracil | CMF |
| Doxorubicin, cyclophosphamide | AC | |
| لمفومة هودجكن | Docetaxel, doxorubicin, cyclophosphamide | TAC |
| Doxorubicin, bleomycin, vinblastine, dacarbazine | ABVD | |
| Mustine, vincristine, procarbazine, پردنيسولون | MOPP | |
| لمفوما لاهودجكينية | Cyclophosphamide, doxorubicin, vincristine, پردنيسولون | CHOP |
| ورم الخلايا الجرثومية | Bleomycin, etoposide, cisplatin | BEP |
| سرطان المعدة[2] | Epirubicin, cisplatin, 5-fluorouracil | ECF |
| Epirubicin, cisplatin, capecitabine | ECX | |
| سرطان المثانة | مثوتركسات, vincristine, doxorubicin, cisplatin | MVAC |
| سرطان الرئة | Cyclophosphamide, doxorubicin, vincristine, | CAV |
| سرطان القولون والمستقيم | 5-fluorouracil, حمض الفولينيك, oxaliplatin | FOLFOX |
الفعالية
تعتمد فعالية العلاج الكيميائي على نوع السرطان ومرحلة تطور المرض. وتتراوح الفعالية الإجمالية من كونه علاجياً لبعض أنواع السرطان، مثل بعض أنواع اللوكيميا،[3][4] إلى كونه علاجاً غير فعالاً، كما في بعض حالات أورام المخ،[5] إلى كونه علاجاً لا داعي له، مثل معظم حالات سرطانات الجلد اللا-ميلانومية.[6]
الجرعة

من الصعب تحديد جرعة العلاج الكيميائي: إذا كانت الجرعة منخفضة للغاية، ستكون غير فعالة على الورم، في حين عند الجرعات المفرطة، تكون السمية (الآثار الجانبية) غير محتملة بالنسبة للشخص الذي يتلقى العلاج.[1] تعتمد الطريقة القياسية لتحديد جرعة العلاج الكيميائي على حساب مساحة سطح الجسم (BSA). عادة ما يتم حساب مساحة سطح الجسم عن طريق معادلة رياضية أو مخطط معادلة، باستخدام وزن المريض وطوله، بدلاً من القياس المباشر لمساحة الجسم. تم التوصل لهذه المعادلة في دراسة عام 1916 والتي حاولت ترجمة الجرعات الطبية المطبقة على حيوانات المختبر إلى جرعات مكافئة للبشر.[7] تشير الدراسة إلى 9 عناصر بشرية فقط.[8] عند طرح العلاج الكيميائي في الخمسينيات، تم اعتماد معادلة مساحة سطح الجسم كمعيار رسمي لتحديد جرعة العلاج الكيميائي لعدم وجود خيار أفضل.[9][10]
مؤخراً، أصبحت مصداقية هذه الطريقة في حساب الجرغات الرسمية للعلاج الكيميائي محل تساؤل. ويرجع السبب في هذا إلى أن المعادلة تأخذ فقط في الحسبان وزن الجسم وطوله. يتأثر امتصاص الدواء والتخلص منه بعدة عوامل، منها السن، النوع، الأيض، الحالة المرضية، وظائف الأعضاء، التفاعل الدوائي، الجينات الوراثية، والبدانة، والتي لها أثراً رئيسياً على التركز الفعلي للدواء في تيار الدم.[9][11][12] نتيجة لذلك، هناك تباين كبير في تركيز العلاج الكيميائي الشامل على الأشخاص الذين يتناولون جرعات على أساس مساحة سطح الجسم، وقد ثبت أن هذا التباين قد وصل إلى أكثر من 10 أضعاف للعديد من الأدوية.[8][13] بمعنى آخر، إذا تلقى شخصين نفس الجرعة من الدواء حسب مساحة سطح الجسم، فإن تركيز الدواء في تيار دم أحدهما قد يكون أعلى بعشرة أضعاف مقارنة بنظيره في الشخص الآخر.[13] يعتبر هذا التباين نموذجياً مع العديد من أدوية العلاج الكيميائي المحددة جرعتها عن طريق مساحة سطح الجسم، وكما يتضح أدناه، الذي تم إثباته في دراسة 14 جرعة علاج كيميائي شائعة.[8]
نتيجة لهذا التباين في الحركة الدوائية بين الأشخاص، هو أن العديد من الأشخاص لا يتلقون الجرعة المناسبة لتحقيق فعالية العلاج الأمثل مع الآثار الجانبية السمية الدنيا. يحصل بعضهم على جرعات زائدة بينما يحصل الآخرين على جرعات أقل من المطلوبة.[9][11][12][14][15][16][17] على سبيل المثال، في التجار السريرية العشوائية، وجد الباحثون أن 85% من حالات سرطان المستقيم والقولون المتفشي التي تم علاجهم عن طريق 5-فلوروراسيل 5-fluorouracil (5-FU) لم يحصلون على الجرعة الكيميائية المثلى عندما تم تحديد جرعتهم باستخدام طريقة مساحة سطح الجسم- 68% حصلوا على جرعات أقل من المطلوب و17% تلقوا جرعات زائدة.[14]
كان هناك جدول حول استخدام مساحة سطح الجسم لحساب جرعات العلاج الكيميائي للأشخاص المصابين بالبدانة.[18] بسبب مساحة سطح جسمهم الكبيرة، كثيراً ما يخفض الأطباء بشكل تعسفي الجرعة المنصوص عليها حسب طريقة مساحة سطح الجسم خوفاً من من الجرعة الزائدة.[18] في الكثير من الحالات، يمكن أن يؤدي هذا إلى معالجة دون المستوى الأمثل.[18]
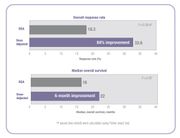
أظهرت الكثير من الدراسات السريرية أنه عندما يتم تخصيص جرعات العلاج الكيميائي لتحقيق أقصى درجة ممكنة من التعرض للعقاقير المثلى، تتحسن نتائج العلاج وتُخفض الآثار الجانبية السامة.[14][16] في دراسة 5-FU السريرية المستشهد بها أعلاه، فإن الأشخاص الذين تم تعديل جرعاتهم لتحقيق هدف محدد مسبقاً، حدث تحسن بنسبة 84٪ في معدل الاستجابة للعلاج وتحسن في البقاء على قيد الحياة (OS) لمدة ستة أشهر مقارنةً بالحالات التي خضعت لتحديد الجرعات عن طريق مساحة سطح الجسم.[14]

في نفس الدراسة، قام الباحثون بمقارنة معدل سمية 5 FU المرتبطة بالدرجة 3/4 بين الأشخاص المعدلة جرعتهم والأشخاص الذين تناولوا جرعات تم تحديدها عن طريق مساحة سطح الجسم.[14] انخفضت حالات الإصابة بالإسهال من 18٪ في المجموعة المستخدمة نظام مساحة سطح الجسم، إلى 4٪ في المجموعة ذات الجرعة المصححة، وتم التخلص من الآثار الجانبية الدموية الخطيرة.[14] بسبب انخفاض السمية، تم علاج المرضى الذين تم تعديل جرعتهم لفترات أطول من الزمن.[14] الأشخاص الذين تحددت جرعة علاجهم باستخدام نظام مساحة سطح الجسم تلقوا العلاج بإجمالي 680 شهر بينما الأشخاص ذوي الجرعة المعدلة تم علاجهم لإجمالي 791 شهر.[14] يعد إكمال دورة العلاج عاملاً مهماً في تحقيق نتائج أفضل في العلاج.
تم التوصل إلى نتائج مماثلة في دراسة تضمنت أشخاص مصابين بسرطان المستقيم والقولون الذين تم علاجهم باستخدم نظام فولفوكس الشهير.[16] انخفضت نسبة حدوث الإسهال الخطير من 12 ٪ في مجموعة من المرضى الذين تم تحديد جرعة علاجهم باستخدام نظام مساحة سطح الجسم إلى 1.7 ٪ في المجموعة ذات الجرعة المصححة، وانخفض حدوث التهاب الغشاء المخاطي الشديد من 15 ٪ إلى 0.8 ٪.[16]
كما أظهرت دراسة الفولفوكس تحسناً في نتائج العلاج.[16] زادت الإستجابة الإيجابية من 46% في المجموعة التي تلقت علاجاً باستخدم نظام مساحة سطح الجسم إلى 70% في المجموعة ذات الجرعة المصححة. تحسن متوسط البقاء على قيد الحياة المتوسط (PFS) والبقاء على قيد الحياة (OS) على حد سواء من قبل ستة أشهر في المجموعة ذات العلاج المعدل.[16]
ومن الأساليب التي يمكن أن تساعد الأطباء على تحديد جرعات العلاج الكيماوي هو قياس مستويات الدواء في پلازما الدم مع مرور الوقت وتعديل الجرعة وفقاً لمعادلة أو خوارزمية لتحقيق التعرض الأمثل. مع التعرض المستهدف لفعالية العلاج الأمثل مع أدنى حد من السمية، يمكن تحديد الجرعات لتحقيق التعرض المستهدف والنتائج المثلى لكل شخص. تم استخدام مثل هذه الخوارزمية في التجارب السريرية المذكورة أعلاه وأسفرت عن نتائج معالجة محسنة بشكل كبير.
يقوم علماء الأورام بالفعل بتخصيص جرعات بعض أدوية السرطان بناءً على التعرض. تعتمد تحديد جرعات الكارباپلاتين (Carboplatin)[19] والبوسولفان (busulfan)[20][21] على نتائج من تحاليل الدم لحساب الجرعة المثلى لكل شخص. كما تحدد عينة تحاليل الدم توافر الجرعة المثلى من المثوتركسات methotrexate،[22] 5-FU، الپاكليتاكسل (paclitaxel)، والدويستاكسل (docetaxel).[23][24]
الأنواع

يُمكن تقسيم معظم أدوية العلاج الكيميائي إلى: عناصر الألكلة (alkylating agents)، والعقاقير الكابحة للأيض (antimetabolite)، والانتراسيكلين (anthracycline)، والأشباه القلوية النباتية (plant alkaloids)، ومثبطات التوبايسوميراز، وغيرها من العقاقير المضادة للأورام.[26] وتُؤثر جميع تلك الأدوية على الانقسام الخلوي، وتوليفة ووظيفة الحمض النووي بشكلٍ أو بآخر.
لا تتداخل بعض العقاقير الحديثة مع الحمض النووي الريبي منقوص الأكسجين بشكل مباشر، وهي تشمل: الأضداد وحيدة النسيلة (monoclonal antibodies)، والمثبطات الجديدة للتيروزين كيناز مثل الـmesylate imatinib، الذي يستهدف الجزيئيات الشاذة مباشرةً في أنواع معينة من السرطان (أبيضاض الدم النقوي المزمن، وأورام أنسجة الجهاز الهضمي. وتندرج تلك الأمثلة تحت العلاج المُوَجَّه.
كما يمكن استخدام بعض العقاقير التي تُعَدِّل سلوك الخلايا السرطانية دون مهاجمتها بشكل مباشر. ويندرج العلاج بالهرمونات ضمن هذه الفئة.
ويمكن توفير نظام التصنيف الكيميائي العلاجي التشريحي للفئات الرئيسية.
عوامل الألكلة
سُمِّيَت عوامل الألكلة بهذا الاسم نظراً لقدرتها على إضافة مجموعات من الألكيل إلى المجموعات الكهربية السالبة طبقاً لظروف الخلايا. وتشمل عوامل الألكلة السيسبلاتين، والكاربوبلاتين، والأوكساليبلاتين. فهي تعمل على إضعاف وظيفة الخليَّة من خلال تكوين روابط تساهمية مع مجموعات الأمينو، والكربوكسايل، والسلفايدرايل، والفوسفات في الجزيئيات المهمة بيولوجياً.[26]
وهذا بالإضافة إلى الميكلوريثامين، والسيكلوفوسفاميد، والكلوراميوسيل، والإفوسفامايد.[26] وهي تعمل من خلال تعديل الحمض النووي للخلية كيميائياً.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
العناصر المضادة المستقلبة

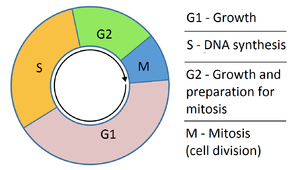
تتنكَّر المضادات المستقلبة في صورة البيورين (الآزوثيوبرين والميركابتوبيورين) أو البيريميدين—الذي أصبح أساس الحمض النووي. وهو يمنع هذه المواد من التداخل مع الحمض النووي خلال المرحلة "S" (من دورة الخلية)، ومن ثم توقف التطور الطبيعي والانقسام. كما أنها تُؤثر على تركيبة الحمض النووي الريبوزي. وتُعتبر هذه الأدوية هي الأكثر استخداماً بسبب فاعليتها.
الأشباه القلوية النباتية والتيربينويدس (L01C)
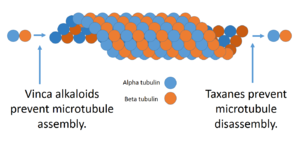
استخرجت هذه الأشباه القلوية من النباتات، وهي تمنع انقسام الخلايا من خلال إحباط وظيفة تشابكات الألياف العصبية. تُعتبر تشابكات الألياف العصبية مهمة جداً لانقسام الخلايا، وبدونها لا يمكن أن يحدث الانقسام الخلوي. وتشمل الأمثلة: قلويدات الفنكا والتاكسان.
العوامل المضادة للأنيبيبات
ترتبط فينكا القلويدات بمواقع محددة في الأنبوبين، ومن ثم تمنع تجمعه في تشابكات الألياف العصبية (المرحلة إم من دورة الخلية). فهي مشتقة من نبات الفنكة، Catharanthus roseus، (وكانت تُعرف سابقاً باسم Vinca rosea). وتشمل فينيكا القلويدات:
- Vincristine
- Vinblastine
- Vinorelbine
- Vindesine
عن إنتاج المادة، بحيث يمكن الحصول عليها مرة أخرى.
التاكسان (L01CD)
إن النموذج الأصلي للتاكسان هو الناتج الطبيعي للباكليتاكسيل، وكان يُعرف في الأصل باسم تاكسول. وهي مشتقة من لحاء شجرة الطقسوس الباسيفيكي. ويُعتبر الدوسيتاكسيل شبيه صناعي للباكليتاكسيل. ويعزز التاكسان من استقرار الأنابيب الدقيقة، ومن ثم يمنع فصل الكروموسومات خلال الطور الانفصالي.
مثبطات التوپوآيزوميراز
التوبايسوميراز هي إنزيمات ضرورية للمحافظة على هيكل الحمض النووي. ويتداخل منع إفراز النوع الأول أو النوع الثاني من التوبايسوميراز مع نسخ الحمض النووي من خلال التَحَوُّر.
- يشمل النوع الأول من موانع توبايسوميراز الcamptothecins، مثل الـirinotecan والـtopotecan.
- يشمل النوع الثاني الـamsacrine، والـetoposide، والـetoposide phosphate، والـteniposide. وهي مُشتقَّات شبه صناعية من الـepipodophyllotoxins. وتوجد القلويات في جذور تفاحة مايو.
المضادات الحيوية السامة للخلايا
نظام العلاج

هناك العديد من الاستراتيجيات الخاصة بالعقاقير الكيميائية المُسْتَخْدَمَة اليوم. يَهدُف العلاج الكيميائي إلى الشفاء أو إطالة الحياة أو التخفيف من الأعراض.
يُمكِن الجمع بين العلاج الكيميائي والعلاج الإشعاعي أو الجراحة. ويتم علاج مُعظَم أنواع السرطان اليوم بهذه الطريقة. كما يمكن الجمع بين العقاقير المختلفة في وقت واحد. وتختلف الأدوية من حيث الآلية والآثار الجانبية. وتكمن ميزة هذا الأسلوب العلاجي في تقليل فُرص مقاومة الخلايا السرطانية للمواد الكيميائية.
ويمكن استخدام العلاج الكيميائي لتقليص الأورام الأولية، مما يُسَهِّل إجراء العملية الجراحية والعلاج الإشعاعي. ويستخدم العلاج الكيميائي بعد العمليات الجراحية عند وجود مؤشر ضعيف على وجود خلايا سرطانية، أو في حالة خطورة الإصابة بالمرض مرة أخرى. حيث يُقلل ذلك من فرص مقاومة الخلايا السرطانية في حالة وجود ورم. كما أنه يساعد في قتل أي خلايا سرطانية قد تكون انتشرت في أجزاء الجسم. وغالباً ما يكون ذلك فعالاً لأن الأورام الجديدة تنقسم بسرعة، وبالتالي يسهل التخلص منها.
ويُمكن ألا يهدف العلاج الكيميائي إلى الشفاء، ولكن ببساطة لتقليل حجم الورم وإطالة العمر المتوقع للمريض.
تتطلب جميع أنظمة العلاج الكيميائي أن يكون المريض قادراً على الخضوع للعلاج. وغالباً ما يتم قياس الحالة العامة لتحديد ما إذا كان المريض يستطيع تلقي العلاج الكيميائي أم يجب خفض الجرعة. وذلك لأنه يتم قتل جزء واحد فقط من خلايا الورم مع كل جرعة، ومن ثم يجب التحكم في الجرعات المتكررة لتقليل حجم الورم.[27] ويتم العلاج الكيميائي حالياً في شكل دورات، وتُحدَّد قوة ومدة العلاج من خلال السُمِّيَّة المطلوبة.[28]
توصيل المادة الكيميائية
يؤخذ العلاج الكيميائي عن طريق الوريد في معظم الأحيان، على الرغم من أخذ بعض المواد الكيميائية عن طريق الفم (مثل الملفلان، والبوسولفان، والكابيسيتابين). كما يُستخدم في بعض الحالات أسلوب الحقن المعزول (وغالباً ما يستخدم في حالة الميلانوما) عن طريق الكبد أو الرئة. يكمن الغرض الرئيسي من هذه الأساليب في توصيل جرعة كبيرة من العلاج الكيميائي لمواقع الورم دون التسبب في أضرار نظامية.
ويمكن أن يؤخذ العلاج في المستشفى أو خارجها. وهذا يعتمد على نوع المريض، ونوع السرطان، ومرحلة السرطان، ونوع العلاج الكيميائي، والدواء. ويحتمل تركيب أجهزة مختلفة داخل الأوعية الدموية جراحياً في حالة العلاج المستمر والمتكرر لفترات طويلة. وتشمل الأجهزة الشائعة استخدام الHickman line، والPort-a-Cath، والPICC line. ولا تمثل هذه الأجهزة خطورة، حيث أنها لا تعرض المريض للالتهاب الوريدى أو التسرب الوريدي، مما يمنع الحاجة إلى التركيب المتكرر للكانيولا.
تقل الأضرار الناتجة عن سمية العلاج الكيميائي طبقاً للجرعة التي يجب تعاطيها. حيث يمكن تدمير بعض الأورام باستخدام جرعات كبيرة من العلاج الكيميائي. ولكن لا يمكن أخذ هذه الجرعات الكبيرة، لأنها قد تكون قاتلة للمريض.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الآثار الجانبية للعلاج الكيميائي
يؤخذ العلاج الكيميائي عن طريق الوريد في معظم الأحيان، على الرغم من أخذ بعض المواد الكيميائية عن طريق الفم (مثل الملفلان، والبوسولفان، والكابيسيتابين). كما يُستخدم في بعض الحالات أسلوب الحقن المعزول (وغالباً ما يستخدم في حالة الميلانوما) عن طريق الكبد أو الرئة. يكمن الغرض الرئيسي من هذه الأساليب في توصيل جرعة كبيرة من العلاج الكيميائي لمواقع الورم دون التسبب في أضرار نظامية.
ويمكن أن يؤخذ العلاج في المستشفى أو خارجها. وهذا يعتمد على نوع المريض، ونوع السرطان، ومرحلة السرطان، ونوع العلاج الكيميائي، والدواء. ويحتمل تركيب أجهزة مختلفة داخل الأوعية الدموية جراحياً في حالة العلاج المستمر والمتكرر لفترات طويلة. وتشمل الأجهزة الشائعة استخدام الHickman line، والPort-a-Cath، والPICC line. ولا تمثل هذه الأجهزة خطورة، حيث أنها لا تعرض المريض للالتهاب الوريدى أو التسرب الوريدي، مما يمنع الحاجة إلى التركيب المتكرر للكانيولا.
تقل الأضرار الناتجة عن سمية العلاج الكيميائي طبقاً للجرعة التي يجب تعاطيها. حيث يمكن تدمير بعض الأورام باستخدام جرعات كبيرة من العلاج الكيميائي. ولكن لا يمكن أخذ هذه الجرعات الكبيرة، لأنها قد تكون قاتلة للمريض.
كبت المناعة وتثبيط نقي العظم
تُسبب جميع نظم العلاج الكيميائي ضعف في الجهاز المناعي، وذلك من خلال شل حركة نخاع العظام. مما يؤدي إلى نقص خلايا الدم البيضاء، وخلايا الدم الحمراء، والصفائح الدموية. يمكن علاج نقص كرات الدم البيضاء والحمراء والصفائح من خلال نقل الدم. يمكن تحسين معدل قلة العدلات (انخفاض عدد الخلية المحببة إلى أقل من 0.5 × 10 9/لتر) باستخدام الsynthetic G-CSF (عامل تحفيز الخلية المحببة مثل الfilgrastim، والlenograstim.)
وفي حالة التثبيط نقى العظم الشديد الذي يحدث نتيجة بعض النظم العلاجية، يتم تدمير كل الخلايا الجذعية الموجودة في النخاع (الخلايا التي تُنتج كرات الدم الحمراء والبيضاء. وهذا يعنى أن المريض سيكون بحاجة إلى زرع خلايا للنخاع. (يتم إزالة الخلايا من المريض قبل العلاج في حالة الautologous BMTs، ثم تتضاعف ويعاد حقنها بعد ذلك؛ بينما يصبح المانح هو المصدر في حالة الallogenic BMTs). ومع ذلك، لا يزال بعض المرضى يعانون من بعض الأمراض بسبب التداخل مع نخاع العظام.
وافقت الحكومة اليابانية على استخدام بعض الأدوية المستخرجة من الفطر مثل المبرشقة، لمواجهة ضعف الجهاز المناعي في المرضى الذين يخضعون للعلاج الكيميائي.[29]
التهاب القولون والأمعاء
بسبب تثبيت الجهاز المناعي، التهاب الأعور (neutropenic enterocolitis) هو أحد "المضاعفات المعوية المهددة للحياة للعلاج الكيميائي".[30] التهاب الأعور هو عدوى معوية يمكن أن تظهر من خلال الأعراض التي تشمل الغثيان، القيء، الإسهال، وتمدد البطن، الحمى، النفضان، أو المغص والايلام الارتدادي.
التهاب الأعور هو حالة طوارئ طبية. مآله ضعيف للغاية وعادة ما يكون وغالبًا ما يكون مميتًا ما لم يتم التعرف عليه على الفور ومعالجته بفعالية.[31] يعتمد العلاج الناجح على التشخيص المبكر الذي يوفره مؤشر عالي من الشك واستخدام التصوير المقطعي المحوسب، العلاج غير الجراحي للحالات الغير معقدة، وأحياناً استئصال القولون الاختياري لمنع تكرار المرض.[31]
عسر الهضم
الغثيان، القيء، فقدان الشهية، الإسهال، تقلصات البطن، والإمساك من الآثار الجانبية الشائعة للعلاج الكيميائي الذي يقتل الخلايا سريعة الانقسام.[32] قد يحدث سوء تغذية ولفقدان للسوائل عندما لا يأكل المريض أو يشرب كميات كافية، أو عندما يتقيأ الشخص بشكل متكرر بسبب تلف الجهاز الهضمي. قد يؤدي هذا إلى حدوث فقدان سريع في الوزن، أو أحياناً زيادة في الوزن، إذا أكل الشخص كميات كبيرة في محاولة لتهدئة الغثيان أو الحرقة. قد يحدث زيادة في الوزن أيضاً بسبب بعض الأدوية السترويدية. يمكن الحد من هذه الآثار الجانبية أو التخلص منها باستخدام الأدوية المضادة للقيء. عادة ما ينصح ببعض تدابير الرعاية الذاتية، مثل تناول وجبات صغيرة متكررة وشرب السوائل النقية أو شايء الزنجبيل. بصفة عامة، تعتبر هذه الآثار مؤقتة، وتنتهي في غضون أسبوع من الانتهاء من العلاج. ومع ذلك، فإن مؤشر الشك المرتفع مطلوباً، حيث أن الإسال والانتفاخ هي أيضاً أعراض لالتهاب الأعور، والذي يعتبر من الطوارئ الطبية الخطيرة ومهدداً محتملاً للحياة ويتطلب العلاج الفوري.
فقر الدم
قد يحدث فقر الدم نتيجة للعلاج الكيمائي لكبت نقى الدم، وقد يكون لأسباب محتملة مرتبطة بالسرطان مثل النزيف، تكسر خلايا الدم (انحلال الدم)، مرضاً وراثياً، خلل في وظائف الكلى، قصور في التغذية، أو مرض فقر الدم المزمن. تشمل العلاجات لتخفيف فقر الدم هرمونات لزيادة إنتاج الدم (إريثروپويتين)، مكملات الحديد، ونقل الدم.[33][34][35] قد يتسبب علاج كبت نقى الدم الميل للنزف بسهولة، مما يؤدي إلى فقر الدم. العلاجات التي تقتل الخلايا سريعة الانقسام أو الخلايا الدموية قد تقلل من عدد الصفائح الدموية في الدم، مما يؤدي إلى الإصابة بالورم الدموي والنزف. يمكن علاج الانخفاض الشديد في الصفائح الدموية عن طريق نقل الصفائح الدموية وجاري تطوير أدوية جديدة لزيادة عدد الصفائح الدموية أثناء العلاج الكيميائي.[36][37] في بعض الأحيان، يتم تعليق العلاج الكيميائي للسماح بعودة الصفائح الدموية إلى معدلها الطبيعي.
التعب
قد يكون التعب إحدى تبعات الإصابة بالسرطان أو علاجه، وقد يستمر من شهور لأعوام بعد العلاج. ومن الأسباب الفسيولوجية للتعب فقر الدم، الذي قد يحدث بسبب العلاج الكيميائي، الجراحة، العلاج الإشعاعي، الأمراض الأولية والنقيلة أو استنفاد العناصر الغذائية في الجسم.[38][39] وُجد أن التمارين اللاهوائية مفيدة في تقليل الإحساس بالتعب لدى الأشخاص المصابين بالأورام الصلبة.[40]
الغثيان والقيء
يعتبر الغثيان والقيء من الأعراض الشائعة للعلاج الكيميائي. ولكن يمكن التقليل من مخاطر الإصابة بهذه الأعراض من خلال استخدام أنواع من العلاج الكيميائي التي لا تسبب القيء وأدوية مضادة للقيء والغثيان. ويُؤدي تنشيط مركز القيء في المخ إلى استجابة الحجاب الحاجز، والغدد اللعابية، وأعصاب الجمجمة، وعضلات المعدة والأمعاء، مما يسبب انقطاع التنفس وطرد محتويات المعدة المعروف باسم القيء. يتم تحفيز مركز التقيؤ مباشرةً عن طريق ناقل مدخلات العصب الحائر والأعصاب الحشوية، والبلعوم، وقشرة الدماغ، وتحفيز الكولين والهيستامين من النظام الدهليزي، ومدخلات من منطقة مستقبل الإثارة الكيميائية (CTZ). تقع منطقة الCTZ في الpostrema، خارج الحاجز الدموي في الدماغ. وبالتالي يصبح أكثر عرضة للتحفيز من قبل المواد الموجودة في الدم أو السائل الدماغي الشوكي. تحفز الناقلات العصبية مثل الدوبامين والسيروتونين مركز القيء بطريقة غير مباشرة من خلال الCTZ.
تُعتبر مثبطات ال5-HT3 أكثر مضادات القئ فاعلية. صممت هذه الأدوية لإعاقة الإشارات التي تسبب الغثيان والقيء. ويبدو أن ال5-HT3 هو أكثر الإشارات حساسية خلال ال24 ساعة الأولى بعد العلاج الكيميائي. تُعتبر عرقلة إشارة ال5-HT3 وسيلة من وسائل منع حدوث التقيؤ الشديد قصير المدى. وتشمل مثبطات ال5-HT3 التي تم الموافقة عليها: الDolasetron أو (Anzemet)، والGranisetron أو (Kytril, Sancuso)، والOndansetron أو (Zofran). ويمنع الpalonosetron أو (Aloxi)، وهو أحدث مثبطات ال5-HT3، تأخر الغثيان والقيء الذي يحدث بعد انتهاء العلاج من يومين لخمسة أيام. وافقت إدارة الغذاء والدواء الأمريكية على الgranisetron transdermal patch أو (Sancuso) في شهر سبتمبر عام 2008. يُستخدم الدواء قبل العلاج الكيميائي بـ24-48 ساعة، ويُمكن استمراره لمدة تصل إلى 7 أيام حسب مدة العلاج الكيميائي.
ظهر دواء آخر يُساعد في السيطرة على الغثيان لدى مرضى السرطان في عام 2005. أثبت مثبط المادة P واسمه aprepitant (يتم تسويقه باسم Emend) فاعليته في السيطرة على الغثيان الناتج عن العلاج الكيميائي للسرطان. ونشرت نتائج تجربتين كبيرتين في عام 2005 تصفان فاعلية هذا الدواء مع أكثر من 1،000 مريض.[41]
زعمت بعض الدراسات [42] ومجموعة من المرضى بأن استخدام الحشيش المشتق من الماريجوانا خلال العلاج الكيميائي يُقلل الغثيان والقيء بنسبة كبيرة، مما يُمكِّن المريض من الأكل. ويُمكن استخدام بعض المشتقات التركيبية للمادة النشطة في الماريجوانا (التتراهيدروكانابينول) مثل الMarinol. كما تستخدم الماريجوانا الطبيعية، المعروفة باسم الماريجوانا الطبية. وقد أوصى بها بعض أطباء الأورام على الرغم من تحريم بعض الأماكن استخدامها قانونياً.[43]
فقدان الشعر
قد يحدث فقدان الشعر بسبب العلاج الكيميائي الذي يقتل الخلايا سريعة الانقسام؛ وقد تتسبب العلاجات الأخرى في تساقط الشعر. عادة ما تكون هذه آثار مؤقتة: يبدأ الشعر في النمو مرة أخرى بعد بضعة أسابيع من آخر علاج، وقد يحدث أحياناً تغير في لون الشعر، قوامه، كثافته وشكله. في بعض الأحيان ينبت الشعر الجديد أجعد، فيما يسمى "الشعر الأجعد الكيميائي". يحدث فقدان شديد للشعر بسبب العلاج بأدوية مثل الدوكسوروبيسين doxorubicin، الدونوروبيسين daunorubicin، الپاكليتاكسل paclitaxel، الدوكتاكسل docetaxel، السيكلوفوسفاميد cyclophosphamide، الإيفوزفاميد ifosfamide والإتوپوسيد etoposide. تساقط أو فقدان الشعر الدائم قد يكون بسبب بعض أنظمة العلاج الكيميائي القياسية.
يحدث تساقط الشعر الناجم عن العلاج الكيميائي بواسطة آلية غير أندروجينية، ويمكن أن تظهر في صورة ثعلبة شاملة alopecia totalis، تساقط الشعر الكربي telogen effluvium، أو الشكل الأقل شيوعاً، الثعلبة alopecia areata.[44] عادة ما يرتبط فقدان الشعر بالعلاج الممنهج بسبب ارتفاع معدل انقسام بصيلات الشعر، الأكثر انعكاساً عن فقدان الشعر الأندروجيني،[45][46] على الرغم من احتمال حدوث الحالات الدائمة.[47] قد يؤدي العلاج الكيميائي لفقدان الشعر في النساء أكثر من الرجال.[48]
يعتبر تبريد فروة الرأس من الوسائل التي تمنع فقدان الشعر المؤقت والدائم؛ ومع ذلك، فقد ظهرت مخاوف من هذه الطريقة.[49][50]
الأورام الثانوية
يمكن أن تتكون أورام ثانوية بعد نجاح العلاج الكيميائي أو العلاج الإشعاعي وانتهائه. ومن أشهره تلك الأورام أبيضاض الدم النقوي الحاد، الذي يتكون أولاً بعد العلاج باستخدام عوامل الألكلة أو مثبطات التوبايسوميراز.[51] وأظهرت دراسات أخرى زيادة نسبة السكان الذين يتعرضون إلى أورام ثانوية بحوالي 13.5 ضعفاً، وذلك بعد مرور 30 سنة من العلاج.[52]
العقم
بعض أنواع العلاج الكيميائي سامة على الغدد التناسلية وقد تسبب العقم.[53] لأدوية العلاج الكيميائي مخاطر مرتفعة ومنها الپروكاربازين وأدوية ألكيلاتية أخرى مثل السيكلوفوسفاميد، الإفسوفاميد، البوسفولفان، الملفالان، الكلورامبوسيل، والكلورميثين.[53] الأدوية ذات معدل الخطورة المتوسط تشمل الدوكسوبروبيسين ونظائر الپلاتين مثل السيسپلاتين والكاربوپلاتين.[53] ومن جهة أخرى، فالعلاج ذات الخطر المتوسط على الغدد التناسلية تشمل الأدوية المشتقة من النباتات مثل الڤينكريستين والڤينبلاستين، المضادات الحيوية مثل البليوماسين والداكتينوماسين، ومضادات الاستقلاب مثل المثتوركسات، المركاپتوپورين، و5-فلوروراسيل.[53]
يظهر العقم عند النساء نتيجة للعلاج الكيميائي على صورة ثانوية إلى فشل المبيض المبكر بفقدان الجريبات البدائية.[54] لا يكون هذا الفقدان بالضرورة أثراً مباشراً لأدوية العلاج الكيميائي، لكنه قد يرجع للمعدل المتزايد لبدء النمو ليحل محل الجريبات النامية المتضررة.[54]
قد يختار الأشخاص بين مختلف وسائل حفظ الخصوبة قبل بدء العلاج الكيميائي، وتشمل الحفظ بالتبريد للسائل المنوي، نسيج المبيض، البويضات، أو الأجنة.[55] بما أن أكثر من نصف مرضى السرطان هم من كبار السن، فإن هذا التأثير الضار يرتبط فقط بأقلية من المرضى. في دراسة عقدت في فرنسا بين عام 1999 و2011 وُجد أن الأجنة المجمدة قبل بدء العلاج بالعوامل السامة على الغدد التناسلية للإناث قد تسببت في تأخير علاج 34% من الحالات، مع فترة المتابعة التي تتراوح بين 1 و13 سنة.[56]
وتشمل العوامل الواقية أو المخففة المحتملة GnRH analogs، حيث أظهرت مختلف الدراسات أن أثراً حمائياً في المعمل لدى البشر، لكن بعض الدراسات لم تظهر مثل هذا الأثر. ظهر أن Sphingosine-1-phosphate (S1P) تاثير مشابه، لكن آلية تثبيطه sphingomyelin apoptotic pathway قد تتداخل أيضاً مع تأثير الاستماتة لأدوية العلاج الكيميائي.[57]
في العلاج الكيميائي مثل النظام المكيف في زراعة الخلايا الجذعية للنخاع العمي، أظهرت إحدى الدراسات لأشخاص متكيفين مع السيكلوفوسفاميد وحده بسبب فقر الدم اللاتنسجي الحاد الذي جاء نتيجة تنشيط المبيض في جميع النساء دون سن 26 سنة في وقت الزرع، ولكن في خمس فقط من بين 16 امرأة أكبر من 26 سنة.[58]
التشوهات الخلقية
للعلاج الكيميائي تأثيرات تشوهية أثناء الحمل، وخاصة في الأشهر الثلاثة الأولى منه، وتمتد لتصل إلى الأجهاض والذي عادة ما يُنصح به إذا اكتشف وجود حمل أثناء العلاج الكيميائي.[59] الأشهر الثلاث الثانية والأخيرة (من 4-6، ومن 7-9) لا تزيد فيها عادة مخاطر التشوهات والآثار الضارة على النمو المعرفي، لكن قد يزيد فيها مخاطر الإصابة بمضاعفات الحمل المختلفة وكب نقى العظام القاتل.[59]
في الذكور الذين خضعوا في السابق للعلاج الكيميائي أو الإشعاعي، يبدو أنه لا توجد زيادة في الأمراض الوراثية أو التشوهات الخلقية لدى أطفالهم بعد العلاج.[59] استخدام تقنيات التلقيح بالمساعدة وتقنية الميادية مجهرية قد تزيد من هذا الخطر.[59] في الإناث اللواتي سبق لهن الخضوع للعلاج الكيميائي، لم تجدث زيادة في نسبة الإجهاض والتشوهات الخلقية في حالات الحمل اللاحقة.[59] ومع ذلك، فعند اللجوء إلى التلقيح الاصطناعي وتجميد الأجنة بعد فترات العلاج الكيميائي أو بعد مدة وجيزة منه، تزيد المخاطر الوراثية المحتملة على البويضات، وبالتالي يُوصى بإجراء فحص للأطفال.[59]
اعتلال الأعصاب المحيطية
يعاني ما بين 30 و4 في المائة من الأشخاص الذي يخضعون للعلاج الكيميائي من الاعتلال العصبي المحيطي الناجم عن العلاج الكيميائي (CIPN)، حالة مرضية متقدمة، دائمة، وغير قابلة للشفاء في كثير من الأحيان، تسبب الألم، الوخز، والخدر والحساسية للبرد، وتبدأ في اليدين والقدمين وأحياناً تتقدم إلى الذراعين والساقين.[60] أدوية العلاج الكيميائي المرتبطة بالاعتلال العصبي المحيط هي الثاليدوميد thalidomide، الإپثيلونات epothilone، أشباه قلوية ڤينكا، التاكسانات، مثبطات الپروتوسوم، والأدوية المشتق من الپلاتنيوم.[60][61] تحديد الإصابة بالمرض ودرجة تقدمه يتم عن طريق اختيار الدواء، مدة الاستخدام، وإجمالي الكمية المستهلكة وما إذا كان المريض مصاباً بالفعل بالاعتلال العصبي المحيطي. على الرغم من أن الأعراض هي في الغالب حسية، إلا أنه في بعض الحالات تتأثر الأعصاب الحركية والجهاز العصبي التلقائي.[62] عادة ما يحدث الاعتلال العصبي المحيط بعد أول جرعة من العلاج الكيميائي وتزيد حدته مع استمرار العلاج، لكن هذا التقدم عادة ما يستقر عند الانتهاء من العلاج. الأدوية المشتقة من الپلاتنيوم تعتبر استثناء؛ مع هذه الادوية، قد يستمر الإحساس بالتدهور لعدة أشهر بعد انتهاء العلاج.[63] ويبدو أن بعد حالات الاعتلال العصبي المحيطي الناجم عن العلاج الكيميائي لا يمكن علاجها.[63] يمكن السيطرة على الألم في كثير من الأحيان عن طريق العلاج الدوائي أو غيرها من العلاجات، ولكن عادة ما يكون الخدر مقاومًا للعلاج.[64]
ضعف الإدراك
أفاد بعض الأشخاص الذين يتلقون العلاج الكيميائي بمعاناتهم من التعب أو مشاكل عصبية غير محددة، مثل عدم القدرة على التركيز؛ ويسمى هذا أحياناً العجز المعرفي ما بعد العلاج الكيميائي (post-chemotherapy cognitive impairment)، الذي يشار إليه في وسائل الإعلام والتواصل الاجتماعي "بالدماغ الكيميائي".[65]
متلازمة انحلال الورم
في الأورام والسرطانات الضخمة بصفة خاصة مع ارتفاع عدد الخلايا البيضاء، مثل اللمفوات، الأورام المسخية وبعض أنواع اللوكميا، تتطور لدى بعض الأشخاص [[متلازمة انحلال الورمي]. الانحلال السريع للخلايا السرطانية يؤدي إلى إطلاق مواد كيميائية من داخل الخلايا. في أعقاب هذا، ترتفع معدلات حمض اليوريك، الپوتاسيوم والفوسفات في الدم. المعدلات المرتفعة من الفوسفات تؤدي إلى حدوث فرط فوسفات الدم من الدرجة الثانية، مما يؤدي إلى انخفاض معدلات الكالسيوم في الدم. يتسبب هذا في تضرر الكلى وقد يؤدي ارتفاع معدلات الپوتاسيوم إلى الإصابة باضطراب النظم. على الرغم من أن انحلال الورم مرتبط وعادة ما يكون موجوداً لدى المصابين بالأورام الضخمة، إلا أن هذا الأثر الجانبي الخطير قد يؤدي إلى الوفاة إذا لم يتم علاجه.[66]
تضرر الأعضاء
تسمم القلب (Cardiotoxicity) هو مرض شائع بشكل خاص مع استخدام أدوية الأنثراسيكلين (الدوكسوروبيسين، الإپيروبيسين، [[إيداروبيسين|الإيداروبيسين]، والليپوسومال دوكسوروبيسين). يرجع السبب في هذا غالباً إلى انتاج الجذور الحرة في الخلايا وما يتبعه من تضرر الدنا. أدوية العلاج الكيميائي الأخرى التي تتسبب في تسمم القلب، لكن بدرجة أقل، هي السيكلوفوسفاميد، الدوكتاكسل والكلوفارابين.[67]
تسمم الكبد (Hepatotoxicity) قد يحدث نتيجة للكثير من الأدوية السامة خلوياً. يمكن تغيير قابلية الشخص لتلف الكبد بعوامل أخرى مثل السرطان نفسه، الالتهاب الكبدي الڤيروسي وسوء التغذية. قد يتضمن تضرر الكبد تلف خلايا الكبد، متلازمة الانسداد الوريدي الكبدي (انسداد أوردة الكبد)، الركود الصفراوي (حيث لا تتدفق العصارة الصفراوية من الكبد إلى الأمعاء) و[[تشمع الكبد ]].[68][69]
تسمم الكلى (Nephrotoxicity) قد ينتج عن الإصابة بمتلازمة الانحلال الورمي وقد يكون أيضاً أثراً مباشراً لخروج الأدوية عن طريق الكلى. تؤثر الأدوية المختلفة على مناطق مختلفة من الكلى وقد تكون السمية بدون أعراض (عادة ما تظهر في تحاليل الدم أو البول) أو قد تتسبب في الفشل الكلوي الحاد .[70][71]
التسمم الأذني (Ototoxicity، تضرر الأذن الداخلية) هو أثر جانبي شائع لاستخدام الأدوية المشتقة من الپلاتنيوم والتي قد تتسبب في ظهور أعراض مثل الطنين والدوار.[72][73]
الآثار الجانبية الأخرى
قد يتعرض بعض المرضى إلى متلازمة انحلال الورم في حالة الأورام الكبيرة مثل الأورام اللمفاوية الكبيرة. وذلك نتيجة الانهيار السريع للخلايا الخبيثة. على الرغم من أنه يتم إعطاء مرضى الأورام الكبيرة أساليب الوقاية اللازمة، يُعد ذلك من الآثار الجانبية الخطيرة التي قد تسبب الوفاة إذا ما لم يتم علاجها.
تشمل الآثار الجانبية الأقل شيوعاً الألم، وإحمرار الجلد (الحمامي)، وجفاف الجلد، وتلف الأظافر، وجفاف الفم، والاحتفاظ بالماء، والعجز الجنسي. وقد تسبب بعض الأدوية الإصابة بالحساسية.
سجَّل بعض المرضى شعورهم بالتعب أو تعرضهم لمشاكل عصبية غير محددة، مثل عدم القدرة على التركيز؛ وهو يسمى أحياناً بضعف الإدراك بعد انتهاء العلاج الكيميائي. كما يُطلق عليه بعض المرضى اسم "مخ العلاج الكيميائي".[65]
يَصحب بعض المواد الكيميائية المحددة تسمم بعض الأعضاء مثل: أمراض القلب والأوعية الدموية (الدوكسوروبيسين)، ومرض الرئة الخلالي (الbleomycin) والأورام الثانوية (علاج الأورام الهودجكنية باستخدام الMOPP).
القيود
لا يعمل العلاج الكيميائي في جميع الحالات، وحتى عندما يكون مفيداً، فإنه لا يدمر السرطان بشكل كامل. وفي كثير من الأحيان يفشل بعض الأشخاص في فهم قيوده. أظهرت إحدى الدراسات أن الأشخاص الذين تم تشخيصهم حديثاً كحالات غير قابلة للشفاء، سرطان من الدرجة الرابعة، يشكلون أكثر من ثلثي الأشخاص المصابين بسرطان الرئة وأكثر من أربع أخماس المصابين بسرطان المستقيم لا زالوا يعتقدون أن العلاج الكيميائي على الأرجح سيعالجهم.[74]
يشكل الحاجز الدموي الدماغي عقبة في طريق وصول العلاج الكيميائي إلى الدماغ. يرجع هذا إلى أن الدماغ لديه نظام واسع النطاق لحمايته من المواد الكيميائية الضارة. يمكن لناقلات الدواء ضخ الأدوية من الدماغ والخلايا الدموية للدماغ إلى السائل الدماغي الشوكي والدورة الدموية. تقوم هذه الناقلات بضخ معظم أدويةالعلاج الكيميائي، مما يقلل من فعاليتها لعلاج أورام المخ. فقط عوامل الألكلة الصغيرة المحبة للدهن مثل اللوموستين أو التموزولوميد هي القادرة على عبور هذا الحاجز الدموي الدماغي.[75][76][77]
تختلف الأوعية الدموية داخل الأورام بشكل كبير عن تلك الموجودة في الأنسجة الطبيعية. مع نمو الورم، تصبح الخلايا الورمية أبعد من الأوعية الدموية منخفضة الأكسجين (نقص الأكسجة). لمواجهة هذا تقوم بإصدار إشارات إلى تشير الأوعية الدموية الجديدة كي تنمو. الأوعية الدموية الورمية حديثة النشأة تكون ضعيفة التكوين ولا تقدم إمدادات دم كافية لجميع مناطق الورم. يؤدي هذا إلى مشكلات في توصيل الدواء لأن العديد من الأدوية سيتم توصيلها إلى الورم عن طريق الجهاز الدوري.[78]
المقاومة
تعتبر المقاومة سبباً رئيسياً لفشل أدوية العلاج الكيميائي. هناك بضعة أسباب محتملة لمقاومة السرطان للعلاج، منها وجود مضخات صغيرة على سطح الخلايا السرطانية تزيح بنشاط العلاج الكيميائي من داخل الخلية إلى خارجها. تنتج الخلايا السرطانية كميات مرتفعة من هذه المضخات، والمعروفة بالپروتين سكري-پ، من أجل حماية نفسها من أدوية العلاج الكيميائي. تجرى حالياً أبحاث حول الپروتين سكري-پ ومضخات طرح العلاج الكيميائي الأخرى. كما تجرى دراسات حول الأدوية المثبطة لوظيفة الپروتين سكري-پ، لكن نظراً لسميتها وتفاعلها مع الأدوية المضادة للسرطان كان من الصعب تطويرها.[79][80] هناك آلية أخرى للمقاومة وهي تضخيم الجينات، عملية تقوم فيها الخلايا السرطانية بإنتاج عدة نسخ من الجين. يتغلب هذا على تأثير الأدوية التي تقلل من التعبير عن الجينات المشاركة في النسخ المتماثل. مع المزيد من نسخ الجين، لا يمكن للدواء منع كل تعبير عن الجين، وبالتالي يمكن للخلية استعادة قدرتها التكاثرية. يمكن أن تسبب الخلايا السرطانية أيضًا عيوبًا في المسارات الخلوية للاستموات (موت الخلية المبرمج). بهذه الطريقة تقتل معظم أدوية العلاج الكيميائي الخلايا السرطانية، يسمح الاستموات المعيب ببقاء هذه الخلايا، مما يجعلها مقاومة للأدوية. كما تسبب الكثير من أدوية العلاج الكيميائي في تضرر الدنا، الذي يمكن اصلاحها عن طريق الانزيمات الموجودة في الخلية التي تتولى إصلاح الدنا. Upregulation هذه الجينات يمكن أن يؤدي إلى التغلب على أضرار الحمض النووي (DNA) ومنع استحثاث الاستموات. الطفرات الجينية التي تنتج الپروتينات المستهدفة للأدوية، مثل التيوبيولين، يمكن أن تؤدي إلى منع الأدوية من الارتباط بالپروتين، مما يؤدي إلى مقاومة هذه الأنواع من الأدوية.[81] الأدوية المستخدمة في العلاج الكيميائي قد تحث إجهاد الخلية، الذي قد يمكن من القضاء على الخلية السرطانية، ومع ذلك، تحت ظروف معينة قد يؤدي إجهاد الخلايا إلى تغيرات في التعبير الجيني مما يمكن الخلايا من مقاومة أنواع مختلفة من الأدوية.[82]
السموم الخلوية والعلاجات الموجهة
العلاجات الموجهة هي فئة جديدة نسبياً من أدوية السرطان والتي يمكنها التغلب على العديد من القضايا المتعلقة باستخدام السموم الخلوية. وهي مقسمة إلى مجموعتين: جزيئات صغيرة وأجسام مضادة. ترجع السمية الهائلة الذي يشهده استخدام السموم الخلوية إلى عدم تخصص هذه الأدوية. تقوم هذه الأدوية بقتل أي خلايا سريعة الانقسام، سواء سرطانية أو طبيعية. أما العلاج الموجه فهو علاج مصمم للتأثير على الپروتينات الخلوية أو العمليات التي تستخدمها الخلايا السرطانية. يسمح هذا بحصول الأنسجة السرطانية على جرعات دوائية عالية مع جرعات منخفضة نسبياً للأنسجة الأخرى. على الرغم من أن الآثار الجانبية لتلك الأدوية عادة ما تكون أقل من السموم الخلوية الأخرى المستخدمة في العلاج الكيميائي، إلا أن الآثار المههدة للحياة قد تكون قائمة. في البداية، كان من المفترض أن تكون العلاجات الموجهة انتقائية فقط لپروتين واحد. لكن اتضح الآن أن هناك مجموعة من الپروتينات المستهدفة والتي يمكن للدواء الارتباط بها. ومن أمثلة الپروتينات المستهدفة من العلاج الموجه هو الپروتين الذي ينتجه كروموسوم فيلادلفيا، آفة وراثية عادة ما توجد في ابيضاض الدم النقوي المزمن. لهذه الآفة الپروتينية نشاط انزيمي يمكن تثبيطه عن طريق الإيماتينيب، أحد أدوية الجزيئات الصغيرة.[83][84][85][86]
آلية العلاج
السرطان هو نمو الخلايا بشكل مُطْلَق، ويُصَاحِبَهُ سلوك خبيث: إما الغزو أو النقيلة. ويُعتقد بأن السرطان ينجم عن التفاعل بين التأثيرات الجينية والسموم البيئية.
تعمل معظم أدوية العلاج الكيميائي عن طريق الانقسام الفتيلي (الانقسام الخلوي)، ومن ثم استهداف الخلايا التي تنقسم بسرعة. وتوصف هذه العقاقير بأنها قاتلة للخلايا لأنها تُسَبِّب تلفاً للخلايا. وتُسبب بعض العقاقير تعرض الخلايا إلى الاستماتة (وهو ما يسمى بـ"موت الخلية المُبَرْمَج").
لم يُحَدِّد العُلَماء بعد السمات الخاصة بالخلايا الخبيثة وخلايا المناعة، ومن ثم يَسهل استهدافها (باستثناء بعض الأمثلة مثل استهداف عقار الإماتينيب (imatinib) لصبغي فيلادلفيا). وهذا يعني إلحاق الضرر بالخلايا الأخرى سريعة الانقسام مثل تلك المسؤولة عن نمو الشعر واستبدال ظهارة الأمعاء (البطانة). ومع ذلك، تتراوح خطورة الآثار الجانبية من عقار لآخر مما يُتيح للأطباء تعديل أنظمة العلاج لصالح المرضى.
وبما أن العلاج الكيميائي يُؤثر على الانقسام الخلوى، تعتبر الأورام سريعة النمو (مثل أبيضاض الدم النقوي الحاد، والورم اللمفي، بما في ذلك لمفومة هودجكين) أكثر حساسية للعلاج الكيميائي، وذلك لانقسام نسبة كبيرة من الخلايا المُسْتَهْدَفة في أي وقت. ولا تستجيب الأورام الخبيثة بطيئة النمو (مثل اللمفومات الكسولة) للعلاج الكيميائي بشكل كبير.
وتُؤثِّر العقاقير على الأورام "الصغيرة" بشكل أكثر فاعلية، وذلك بسبب الحفاظ على الآليات التي تُنَظِّم نمو الخلايا. ومع ظُهور أجيال جديدة من الخلايا السرطانية، يَصْعُب التمييز بينها لأنها تنمو بشكل غير مُنتظم. وبالتالي، تُصبح الأورام أقل استجابة لمعظم وسائل العلاج الكيميائي. يتوقف الانقسام الخلوى بالقرب من مركز بعض الأورام الصلبة، مما يجعلها لا تستجيب للعلاج الكيميائي. ولا تستطيع المادة الكيميائية الوصول إلى مركز الأورام الصلبة في معظم الأحيان. يكمن الحل لتلك المشكلة في العلاج الإشعاعي (العلاج الإشعاعي القصير والعلاج الإشعاعي عن بعد) والجراحة.
وبمرور الوقت، تُقَأوِم الخلايا السرطانية العلاج الكيميائي. حيث اكتشف العلماء مؤخراً وجود مضخَّات صغيرة على سطح الخلايا السرطانية تقوم بإخراج المادة الكيميائية من داخل الخلية. وهناك العديد من الأبحاث المتعلقة ببروتين ب.ج.ب وغيره من المضخات التي تُؤَدي إلى هروب العلاج الكيميائي من الخلايا السرطانية. وهذا بالإضافة إلى اختبار بعض الأدوية التي تعوق بروتين ب.ج.ب من القيام بوظيفته اعتباراً من شهر يونيو عام 2007، وذلك لتعزيز فاعلية العلاج الكيميائي.
استخدامات أخرى
تستخدم بعض أدوية العلاج الكيميائي لعلاج أمراض أخرى غير السرطان، مثل اضطرابات المناعة الذاتية،[87] اعتلال الخلية الپلازمية الغير سرطاني. في بعض الحالات عادة ما تستخدم بجرعات منخفضة، مما يعني أن الآثار الجانبية تكون محدودة،[87] بينما في حالات أخرى يتم استخدام جرعات مماثلة لتلك المستخدمة لعلاج السرطان. يستخدم المثوتركسات في علاج التهاب المفاصل الرثياني، [88] الصدفية،[89] التهاب الفقار المقسط[90] والتصلب المتعدد.[91][92] يعتقد أن الاستجابة المضادة للالتهابات في حالة التهاب المفاصل الرثياني ترجع إلى زيادة الأدينوزين، مما يسبب كبت المناعة؛ آثار على مسارات انزيم السايكلوأوكسيجنيز -2 المنظم للمناعة؛ انخفاض السيتوكينات الالتهابية؛ والخصائص المضادة للتكاثر.[88] على الرغم من استخدام المثوتركسات لعلاج كلا التصلب المتعدد والتهاب الفقار المقسط، إلا أن تأثيره على هذه الأمراض لا يزال غير مؤكد.[90][91][92] يستخدم السيكلوفوسفاميد أحياناً لعلاج التهاب الكلية الذئبي، أحد الأعراض الشائعة للذئبة الحمامية المجموعية.[93] يستخدم الدكسامثازون مع البورتزوميب أو الملفالان لعلاج AL amyloidosis. مؤخراً أظهر استخدام البورتزوميد مع السيكلوفوسفاميد نتائج واعدة كعلاج AL amyloidosis. أظهرت أدوية أخرى تستخدم لعلاج الورم النقوي المتعدد مثل الناليدوميد نتائج مبشرة لعلاج AL amyloidosis.[94]
كما تستخدم أدوية العلاج الكيميائي في الأنظمة التكيفية قبل ]زراعة نخاع العظام. تستخدم الأنظمة التكيفية لكبت الجهاز المناعي المستقبل ما أجل السماح لعملية الزرع. السيكلوفوسفاميد هو علاج سمي خلوي شائع يستخدم بهذه الطريقة، عادة ما يستخدم بالتزامن مع تشعيع الجسم الكامل (العلاج الإشعاعي لكامل الجسم). قد تستخدم أدوية السيكلوفوسفاميد بجرعات عالية لإزالة الخلايا النخاعية بالكامل لدى المريض أو بجرعات منخفضة تمنع فقدان النخاع العظمي بشكل دائم.[95] عند استخدامه في علاج الأمراض الغير سرطانية، لا يزال يسمى "العلاج الكيميائي"، وعادة ما يتم في نفس مراكز العلاج المستخدمة من قبل المصابين بالسرطان.
الاحتياطات المهنية
يتخذ أفراد الرعاية الصحية المعرضون للأدوية المضادة للأورام الاحتياطات اللازمة للحفاظ على الحد الأدنى للتعرض. هناك قيود على dissolution السموم الخلوية في أستراليا والولايات المتحدة إلى 20 حالة dissolution لكل صيدلي ممرضة،[بحاجة لمصدر] حيث أن الصيادلة الذين يقومون بإعداد هذه الأدوية، أو الممرضين الذين قد يقوموا بإعدادها أو إدارتها هما المجموعتان المهنيتان اللتان تتمتعان بأعلى نسبة ممكنة من عوامل مضادات الأورام. بالإضافة إلى ذلك، قد يتعرض الأطباء وأفراد غرفة العمليات أيضًا أثناء علاجهم المرضى. طاقم المستشفيات، مثل موظفي الشحن والاستقبال، وعمال الاحتجاز، وعمال الغسيل ومعالجي النفايات، قد يكونون معرضين أيضاً لهذه الأدوية أثناء عملهم. الاستخدام المتزايد لمضادات الأورام في علم الأورام البيطري يضع هؤلاء الأفراد أيضاً عرضة للتعرض لهذه الأدوية.[96][97] مسارات دخول هذه الأدوية لجسم العاملين المعرضين عن طريق امتصاص البشرة، الاستنشاق، والبلع من اليد إلى الفم.[97] وتشمل الآثار طويلة المدى للتعرض الاضطرابات الصبغية والعقم.[66]
العوامل المتوافرة
هناك قائمة مفصلة لمضادات الأورام تم استخدام عدد من مخططات التصنيف لتقسيم الأدوية المستخدمة لعلاج السرطان إلى أنواع مختلفة عديدة.[بحاجة لمصدر]
التاريخ

يُعْتَقَد أن استخدام الأدوية التي تعتمد على المعادن والنباتات يعود إلى فترة طب ما قبل التاريخ.
تم علاج السرطان باستخدام العقاقير لأول مرة في أوائل القرن العشرين، على الرغم من أنه لم يكن مقصوداً. استُخدم غاز الخردل في الحرب العالمية الأولى كنوع من الأسلحة الكيميائية، وتم دراسته بشكل أكبر خلال الحرب العالمية الثانية، حيث تعرض مجموعة من الناس خلال عملية عسكرية لغاز الخردل بالصدفة، وتَبَيَّن أنهم يعانون من انخفاض في نسبة خلايا الدم البيضاء نتيجة لذلك.[98] وبالتالي، يُمكن أن يكون للغاز تأثير على الخلايا السرطانية، مثلما يُؤَثِّر على خلايا الدم البيضاء التي تنمو بسرعة. ومن ثم تم إعطاء هذا العقار للعديد من مرضى سرطان خلايا الدم البيضاء عن طريق الوريد في الأربعينيات، بدلاً من استنشاق الغاز بشكل مباشر. وقد تحسنوا بشكل واضح، على الرغم من أنه تحسن مؤقت.[99][100] ودفعت هذه التجربة الباحثين للتفتيش عن غيره من المواد التي قد يكون لها تأثير مماثل على الخلايا السرطانية. ونتيجة لذلك، ظهر العديد من العقاقير الأخرى لعلاج السرطان. وأصبحت تلك الصناعة تُكَلِّف مليارات الدولارات، على الرغم من وجود بعض القيود الخاصة بالعلاج الكيميائي حتى الآن.[101]
المبيعات
أدوية السرطان العشر الأكثر مبيعاً (من حيث الإيرادات بالدولار) في 2013:[102]
| الترتيب | المبيعات العالمية 2013 | INN | الاسم التجاري | حامل ترخيص التسويق | دواعي الاستعمال |
|---|---|---|---|---|---|
| 1 | 7.78 بليون | ريتوكسيماب | ريتوكسان ، مابتـِرا | روش، فارمستاندرد | اللمفوما لاهودجكينية، اللوكيميا الليمفاوية المزمنة |
| 2 | 6.75 بليون | بڤاسيزوماب | أڤاستين | روش | سرطان القولون والمستقيم، الرئة، المبيض، والمخ |
| 3 | 6.56 بليون | تراستوزوماب | هرسپتين | روش | سرطان الثدي، المريء والمعدة |
| 4 | 4.69 بليون | إيمينتاب | گليڤك | نوڤارتيس | اللوكيميا، سرطان الجهاز الهضمي |
| 5 | 1.09 بليون | لناليدوميد | رڤليميد | كلجن، فارمستاندرد | ورم نقوي متعدد، لمفوما الغشاء الخلوي اللمفاوي |
| 6 | 2.7 بليون | پمتركسد | أليمتا | إلي ليلي | سرطان الرئة |
| 7 | 2.6 بليون | بورتزوميب | ڤلساد | جونسون أند جونسون، تاكيدا، فارمستاندرد | ورم نقوي متعدد |
| 8 | 1.87 بليون | ستوكسيماب | إبريتوكس | مرك، بريستول-مايرز سكويب | سرطان القولون والرأس والعنق |
| 9 | 1.73 بليون | ليپرورلين | لوپرون، إليگارد | أبڤي أند تاكدا؛ سانوفي أند أستلاس فارما | سرطان الپروستاتا والمبيض |
| 10 | 1.7 بليون | أبيراترون | زيتيگا | جونسون أند جونسون | سرطان الپروستاتا |
الأبحاث

العلاجات الموجهة
تهدف مركبات الأدوية الموجهة بشكل خاص إلى زيادة مستويات فعالية العلاج الكيميائي على الخلايا الورمية مع تقليل مستويات فعاليتها على الخلايا الأخرى. ينبغي أن يؤدي هذا إلى القضاء على الورم بشكل متزايد مع انخفاض السمية أو كليهما معاً.[103]
مترافقات الأجسام المضادة
تضم مترافقات الأجسام المضادة جسم مضاد، دواء ورابط بينهما. سوف يستهدف الجسم المضاد پروتين معبر عنه بشكل تفضيلي في الخلايا الورمية (يُعرف بالمستضد الورمي) أو على الخلايا التي يمكن أن يستخدمها الورم، مثل البطانة الغشائية للأوعية الدموية. ترتبط بالمستضدات الورمية ويتم استيعابها، حيث ينتشر رابط الدواء في الخلية. تتباين مركبات توصيل الدواء المستهدِفة هذه في ثباتها وانتقائها واختيارها، ولكنها، في جوهرها، تهدف جميعها إلى زيادة الجرعة الفعالة القصوى التي يمكن توصيلها للخلايا الورمية.[104] السمية الممنهجة المنخفضة تعني أنه يمكن استخدامها أيضًا في الأشخاص المصابين بمرض، وأنهم يستطيعون تحمل أدوية علاج كيميائي جديدة كان من الممكن أن تكون شديدة السمية بحيث لا يمكن توصيلها عبر الطرق التقليدية.[بحاجة لمصدر]
كان أول دواء معتمد من هذا النوع هو گمتوزوماب أوزوگاميسين (مايلوتارگ)، والذي طرحته وايث (فايزر حالياً). تم اعتماد الدواء لعلاج ابيضاض الدم النقوي الحاد، لكن تم سحبه حالياً من الأسواق لأن الدواء لم يستوف أهداف الفعالية في تجارب سريرية أخرى.[105][106] الدواءان الآخران، تراستوزوماب إمتانسين وبرنتوكسيماب ڤدوتين، كلاهما قيد التجار السريرية، تم منح الأخير موافقة تسريع لعلاج لمفومة هودجكن المقاومة والأورام اللمفاوية للخلايا الكبيرة المتحولة الممنهجة.[104]
الجسيمات النانوية
الجسيمات النانوية هي جزيئات بحجم 1-1000 نانومتر يمكنها أن تعزز الانتقائية للورم والمساعدة في إيصال الأدوية منخفضة الذبانية. يمكن استهداف الجسيمات النانوية بشكل سلبي أو نشط. يُستغل الاستهداف السلبي للتفرقة بين الأوعية الدموية السرطانية والأوعية الدموية الطبيعية. الأوعية الدموية في الأورام تكون "مسربة" لأنها تحتوي على ثغرات من 200 إلى 2000 nbsp؛ نانومتر، مما يسمح للجسيمات النانوية بالهروب داخل الورم. يستخدم الاستهداف النشط الجزيئيات الحيوية (الأجسام المضادة)، الپروتينات، الدنا وربيطات المستقبلات) لاستهداف جسيمات النانوية للخلايا الورمية بشكل تفضيلي. هناك عدة أنواع من أنظمة توصيل الدواء بالجسيمات النانوية، مثل السيليكا، الپوليمرات، الليپوسومات والجزيئات المغناطيسية. تتكون الجزيئات النانوية من مادة مغناطيسية يمكن استخدامها أيضاً لتركيز الأدوية على مواقع الورم باستخدام المجال المغناطيسي المطبق خارجياً.[103] نشأت الجزيئات النانوية كآلية مفيدة في إيصال الدواء مغناطيسياً للعوامل منخفضة الذوبانية مثل پاكسليتاكسل].[107]
العلاج الكهروكيميائي
العلاج الكهروكيميائي هو علاج مجمع يتم فيه حقن دواء العلاج الكيميائي يليه تطبيق نبضبات كهربائية عالية الجهد موضعياً على الورم. تمكن هذه الطريقة أدوية العلاج الكيميائي، التي لا يمكنها المرور أو تمر بصعوبة عبر أغشية الخلية (مثل البليوماسين والسيسپلاتين)، من الدخول إلى الخلايا السرطانية. بالتالي، يمكن الحصول على فعالية أكبر لعلاج الأورام.
أُستخدم العلاج الكهروكيميائي السريري بنجاح في علاج الأورام الجلدية والتحت جلدية بصرف النظر عن منشأها الهيستولوجي.[108][109][110][111][112][113] أُفيد أن هذه الطريقة آمنة، بسيطة وشديدة الفعالية في جميع تقارير الاستخدام السريري للعلاج الكهروكيميائي. تبعاً لمشروع ESOPE (إجراءات التشغيل المعياري الأوروپي للعلاج الكهروكيميائي)، أن التشغيل المعياري للعلاج الكهروكيميائي تم اعداده، بناءاً على خبرة مراكز السرطان الأوروپية الرائدة حول العلاج الكهروكيميائي.[110][114] مؤخراً، تم تطوير طرق جديدة للعلاج الكهروكيميائي لعلاج الأورام الداخلية باستخدام العمليات الجراحية، والطرق التنظيرية أو الطرق عن طريق الجلد للوصول إلى منطقة المعالجة.[115][116]
المعالجة الفرط حرارية
المعالجة الفرط حرارية هي العلاج الحراري للسرطان الذي يمكن أن يكون أداة قوية عند استخدامه مع العلاج الكيميائي (العلاج الكيميائي الحراري) أو العلاج الإشعاعي من أجل السيطرة على مجموعة متنوعة من السرطانات. يمكن تطبيق الحرارة موضوعياً على موضع الورم، والتي سوف تمدد الأوعية الدموية للورم، مما يسمح بوصول المزيد من العلاج الكيميائي داخل الورم. بالإضافة إلى ذلك، يصبح غشاء الخلية الورمية أكثر مسامية، مما يسمح لمزيد من الدواء العلاج الكيميائي بدخول الخلية الورمية.
كما اتضح أن المعالجة الفرط حرارية تساعد على منع أو عكس "المقاومة للعلاج الكيميائي". قد تتطور مقاومة العلاج الكيميائي أحياناً بمرور الوقت حيث يتطور الورم ويمكنه مقاومة سمية العلاج الكيميائي. "تم دراسة التغلب على المقاومة الكيميائية على نطاق واسع في الماضي، وخاصة باستخدام الخلايا المقاومة للسيسپلاتين. فيما يتعلق بالفائدة المحتملة التي يمكن تجنيدها للخلايا المقاومة للأدوية من أجل العلاج الفعال عن طريق الجمع بين العلاج الكيميائي مع العلاج الفرط حراري، كان من المهم إظهار أن المقاومة الكيميائية ضد العديد من الأدوية المضادة للسرطان (مثل الميتومايسين سي، الأنثارسيكلينز، الكارموستين، الملفالان) تتضمن السيسپلاتين يمكن عكسها على الأقل جزئياً بإضافة الحرارة.[117]
حيوانات أخرى
يستخدم العلاج الكيمائي في الطب البيطري بشكل مشابه لاستخدامه في الطب البشري.[118]
انظر أيضاً
- الأدوية المضادة للسرطان (جريدة)
- العلاج الكيميائي المضاد للميكروبات
- السرطان والغثيان
- التعب المرتبط بالسرطان
- العلاج ما بعد الكيميائي
- نظام العلاج الكيميائي
- ركود خلوي
- العلاجات التجريبية للسرطان
- التداول الآمن للأدوية الخطرة
- توصيل الدواء
- علاج فرط حراري
- العلاج المناعي
- الشبكة الوطنية لمكافحة السرطان الشامل
- التراجع المعرفي الناجم عن الإشعاع
- العلاج الإشعاعي
- العلاج الڤيروسي
مرئيات
المصادر
- ^ أ ب ت خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةCorrie - ^ Wagner, Anna Dorothea; Syn, Nicholas LX; Moehler, Markus; Grothe, Wilfried; Yong, Wei Peng; Tai, Bee-Choo; Ho, Jingshan; Unverzagt, Susanne (29 August 2017). "Chemotherapy for advanced gastric cancer". Cochrane Database of Systematic Reviews. 8: CD004064. doi:10.1002/14651858.cd004064.pub4. PMID 28850174.
- ^ Nastoupil LJ, Rose AC, Flowers CR (May 2012). "Diffuse large B-cell lymphoma: current treatment approaches". Oncology. 26 (5): 488–95. PMID 22730604.
- ^ Freedman A (Oct 2012). "Follicular lymphoma: 2012 update on diagnosis and management". American Journal of Hematology. 87 (10): 988–95. doi:10.1002/ajh.23313. PMID 23001911.
- ^ Rampling R, James A, Papanastassiou V (Jun 2004). "The present and future management of malignant brain tumours: surgery, radiotherapy, chemotherapy". Journal of Neurology, Neurosurgery, and Psychiatry. 75 Suppl 2 (Suppl 2): ii24–30. doi:10.1136/jnnp.2004.040535. PMC 1765659. PMID 15146036.
- ^ Madan V, Lear JT, Szeimies RM (Feb 2010). "Non-melanoma skin cancer". Lancet. 375 (9715): 673–85. doi:10.1016/S0140-6736(09)61196-X. PMID 20171403.
- ^ Du Bois D; Du Bois EF. "A formula to estimate the approximate surface area if height and weight be known. 1916". Nutrition. 5 (5): 303–11. PMID 2520314.
- ^ أ ب ت Felici A.; J. Verweij; A. Sparreboom (2002). "Dosing strategies for anticancer drugs: the good, the bad and body-surface area". Eur J Cancer. 38 (13): 1677–84. doi:10.1016/s0959-8049(02)00151-x.
- ^ أ ب ت Kaestner SA, Sewell GJ (Feb 2007). "Chemotherapy dosing part I: scientific basis for current practice and use of body surface area". Clinical Oncology. 19 (1): 23–37. doi:10.1016/j.clon.2006.10.010. PMID 17305252.
- ^ Donald Pinkel (August 1958). "The Use of Body Surface Area as a Criterion of Drug Dosage in Cancer Chemotherapy". Cancer Res. 18 (7): 853–6.
- ^ أ ب Gurney H (Apr 2002). "How to calculate the dose of chemotherapy". British Journal of Cancer. 86 (8): 1297–302. doi:10.1038/sj.bjc.6600139. PMC 2375356. PMID 11953888.
- ^ أ ب Beumer JH, Chu E, Salamone SJ (Nov 2012). "Body-surface area-based chemotherapy dosing: appropriate in the 21st century?". Journal of Clinical Oncology. 30 (31): 3896–7. doi:10.1200/JCO.2012.44.2863. PMID 22965963.
- ^ أ ب Baker SD; Verweij J; Rowinsky EK; Donehower RC; Schellens JH; Grochow LB; Sparreboom A (2002). "Role of body surface area in dosing of investigational anticancer agents in adults, 1991–2001". J Natl Cancer Inst. 94 (24): 1883–8. doi:10.1093/jnci/94.24.1883.
- ^ أ ب ت ث ج ح خ د ذ ر Gamelin EC; Delva R; Jacob J; Merrouche Y; Raoul JL; Pezet D; Dorval E; Piot G; Morel A; Boisdron-Celle M (2008). "Individual fluorouracil dose adjustment based on pharmacokinetic follow-up compared with conventional dosage: Results of a multicenter randomized trial of patients with metastatic colorectal cancer". J Clin Oncol. 26 (13): 2099–2105. doi:10.1200/jco.2007.13.3934. PMID 18445839.
- ^ Saam J; Critchfield GC; Hamilton SA; Roa BB; Wenstrup RJ; Kaldate RR (2011). "Body Surface Area-based Dosing of 5-Fluorouracil Results in Extensive Interindividual Variability in 5-Fluorouracil Exposure in Colorectal Cancer Patients on FOLFOX Regimens". Clin Colorectal Cancer. 10 (3): 203–206. doi:10.1016/j.clcc.2011.03.015.
- ^ أ ب ت ث ج ح خ Capitain O; Asevoaia A; Boisdron-Celle M; Poirier AL; Morel A; Gamelin E (2012). "Individual Fluorouracil Dose Adjustment in FOLFOX Based on Pharmacokinetic Follow-Up Compared With Conventional Body-Area-Surface Dosing: A Phase II, Proof-of-Concept Study". Clin Colorectal Cancer. 11 (4): 263–267. doi:10.1016/j.clcc.2012.05.004.
- ^ Kaldate RR; Haregewoin A; Grier CE; Hamilton SA; McLeod HL (2012). "Modeling the 5-fluorouracil area under the curve versus dose relationship to develop a pharmacokinetic dosing algorithm for colorectal cancer patients receiving FOLFOX6". Oncologist. 17 (3): 296–302. doi:10.1634/theoncologist.2011-0357. PMC 3316912.
- ^ أ ب ت Hunter RJ, Navo MA, Thaker PH, Bodurka DC, Wolf JK, Smith JA (Feb 2009). "Dosing chemotherapy in obese patients: actual versus assigned body surface area (BSA)". Cancer Treat Rev. 35 (1): 69–78. doi:10.1016/j.ctrv.2008.07.005. PMID 18922643.
- ^ Hanna, Louise; Crosby, Tom; Fergus Macbeth, eds. (2008). Practical clinical oncology. Cambridge, UK: Cambridge University Press. ISBN 0-521-61816-9.
{{cite book}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Buffery, PJ; Allen, KM; Chin, PKL; Moore, GA; Barclay, ML; Begg, EJ (2014). "Thirteen Years' Experience of Pharmacokinetic Monitoring and Dosing of Busulfan: Can the Strategy Be Improved?". Ther Drug Monit. 36 (1): 86–92.
- ^ Bartelink IH; Bredius RG; Belitser SV; Suttorp MM; Bierings M; Knibbe CA; Egeler M; Lankester AC; Egberts AC; Zwaveling J; Boelens JJ. "Association Between Busulfan Exposure and Outcome in Children Receiving Intravenous Busulfan Before Hematopoietic Stem Cell Transplantation". Ther Drug Monit. 36 (1): 93–99.
- ^ "ARK Methotrexate Assay". Ark Diagnostics.
- ^ "Customizing Chemotherapy for Better Cancer Care". My Care Diagnostics.
- ^ "A Brief History of BSA Dosing". My Care Diagnostics.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةSiddik - ^ أ ب ت تاكيموتو، كالفو "مبادئ المعالجة الدوائية لأمراض السرطان" بازدرو آر، واجمان إل دي، كامفاوسن كيه إيه، هوسكينز (نسخة): إدارة مرض السرطان: أسلوب مُتعدد التخصصات. النسخة ال11، 2008. Archived 2013-10-05 at the Wayback Machine
- ^ آر. تي سكيل (2003). كتيب حول العلاج الكيميائي للسرطان، لپنكوت وليامز وولكنز.
- ^ تشابنر ولونگو (2006). العلاج الكيميائي والبيولوجي: المبادئ والتطبيق. فيلادلفيا، لپنكوت وليامز وولكنز.
- ^ , http://www.cancer.org/docroot/ETO/content/ETO_5_3X_Coriolous_Versicolor.asp
- ^ Davila ML (Jan 2006). "Neutropenic enterocolitis". Current Opinion in Gastroenterology. 22 (1): 44–7. PMID 16319675.
- ^ أ ب Keidan RD, Fanning J, Gatenby RA, Weese JL (Mar 1989). "Recurrent typhlitis. A disease resulting from aggressive chemotherapy". Diseases of the Colon and Rectum. 32 (3): 206–9. doi:10.1007/BF02554529. PMID 2920627.
- ^ Gibson RJ, Keefe DM (Sep 2006). "Cancer chemotherapy-induced diarrhoea and constipation: mechanisms of damage and prevention strategies". Supportive Care in Cancer. 14 (9): 890–900. doi:10.1007/s00520-006-0040-y. PMID 16604351.
- ^ Groopman JE, Itri LM (Oct 1999). "Chemotherapy-induced anemia in adults: incidence and treatment". Journal of the National Cancer Institute. 91 (19): 1616–34. doi:10.1093/jnci/91.19.1616. PMID 10511589.
- ^ Henry DH (Jul 2006). "The role of intravenous iron in cancer-related anemia". Oncology. 20 (8 Suppl 6): 21–4. PMID 16925107.
- ^ Rodgers GM, Becker PS, Bennett CL, Cella D, Chanan-Khan A, Chesney C, Cleeland C, Coccia PF, Djulbegovic B, Garst JL, Gilreath JA, Kraut EH, Lin WC, Matulonis U, Millenson M, Reinke D, Rosenthal J, Sabbatini P, Schwartz RN, Stein RS, Vij R (Jul 2008). "Cancer- and chemotherapy-induced anemia". Journal of the National Comprehensive Cancer Network. 6 (6): 536–64. PMID 18597709.
- ^ Vadhan-Raj S (Jan 2009). "Management of chemotherapy-induced thrombocytopenia: current status of thrombopoietic agents". Seminars in Hematology. 46 (1 Suppl 2): S26–32. doi:10.1053/j.seminhematol.2008.12.007. PMID 19245931.
- ^ Sekhon SS, Roy V (May 2006). "Thrombocytopenia in adults: A practical approach to evaluation and management". Southern Medical Journal. 99 (5): 491–8, quiz 499–500, 533. doi:10.1097/01.smj.0000209275.75045.d4. PMID 16711312.
- ^ Berger AM, Abernethy AP, Atkinson A, Barsevick AM, Breitbart WS, Cella D, Cimprich B, Cleeland C, Eisenberger MA, Escalante CP, Jacobsen PB, Kaldor P, Ligibel JA, Murphy BA, O'Connor T, Pirl WF, Rodler E, Rugo HS, Thomas J, Wagner LI (Aug 2010). "Cancer-related fatigue". Journal of the National Comprehensive Cancer Network. 8 (8): 904–31. PMID 20870636.
- ^ Franklin DJ, Packel L (Mar 2006). "Cancer-related fatigue". Archives of Physical Medicine and Rehabilitation. 87 (3 Suppl 1): S91–3, quiz S94–5. doi:10.1016/j.apmr.2005.12.015. PMID 16500197.
- ^ Cramp F, Byron-Daniel J (2012). Cramp, Fiona (ed.). "Exercise for the management of cancer-related fatigue in adults". The Cochrane Database of Systematic Reviews. 11: CD006145. doi:10.1002/14651858.CD006145.pub3. PMID 23152233.
- ^ Gralla R, de Wit R, Herrstedt J, Carides A, Ianus J, Guoguang-Ma J, Evans J, Horgan K (2005). "Antiemetic efficacy of the neurokinin-1 antagonist, aprepitant, plus a 5HT3 antagonist and a corticosteroid in patients receiving anthracyclines or cyclophosphamide in addition to high-dose cisplatin: analysis of combined data from two Phase III randomized clinical trials". Cancer. 104 (4): 864–8. doi:10.1002/cncr.21222+. PMID 15973669.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ تريمر، كارول، كامبل، رينولدز، مور، ماكويري. السيطرة على الغثيان والقيء الناتج عن العلاج الكيميائي: مراجعة منهجية كمية. المجلة الطبية البريطانية عام 2001؛ 323:16-21. بميد 11440936.
- ^ "أسئلة وأجوبة -- الماريجوانا الطبية" Archived 2008-05-22 at the Wayback Machine
- ^ Chadha V, Shenoi SD (2003). "Hair loss in cancer chemotherapeutic patients". Indian Journal of Dermatology, Venereology and Leprology. 69 (2): 131–132. PMID 17642856.
- ^ Lemieux J (Oct 2012). "Reducing chemotherapy-induced alopecia with scalp cooling". Clinical Advances in Hematology & Oncology. 10 (10): 681–682. PMID 23187775.
- ^ Shapiro J, Price VH (Apr 1998). "Hair regrowth. Therapeutic agents". Dermatologic Clinics. 16 (2): 341–356. doi:10.1016/S0733-8635(05)70017-6. PMID 9589208.
- ^ Al-Mohanna H, Al-Khenaizan S (2010). "Permanent alopecia following cranial irradiation in a child". Journal of Cutaneous Medicine and Surgery. 14 (3): 141–143. doi:10.2310/7750.2010.09014. PMID 20487675.
- ^ Can G, Demir M, Erol O, Aydiner A (Jun 2013). "A comparison of men and women's experiences of chemotherapy-induced alopecia". European Journal of Oncology Nursing. 17 (3): 255–60. doi:10.1016/j.ejon.2012.06.003. PMID 22901547.
- ^ Trüeb RM (Mar 2009). "Chemotherapy-induced alopecia". Seminars in Cutaneous Medicine and Surgery. 28 (1): 11–4. doi:10.1016/j.sder.2008.12.001. PMID 19341937.
- ^ Chon SY, Champion RW, Geddes ER, Rashid RM (Jul 2012). "Chemotherapy-induced alopecia". Journal of the American Academy of Dermatology. 67 (1): e37–47. doi:10.1016/j.jaad.2011.02.026. PMID 22178150.
- ^ روثر، ونونينسيك، وشمول: الأورام الثانوية التي تتكون بعد العلاج الكيميائي والإشعاعي ، والمناعة : مساهمات في علم الأورام (Beiträge zur Onkologie)، المجلد 55، 2000، ردمك 380557116X
- ^ هيجيا، هدسون، لينسنغ وآخرون. حالات تراكمية للأورام الثانوية كحدث أول بعد اللوكيميا الليمفوية الحادة عند الأطفال، جاما، 2007؛ 297:1207-1215.
- ^ أ ب ت ث Brydøy M, Fosså SD, Dahl O, Bjøro T (2007). "Gonadal dysfunction and fertility problems in cancer survivors". Acta Oncologica. 46 (4): 480–9. doi:10.1080/02841860601166958. PMID 17497315.
- ^ أ ب Morgan S, Anderson RA, Gourley C, Wallace WH, Spears N (2012). "How do chemotherapeutic agents damage the ovary?". Human Reproduction Update. 18 (5): 525–35. doi:10.1093/humupd/dms022. PMID 22647504.
- ^ Gurgan T, Salman C, Demirol A (Oct 2008). "Pregnancy and assisted reproduction techniques in men and women after cancer treatment". Placenta. 29 Suppl B: 152–9. doi:10.1016/j.placenta.2008.07.007. PMID 18790328.
- ^ Courbiere B, Decanter C, Bringer-Deutsch S, Rives N, Mirallié S, Pech JC, De Ziegler D, Carré-Pigeon F, May-Panloup P, Sifer C, Amice V, Schweitzer T, Porcu-Buisson G, Poirot C (Sep 2013). "Emergency IVF for embryo freezing to preserve female fertility: a French multicentre cohort study". Human Reproduction. 28 (9): 2381–8. doi:10.1093/humrep/det268. PMID 23832792.
- ^ Roness H, Kalich-Philosoph L, Meirow D (2014). "Prevention of chemotherapy-induced ovarian damage: possible roles for hormonal and non-hormonal attenuating agents". Human Reproduction Update. 20 (5): 759–774. doi:10.1093/humupd/dmu019. PMID 24833728.
- ^ Tichelli A, Rovó A (Aug 2013). "Fertility issues following hematopoietic stem cell transplantation". Expert Review of Hematology. 6 (4): 375–388. doi:10.1586/17474086.2013.816507. PMID 23991924.
In turn citing: Sanders JE, Hawley J, Levy W, Gooley T, Buckner CD, Deeg HJ, Doney K, Storb R, Sullivan K, Witherspoon R, Appelbaum FR (Apr 1996). "Pregnancies following high-dose cyclophosphamide with or without high-dose busulfan or total-body irradiation and bone marrow transplantation". Blood. 87 (7): 3045–3052. PMID 8639928. - ^ أ ب ت ث ج ح Arnon J, Meirow D, Lewis-Roness H, Ornoy A (2001). "Genetic and teratogenic effects of cancer treatments on gametes and embryos". Human Reproduction Update. 7 (4): 394–403. doi:10.1093/humupd/7.4.394. PMID 11476352. [1]
- ^ أ ب del Pino BM. Chemotherapy-induced Peripheral Neuropathy. NCI Cancer Bulletin. Feb 23, 2010;7(4):6.
- ^ Grisold W, Oberndorfer S, Windebank AJ. Chemotherapy and polyneuropathies. European Association of Neurooncology Magazine. 2012;12(1).
- ^ Beijers AJM, Jongen, JLM & Vreugdenhil1 G. [2]. The Netherlands journal of medicine. January 2012 [archived 3 December 2013];70(1). PMID 22271810.
- ^ أ ب Windebank AJ & Grisold W. Chemotherapy-induced neuropathy. Journal of the Peripheral Nervous System. 2008 Mar;13(1):27–46. doi:10.1111/j.1529-8027.2008.00156.x. PMID 18346229.
- ^ Savage L. Chemotherapy-induced pain puzzles scientists. Journal of the National Cancer Institute. 2007;99(14):1070–1071. doi:10.1093/jnci/djm072. PMID 17623791.
- ^ أ ب Tannock IF, Ahles TA, Ganz PA, Van Dam FS (Jun 2004). "Cognitive impairment associated with chemotherapy for cancer: report of a workshop". Journal of Clinical Oncology. 22 (11): 2233–9. doi:10.1200/JCO.2004.08.094. PMID 15169812. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "pmid15169812" معرف أكثر من مرة بمحتويات مختلفة. - ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةWood2005 - ^ Shaikh AY, Shih JA (Jun 2012). "Chemotherapy-induced cardiotoxicity". Current Heart Failure Reports. 9 (2): 117–27. doi:10.1007/s11897-012-0083-y. PMID 22382639.
- ^ Thatishetty AV, Agresti N, O'Brien CB (Nov 2013). "Chemotherapy-induced hepatotoxicity". Clinics in Liver Disease. 17 (4): 671–86, ix–x. doi:10.1016/j.cld.2013.07.010. PMID 24099024.
- ^ King PD, Perry MC (2001). "Hepatotoxicity of chemotherapy". The Oncologist. 6 (2): 162–76. doi:10.1634/theoncologist.6-2-162. PMID 11306728.
- ^ de Jonge MJ, Verweij J (Feb 2006). "Renal toxicities of chemotherapy". Seminars in Oncology. 33 (1): 68–73. doi:10.1053/j.seminoncol.2005.11.011. PMID 16473645.
- ^ Humphreys BD, Soiffer RJ, Magee CC (Jan 2005). "Renal failure associated with cancer and its treatment: an update". Journal of the American Society of Nephrology. 16 (1): 151–61. doi:10.1681/ASN.2004100843. PMID 15574506.
- ^ Brock PR, Knight KR, Freyer DR, Campbell KC, Steyger PS, Blakley BW, Rassekh SR, Chang KW, Fligor BJ, Rajput K, Sullivan M, Neuwelt EA (Jul 2012). "Platinum-induced ototoxicity in children: a consensus review on mechanisms, predisposition, and protection, including a new International Society of Pediatric Oncology Boston ototoxicity scale". Journal of Clinical Oncology. 30 (19): 2408–17. doi:10.1200/JCO.2011.39.1110. PMC 3675696. PMID 22547603.
- ^ Rybak LP, Mukherjea D, Jajoo S, Ramkumar V (Nov 2009). "Cisplatin ototoxicity and protection: clinical and experimental studies". The Tohoku Journal of Experimental Medicine. 219 (3): 177–86. doi:10.1620/tjem.219.177. PMC 2927105. PMID 19851045.
- ^ Weeks JC, Catalano PJ, Cronin A, Finkelman MD, Mack JW, Keating NL, Schrag D (Oct 2012). "Patients' expectations about effects of chemotherapy for advanced cancer". The New England Journal of Medicine. 367 (17): 1616–25. doi:10.1056/NEJMoa1204410. PMC 3613151. PMID 23094723.
- ^ Deeken JF, Löscher W (Mar 2007). "The blood-brain barrier and cancer: transporters, treatment, and Trojan horses". Clinical Cancer Research. 13 (6): 1663–74. doi:10.1158/1078-0432.CCR-06-2854. PMID 17363519.
- ^ Agarwala SS, Kirkwood JM (2000). "Temozolomide, a novel alkylating agent with activity in the central nervous system, may improv
e the treatment of advanced metastatic melanoma". The Oncologist. 5 (2): 144–51. doi:10.1634/theoncologist.5-2-144. PMID 10794805.
{{cite journal}}: line feed character in|title=at position 95 (help) - ^ Gerstner ER, Fine RL (Jun 2007). "Increased permeability of the blood-brain barrier to chemotherapy in metastatic brain tumors: establishing a treatment paradigm". Journal of Clinical Oncology. 25 (16): 2306–12. doi:10.1200/JCO.2006.10.0677. PMID 17538177.
- ^ Minchinton AI, Tannock IF (Aug 2006). "Drug penetration in solid tumours". Nature Reviews. Cancer. 6 (8): 583–92. doi:10.1038/nrc1893. PMID 16862189.
- ^ Goldman B (Feb 2003). "Multidrug resistance: can new drugs help chemotherapy score against cancer?". Journal of the National Cancer Institute. 95 (4): 255–7. doi:10.1093/jnci/95.4.255. PMID 12591977.
- ^ E. Crowley; CA. McDevitt; R. Callaghan (2009). Multidrug Resistance in Cancer. Generating Inhibitors of P-Glycoprotein: Where to, Now?. Springer Protocols. pp. 405–432.
{{cite book}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Luqmani YA (2005). "Mechanisms of drug resistance in cancer chemotherapy". Medical Principles and Practice. 14 Suppl 1: 35–48. doi:10.1159/000086183. PMID 16103712.
- ^ Moschovi, Maria (2015). "Drugs acting on homeostasis: challenging cancer cell adaptation". Expert Rev Anticancer Ther. 15 (12): 1405–17. doi:10.1586/14737140.2015.1095095. PMID 26523494.
- ^ Gerber DE (Feb 2008). "Targeted therapies: a new generation of cancer treatments". American Family Physician. 77 (3): 311–9. PMID 18297955.
- ^ Allen TM (Oct 2002). "Ligand-targeted therapeutics in anticancer therapy". Nature Reviews. Cancer. 2 (10): 750–63. doi:10.1038/nrc903. PMID 12360278.
- ^ Chen HX, Cleck JN (Aug 2009). "Adverse effects of anticancer agents that target the VEGF pathway". Nature Reviews. Clinical Oncology. 6 (8): 465–77. doi:10.1038/nrclinonc.2009.94. PMID 19581909.
- ^ Zhang J, Yang PL, Gray NS (Jan 2009). "Targeting cancer with small molecule kinase inhibitors". Nature Reviews. Cancer. 9 (1): 28–39. doi:10.1038/nrc2559. PMID 19104514.
- ^ أ ب Ben-Ari ET (Apr 2004). "Dual purpose: some cancer therapies used to treat autoimmune diseases" (PDF). Journal of the National Cancer Institute. 96 (8): 577–9. doi:10.1093/jnci/96.8.577. PMID 15100330.
- ^ أ ب Cutolo M, Sulli A, Pizzorni C, Seriolo B, Straub RH (Aug 2001). "Anti-inflammatory mechanisms of methotrexate in rheumatoid arthritis". Annals of the Rheumatic Diseases. 60 (8): 729–35. doi:10.1136/ard.60.8.729. PMC 1753808. PMID 11454634.
- ^ Montaudié H, Sbidian E, Paul C, Maza A, Gallini A, Aractingi S, Aubin F, Bachelez H, Cribier B, Joly P, Jullien D, Le Maître M, Misery L, Richard MA, Ortonne JP (May 2011). "Methotrexate in psoriasis: a systematic review of treatment modalities, incidence, risk factors and monitoring of liver toxicity". Journal of the European Academy of Dermatology and Venereology. 25 Suppl 2: 12–8. doi:10.1111/j.1468-3083.2011.03991.x. PMID 21388454.
- ^ أ ب Chen J, Veras MM, Liu C, Lin J (2013). Chen, Junmin (ed.). "Methotrexate for ankylosing spondylitis". The Cochrane Database of Systematic Reviews. 2: CD004524. doi:10.1002/14651858.CD004524.pub4. PMID 23450553.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ أ ب Gray O, McDonnell GV, Forbes RB (2004). Gray, Orla (ed.). "Methotrexate for multiple sclerosis". The Cochrane Database of Systematic Reviews (2): CD003208. doi:10.1002/14651858.CD003208.pub2. PMID 15106195.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ أ ب Gray OM, McDonnell GV, Forbes RB (Aug 2006). "A systematic review of oral methotrexate for multiple sclerosis". Multiple Sclerosis. 12 (4): 507–10. doi:10.1191/1352458506ms1299oa. PMID 16900766.
- ^ Ntali S, Bertsias G, Boumpas DT (Jun 2011). "Cyclophosphamide and lupus nephritis: when, how, for how long?". Clinical Reviews in Allergy & Immunology. 40 (3): 181–91. doi:10.1007/s12016-009-8196-0. PMID 20107927.
- ^ "NCCN Guidelines: Systemic Light Chain Amyloidosis" (PDF). National Comprehensive Cancer Network.
- ^ Bacigalupo A, Ballen K, Rizzo D, Giralt S, Lazarus H, Ho V, Apperley J, Slavin S, Pasquini M, Sandmaier BM, Barrett J, Blaise D, Lowski R, Horowitz M (Dec 2009). "Defining the intensity of conditioning regimens: working definitions". Biology of Blood and Marrow Transplantation. 15 (12): 1628–33. doi:10.1016/j.bbmt.2009.07.004. PMC 2861656. PMID 19896087.
- ^ "NIOSH Occupational Exposure to Antineoplastic Agents". United States National Institute for Occupational Safety and Health. Retrieved 10 October 2007.
- ^ أ ب Connor, Thomas H. (March 7, 2011). "Hazardous Drugs in Healthcare". NIOSH: Workplace Safety and Health. Medscape & NIOSH.
- ^ Hirsch J (2006). "An anniversary for cancer chemotherapy". JAMA. 296 (12): 1518–20. doi:10.1001/jama.296.12.1518. PMID 17003400.
{{cite journal}}: Unknown parameter|month=ignored (help) - ^ Goodman LS, Wintrobe MM, Dameshek W, Goodman MJ, Gilman A,
McLennan MT. (1946). "Nitrogen mustard therapy". JAMA. 132: 26–32.
{{cite journal}}: line feed character in|author=at position 59 (help)CS1 maint: multiple names: authors list (link) - ^ Goodman LS, Wintrobe MM, Dameshek W, Goodman MJ, Gilman A, McLennan MT. (1984). "Landmark article Sept. 21, 1946: Nitrogen mustard therapy. Use of methyl-bis(beta-chloroethyl)amine hydrochloride and tris(beta-chloroethyl)amine hydrochloride for Hodgkin's disease, lymphosarcoma, leukemia and certain allied and miscellaneous disorders. By Louis S. Goodman, Maxwell M. Wintrobe, William Dameshek, Morton J. Goodman, Alfred Gilman and Margaret T. McLennan". JAMA. 251 (17): 2255–61. PMID 6368885.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Joensuu H. (2008). "Systemic chemotherapy for cancer: from weapon to treatment". Lancet Oncol. 9 (3): 304. doi:10.1016/S1470-2045(08)70075-5. PMID 18308256.
- ^ Top 10 best-selling cancer drugs of 2013; May 29, 2014
- ^ أ ب Chidambaram M, Manavalan R, Kathiresan K (2011). "Nanotherapeutics to overcome conventional cancer chemotherapy limitations". Journal of Pharmacy & Pharmaceutical Sciences. 14 (1): 67–77. doi:10.18433/J30C7D. PMID 21501554.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ أ ب Teicher BA, Chari RV (Oct 2011). "Antibody conjugate therapeutics: challenges and potential". Clinical Cancer Research. 17 (20): 6389–97. doi:10.1158/1078-0432.CCR-11-1417. PMID 22003066.
- ^ Sievers EL, Linenberger M (Nov 2001). "Mylotarg: antibody-targeted chemotherapy comes of age". Current Opinion in Oncology. 13 (6): 522–7. doi:10.1097/00001622-200111000-00016. PMID 11673694.
- ^ FDA. "Mylotarg (gemtuzumab ozogamicin): Market Withdrawal". Retrieved 18 August 2013.
- ^ Vines T, Faunce T (May 2009). "Assessing the safety and cost-effectiveness of early nanodrugs". Journal of Law and Medicine. 16 (5): 822–45. PMID 19554862.
- ^ Heller R, Gilbert R, Jaroszeski MJ (Jan 1999). "Clinical applications of electrochemotherapy". Advanced Drug Delivery Reviews. 35 (1): 119–129. doi:10.1016/S0169-409X(98)00067-2. PMID 10837693.
- ^ Larkin JO, Collins CG, Aarons S, Tangney M, Whelan M, O'Reily S, Breathnach O, Soden DM, O'Sullivan GC (Mar 2007). "Electrochemotherapy: aspects of preclinical development and early clinical experience". Annals of Surgery. 245 (3): 469–479. doi:10.1097/01.sla.0000250419.36053.33. PMC 1877027. PMID 17435555.
- ^ أ ب Marty M, Sersa G, Garbay JR, Gehl J, Collins CG, Snoj M, Billard V, Geertsen PF, Larkin JO, Miklavcic D, Pavlovic I, Paulin-Kosir SM, Cemazar M, Morsli N, Soden DM, Rudolf Z, Robert C, O'Sullivan GC, Mir LM (2006). "Electrochemotherapy – An easy, highly effective and safe treatment of cutaneous and subcutaneous metastases". Eur J Cancer Suppl. 4 (11): 3–13. doi:10.1016/j.ejcsup.2006.08.002.
- ^ Möller MG, Salwa S, Soden DM, O'Sullivan GC (Nov 2009). "Electrochemotherapy as an adjunct or alternative to other treatments for unresectable or in-transit melanoma". Expert Review of Anticancer Therapy. 9 (11): 1611–1630. doi:10.1586/era.09.129. PMID 19895245.
- ^ Testori A, Tosti G, Martinoli C, Spadola G, Cataldo F, Verrecchia F, Baldini F, Mosconi M, Soteldo J, Tedeschi I, Passoni C, Pari C, Di Pietro A, Ferrucci PF (2010). "Electrochemotherapy for cutaneous and subcutaneous tumor lesions: a novel therapeutic approach". Dermatologic Therapy. 23 (6): 651–661. doi:10.1111/j.1529-8019.2010.01370.x. PMID 21054709.
- ^ Hampton T (Feb 2011). "Electric pulses help with chemotherapy, may open new paths for other agents". JAMA. 305 (6): 549–551. doi:10.1001/jama.2011.92. PMID 21304073.
- ^ Mir LM, Gehl J, Sersa G, Collins CG, Garbay JR, Billard V, Geertsen PF, Rudolf Z, O'Sullivan GC, Marty M (2006). "Standard operating procedures of the electrochemotherapy: Instructions for the use of bleomycin or cisplatin administered either systemically or locally and electric pulses delivered by the Cliniporator™ by means of invasive or non-invasive electrodes". Eur J Cancer Suppl. 4 (11): 14–25. doi:10.1016/j.ejcsup.2006.08.003.
- ^ Soden DM, Larkin JO, Collins CG, Tangney M, Aarons S, Piggott J, Morrissey A, Dunne C, O'Sullivan GC (Feb 2006). "Successful application of targeted electrochemotherapy using novel flexible electrodes and low dose bleomycin to solid tumours". Cancer Letters. 232 (2): 300–310. doi:10.1016/j.canlet.2005.03.057. PMID 15964138.
- ^ Miklavcic D, Snoj M, Zupanic A, Kos B, Cemazar M, Kropivnik M, Bracko M, Pecnik T, Gadzijev E, Sersa G (2010). "Towards treatment planning and treatment of deep-seated solid tumors by electrochemotherapy". BioMedical Engineering OnLine. 9 (1): 10. doi:10.1186/1475-925X-9-10. PMC 2843684. PMID 20178589.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Issels, R. (1999). "Hyperthermia Combined with Chemotherapy – Biological Rationale, Clinical Application, and Treatment Results". Onkologie. 22 (5): 374–381. doi:10.1159/000026986.
- ^ McKnight JA (May 2003). "Principles of chemotherapy". Clinical Techniques in Small Animal Practice. 18 (2): 67–72. doi:10.1053/svms.2003.36617. PMID 12831063.
وصلات خارجية
![]() تعريفات قاموسية في ويكاموس
تعريفات قاموسية في ويكاموس
![]() كتب من معرفة الكتب
كتب من معرفة الكتب
![]() اقتباسات من معرفة الاقتباس
اقتباسات من معرفة الاقتباس
![]() نصوص مصدرية من معرفة المصادر
نصوص مصدرية من معرفة المصادر
![]() صور و ملفات صوتية من كومونز
صور و ملفات صوتية من كومونز
![]() أخبار من معرفة الأخبار.
أخبار من معرفة الأخبار.
- Chemotherapy, American Cancer Society
- CS1 errors: unsupported parameter
- CS1 errors: invisible characters
- CS1 maint: unflagged free DOI
- Articles with hatnote templates targeting a nonexistent page
- Articles with unsourced statements from August 2013
- Articles with unsourced statements from November 2015
- علاج كيميائي
- أدوية مضادة للأورام
- علاجات السرطان
- علم الأورام