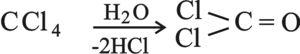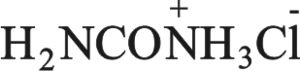تكافؤ رباعي
في الكيمياء، يقال رباعي التكافؤ tetravalence، لذرة في جزيء عندما يكون بها 4 إلكترونات في غلاف طاقتها الأخير متاحة لتكوين روابط كيميائية. ومثال لذلك الميثان، فذرة الكربون رباعية التكافؤ، وترتبط بأربعة ذرات هيدروجين.
ويطلق مصطلح الوظائف الرباعية التكافؤ على الوظائف العضوية التي يمكن عدّها مشتقة من الميثان. قد يرتبط الميثان بجذر X) X هو ذرة غير متجانسة أحادية التكافؤ)، وقد يرتبط بجذر Y) Y ذرة ثنائية التكافؤ أو ثلاثية التكافؤ)، [1]وعلى هذا يمكن تقسيم هذه المركبات إلى أربعة أصناف:
CX4 X2C=Y Y=C=Y X−C≡N
المركبات رباعية التكافؤ
The valence is the combining capacity of an atom of a given element, determined by the number of hydrogen atoms that it combines with. In methane, carbon has a valence of 4; in ammonia, nitrogen has a valence of 3; in water, oxygen has a valence of 2; and in hydrogen chloride, chlorine has a valence of 1. Chlorine, as it has a valence of one, can be substituted for hydrogen in many compounds. Phosphorus has a valence 3 in phosphine (PH
3) and a valence of 5 in phosphorus pentachloride (PCl
5), which shows that an element may exhibit more than one valence. The structural formula of a compound represents the connectivity of the atoms, with lines drawn between two atoms to represent bonds.[2] The two tables below show examples of different compounds, their structural formulas, and the valences for each element of the compound.
| Compound | H 2 Hydrogen |
CH 4 Methane |
C 3H 8 Propane |
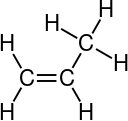
C 3H 6 Propylene |
C 2H 2 Acetylene |
|---|---|---|---|---|---|
| Diagram | 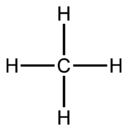
|

|
|
||
| Valencies |
|
|
|
|
|
| Compound | NH 3 Ammonia |
NaCN Sodium cyanide |
PSCl 3 Thiophosphoryl chloride |
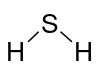
H 2S Hydrogen sulfide |
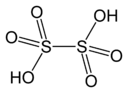
H 2SO 4 Sulfuric acid |
H 2S 2O 6 Dithionic acid |
Cl 2O 7 Dichlorine heptoxide |
XeO 4 Xenon tetroxide |
|---|---|---|---|---|---|---|---|---|
| Diagram | 
|

|
|

|
|

|

| |
| Valencies |
|
|
|
|
|
|
|
|
عدد هذه المركبات كبير، ويوجز فيما يأتي أهمها:
ضروب رباعي هاليد الألكيل
رباعي هاليد الألكيل: CI4 , CBr4 , CCl4 , CF4 وأكثرها أهمية هو رباعي كلوريد الكربون. ويمكن الحصول عليه بمعالجة كبريت الكربون بـ S2Cl2:
رباعي كلوريد الكربون سائل لا لون له، غير قابل للاشتعال وله رائحة مقبولة وهو مسَرْطن. يستخدم على نطاق واسع مُحِلاً (مُذيباً) في الصناعة وفي أجهزة إطفاء الحريق. وعند استخدامه لهذا الغرض في أمكنة مغلقة يجب توخي الحذر الشديد،لأنه بوجود الماء فوق الدرجة 500 ْس يعطي غاز الفوسجين الشديد السمية.
وتؤدي معالجته بغاز الكبريت إلى تشكل الفوسجين أيضاً.
إسترات أورتو حمض الكربون
إسترات أورتو حمض الكربون: C(OR)4 orthocarbonic acid
يمكن الحصول عليها بمعالجة كلوروبيكرين (نتروكلورفورم)
وهذه المركبات سوائل لا لون لها وذات روائح لطيفة، وهي تتحلمه (تتحلَّل مائياً) بسهولة بالماء:
حيث -RO ألكوكسيد.
تتفاعل إسترات أورتو حمض الكربون مع الألدهيدات معطية الأستالات acetals ومع الكيتونات معطية الكيتالات ketals وكربونات ثنائية الألكيل (الإستر الثنائي لحمض الكربون).
حيث ´R ألكيل أو بروتون (H).
الكلوربكرين
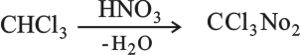
الكلوروبكرين (نتروكلوروفورم) CCl3NO2 chloropicrin
يمكن الحصول عليه بتفاعل الكلورفورم مع حمض الآزوت، وهو سام وله تأثير مبيد للحشرات:
وهو مركب غير قابل للاشتعال، ينحل في الكحول والبنزن والإيتر وقليل الانحلال بالماء.
الفوسجين
الفوسجين (كلوريد الكربونيل) COCl2 phosgene
ويحضر بتفاعل أحادي أكسيد الكربون مع الكلور بوجود الضوء ( ديفي 1812). ويتم هذا التفاعل في الصناعة عند درجة حرارة تراوح بين 100ـ200 س بوجود الكربون الفعال حفّازاً (وسيطاً).
أما مخبرياً فيحضر بتفاعل رباعي كلوريد الكربون بالأوليوم:
والفوسجين غاز لا لون له ( د.غ 8.2 ْس) وله رائحة خانقة. وهو مركب سام جداً وتأثيره خانق يخدش الرئتين مؤدياً إلى الموت. وقد استخدم مادة سامة في الحرب العالمية الأولى.
وبغض النظر عن خاصيته السمية فهو يستخدم في الصناعة، وفي اصطناع الكثير من المركبات العضوية. فيستخدم مثلاً في تفاعل فريدل ـ كرافتس مثل كلوريد الأسيتيل، وفي الحصول على إسترات كلورو حمض النمل ClCOOR.
وكذلك إسترات حمض الكربون CO(OR)2
وتعود أهمية الفوسجين الصناعية إلى استخدامه في الحصول على بولي كربونات التي تستخدم في الحصول على البولي يوريتانات وهو الإسفنج الصناعي عبر مرحلة دي إيزوسيانات.
مشتقات حمض الكرباميك
لم يعرف حمض الكرباميك H2NCOOH في الحالة الحرة حتى اليوم. وكذلك فإن منتجات استبداله عند N التي تتكون على هيئة مركبات ثانوية (في بعض إعادات الترتيب عند ذرة الآزوت) تفقد كربوكسيلها. أما أملاح حمض الكرباميك (الكربامات) فهي ثابتة، إذ يمكن اصطناع كربامات الأمونيوم بتفاعل الأمونيا مع CO2. تتحلمه كربامات الأمونيوم عند درجات عالية من الحرارة إلى كربونات الأمونيوم.
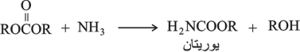
اليوريتان
اليوريتان H2NCOOR urethanes، هي إسترات حمض الكرباميك، ويمكن اصطناعها من إسترات كلوروحمض النمل، أو بمعالجة إسترات حمض الكربون بالنشادر (الأمونيا).
تعطي تفاعلات ضروب اليوريتان بالأمونيا البولةََ:
ويستخدم بعض اليوريتانات مواد دوائية ( الكرباريل C6H7OOCNHCH3 carbaryl والميبروبامات) كما تستخدم مبيدات حشرية ( الكرباميل).
اليوريا
البولة أو اليوريا O=C(NH2)2، وتدعى أيضاً بالكرباميد، وهي من أهم منتجا ت استقلاب المواد الغذائية الحاوية الآزوت في الثديات. وقد عزلها الكيميائي الفرنسي رويل Hilaire - Martin Rouelle أول مرة عام 1772 من بول الإنسان.
والبولة أول مركب عضوي اصطنع من مواد لا عضوية. ففي عام 1928 بخر الكيميائي الألماني فوهلر Wohler محلولاً مائياً لسيانات البوتاسيوم وكبريتات الأمونيوم فحصل على سيانات الأمونيوم التي تماكبت معطية البولة.
وبقي لهذا التفاعل في الوقت الحاضر أهمية تاريخية فقط.
أما في الصناعة فتحضر البولة بالحلمهة الجزئية لسيان أميد، أو بتسخين كربامات الأمونيوم (الناتجة من معالجة CO2 بالأمونيا) عند درجة حرارة 120ـ150 ْس وتحت ضغط 25ـ40كغ/سم2، حيث تخضع لنزع مائها كلياً.
ويمكن الحصول على مشتقات البولة المستبدلة عند N إما بتفاعل الأمينات الأولية وإما الثانوية مع الفوسجين:
تتبلورالبولة على هيئة بلورات موشورية بيضاء تنصهر عند الدرجة 132.7 ْس وهي جيدة الذوبان في الماء والإيتانول. والبولة أساس أحادي الوظيفة وتكوّن أملاحاً مع بعض الحموض، فعلى سبيل المثال: مع حمض كلور الماء HCl تكوِّن:
إن أكسالات البولة ونتراتها رديئتا الذوبان في الماء. يؤدي تسخين البولة بوجود الحموض أو الأسس إلى حلمهتها إلى كربونات الأمونيوم، ويجري هذا التفاعل إنزيميا (بوجود إنزيم أورياز) في الشروط الفزيولوجية العادية.
عند تسخين البولة ببطء حتى الدرجة 150 ْـ160 ْس تفقد النشا در معطية البيوريت (ينصهر عند الدرجة 193 ْس).
يعطي البيوريت مع أيونات Cu في محاليل قلوية معقداً بنفسجياً (تفاعل البيوريت) يستخدم في الكشف الكيفي عن البولة.
إذا عولجت البولة بحمض الآزوتي يتكوَّن الآزوتُ إلى جانب الماء وثنائي أكسيد الكربون. يفيد قياس الآزوت المنطلق في تعيين مقدار البولة كمياً.
ويؤدي تفاعل البولة مع تحت الحموض الهالوجينية ( هيبوبروميت الصوديوم، على سبيل المثال) إلى تشكل الآزوت:
السيان أميد
السيان أميد NH2-C≡N
يمكن عدّه نتريلاً لحمض الكرباميك أو أميداً لحمض سيان الماء HCN أو بلا ماء البولة 0 ويمكن تحضيره إما بتفاعل البولة مع كلوريد التيونيل
وإما انطلاقاً من سيان أميد الكلسيوم الذي يحضر بدوره بتفاعل كربيد الكلسيوم مع الآ زوت عندالدرجة 1000ـ1100س.
يستخدم المزيج المتكون من سيا ن أميد الكلسيوم وهباب الفحم مباشرة سماداً.
يتحول سيان أميد بسهولة إلى البولة أو تيو البولة S=C(NH2)2 أو الغوانيدين بمعالجته بحمض الكبريت الممدد أو H2S أو NH3، على الترتيب.
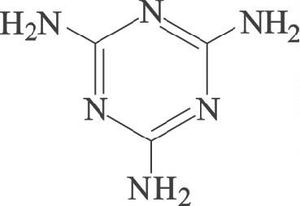
ويتبلمر سيان أميد عند درجا ت حرارة أعلى من درجة انصهاره متحولاً إلى ثنائي سيان أميد الذي يتحول مع استمرار التسخين إلى الميلامين (الفورمايكا).
الگوانيدين
الگوانيدين HN=C(NH2)2 guanidine، ويعد نظريا إيميدين حمض الكرباميك. ويحضر بتسخين سيان أميد مع كلوريد الأ مونيوم:
تنصهر بلورات الگوانيدين عند الدرجة 50 ْس. وهو يسلك سلوك أساس قوي أحادي الوظيفة. ويعزى ذلك إلى استقراره الطنيني، وهو يدخل في بنى بعض الأدوية. وهو يذوب في الماء والكحول.
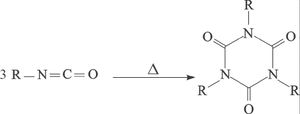
المشتقات الإيزوسيانية
المشتقات الإيزوسيانية R-N=C=O. يمكن الحصول عليها بتفاعل حمض الإيزوسيانيك isocyanic acid (أو حمض السيان) HNCO بهاليدات الألكيل أو كبريتات الألكيل.
تحضر الإيزوسيانات في الصناعة بتفاعل الأمينات الأولية مع الفوسجين ويتشكل المركب الوسطي كلوريد الكرباميد المستبدل عند N:
إيزوسيانات مواد سائلة ذات روائح حادة، وهي تتحول عند درجات الحرارة المرتفعة إلى تريميرات (بولميرات ثلاثية الحد) هي: 5,3,1 ـ ثلاثي ألكيل ـ5،3،1 ـ تري آزين تريون ـ6،4،2.
تستخدم إيزوسيانات في اصطناع ضروب اليوريتان المستبدلة عند N، ومشتقات البولة المستبدلة عند N. وفي الصناعة يمكن الحصول من ثنائي إيزوسيانات O=C=N(CH2)2N=C=O والديولات (الكحولات ثنائية الهدروكسيل) على بولميرات مهمة هي البولي يوريتانات.
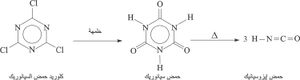
كلوريد السيانوجين
كلوريد السيانوجين Cl-C≡N، يمكن عدّه كما لو كان بلاماء كلوريد الكرباميد أوكلوريد حمض سيان الماء HCN. يمكن الحصول عليه بسهولة بمعالجة سيانيد الصوديوم بالكلور:
وكلوريد السيانوجين غازسام ومسيل للدموع (يغلي عند الدرجة 12.6 ْس) وهو يتماثر بسهولة متحولا إلى 6,4,2 ـ ثلاثي كلور تري آزين ـ 5,3,1 (كلوريد حمض سيانوريك) الذي يتحلمه إلى حمض سيانوريك cyanuric acid الذي يعطي عند تسخينه حمض إيزوسيانيك
التعريف
Valence is defined by the IUPAC as:[3]
- The maximum number of univalent atoms (originally hydrogen or chlorine atoms) that may combine with an atom of the element under consideration, or with a fragment, or for which an atom of this element can be substituted.
An alternative modern description is:[4]
- The number of hydrogen atoms that can combine with an element in a binary hydride or twice the number of oxygen atoms combining with an element in its oxide or oxides.
This definition differs from the IUPAC definition as an element can be said to have more than one valence.
التطور التاريخي
The etymology of the words valence (plural valences) and valency (plural valencies) traces back to 1425, meaning "extract, preparation", from Latin valentia "strength, capacity", from the earlier valor "worth, value", and the chemical meaning referring to the "combining power of an element" is recorded from 1884, from German Valenz.[5]
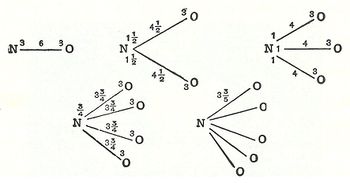
The concept of valence was developed in the second half of the 19th century and helped successfully explain the molecular structure of inorganic and organic compounds.[2] The quest for the underlying causes of valence led to the modern theories of chemical bonding, including the cubical atom (1902), Lewis structures (1916), valence bond theory (1927), molecular orbitals (1928), valence shell electron pair repulsion theory (1958), and all of the advanced methods of quantum chemistry.
In 1789, William Higgins published views on what he called combinations of "ultimate" particles, which foreshadowed the concept of valency bonds.[6] If, for example, according to Higgins, the force between the ultimate particle of oxygen and the ultimate particle of nitrogen were 6, then the strength of the force would be divided accordingly, and likewise for the other combinations of ultimate particles (see illustration).
The exact inception, however, of the theory of chemical valencies can be traced to an 1852 paper by Edward Frankland, in which he combined the older radical theory with thoughts on chemical affinity to show that certain elements have the tendency to combine with other elements to form compounds containing 3, i.e., in the 3-atom groups (e.g., NO
3, NH
3, NI
3, etc.) or 5, i.e., in the 5-atom groups (e.g., NO
5, NH
4O, PO
5, etc.), equivalents of the attached elements. According to him, this is the manner in which their affinities are best satisfied, and by following these examples and postulates, he declares how obvious it is that[7]
A tendency or law prevails (here), and that, no matter what the characters of the uniting atoms may be, the combining power of the attracting element, if I may be allowed the term, is always satisfied by the same number of these atoms.
This "combining power" was afterwards called quantivalence or valency (and valence by American chemists).[6] In 1857 August Kekulé proposed fixed valences for many elements, such as 4 for carbon, and used them to propose structural formulas for many organic molecules, which are still accepted today.
Lothar Meyer in his 1864 book, Die modernen Theorien der Chemie, contained an early version of the periodic table containing 28 elements, for the first time classified elements into six families by their valence. Works on organizing the elements by atomic weight, until then had been stymied by the widespread use of equivalent weights for the elements, rather than atomic weights.[8]
Most 19th-century chemists defined the valence of an element as the number of its bonds without distinguishing different types of valence or of bond. However, in 1893 Alfred Werner described transition metal coordination complexes such as [Co(NH
3)
6]Cl
3, in which he distinguished principal and subsidiary valences (German: 'Hauptvalenz' and 'Nebenvalenz'), corresponding to the modern concepts of oxidation state and coordination number respectively.
For main-group elements, in 1904 Richard Abegg considered positive and negative valences (maximal and minimal oxidation states), and proposed Abegg's rule to the effect that their difference is often 8.
An alternative definition of valence, developed in the 1920's and having modern proponents, differs in cases where an atom's formal charge is not zero. It defines the valence of a given atom in a covalent molecule as the number of electrons that an atom has used in bonding:[9][10][11][12]
- valence = number of electrons in valence shell of free atom − number of non-bonding electrons on atom in molecule,
or equivalently:
- valence = number of bonds + formal charge.
In this convention, the nitrogen in an ammonium ion [NH
4]+
bonds to four hydrogen atoms, but it is considered to be pentavalent because all five of nitrogen's valence electrons participate in the bonding.[9]
الإلكترونات والتكافؤ
The Rutherford model of the nuclear atom (1911) showed that the exterior of an atom is occupied by electrons, which suggests that electrons are responsible for the interaction of atoms and the formation of chemical bonds. In 1916, Gilbert N. Lewis explained valence and chemical bonding in terms of a tendency of (main-group) atoms to achieve a stable octet of 8 valence-shell electrons. According to Lewis, covalent bonding leads to octets by the sharing of electrons, and ionic bonding leads to octets by the transfer of electrons from one atom to the other. The term covalence is attributed to Irving Langmuir, who stated in 1919 that "the number of pairs of electrons which any given atom shares with the adjacent atoms is called the covalence of that atom".[13] The prefix co- means "together", so that a co-valent bond means that the atoms share a valence. Subsequent to that, it is now more common to speak of covalent bonds rather than valence, which has fallen out of use in higher-level work from the advances in the theory of chemical bonding, but it is still widely used in elementary studies, where it provides a heuristic introduction to the subject.
In the 1930s, Linus Pauling proposed that there are also polar covalent bonds, which are intermediate between covalent and ionic, and that the degree of ionic character depends on the difference of electronegativity of the two bonded atoms.
Pauling also considered hypervalent molecules, in which main-group elements have apparent valences greater than the maximal of 4 allowed by the octet rule. For example, in the sulfur hexafluoride molecule (SF
6), Pauling considered that the sulfur forms 6 true two-electron bonds using sp3d2 hybrid atomic orbitals, which combine one s, three p and two d orbitals. However more recently, quantum-mechanical calculations on this and similar molecules have shown that the role of d orbitals in the bonding is minimal, and that the SF
6 molecule should be described as having 6 polar covalent (partly ionic) bonds made from only four orbitals on sulfur (one s and three p) in accordance with the octet rule, together with six orbitals on the fluorines.[14] Similar calculations on transition-metal molecules show that the role of p orbitals is minor, so that one s and five d orbitals on the metal are sufficient to describe the bonding.[15]
التكافؤات المشتركة
For elements in the main groups of the periodic table, the valence can vary between 1 and 8.
| Group | Valence 1 | Valence 2 | Valence 3 | Valence 4 | Valence 5 | Valence 6 | Valence 7 | Valence 8 | Typical valences |
|---|---|---|---|---|---|---|---|---|---|
| 1 (I) | NaCl KCl |
1 | |||||||
| 2 (II) | MgCl 2 CaCl 2 |
2 | |||||||
| 13 (III) | InBr TlI |
BCl 3 AlCl 3 Al 2O 3 |
3 | ||||||
| 14 (IV) | CO PbCl 2 |
CO 2 CH 4 SiCl 4 |
2 and 4 | ||||||
| 15 (V) | NO | NH 3 PH 3 As 2O 3 |
NO 2 |
N 2O 5 PCl 5 |
3 and 5 | ||||
| 16 (VI) | H 2O H 2S SCl 2 |
SO 2 SF 4 |
SO 3 SF 6 H 2SO 4 |
2, 4 and 6 | |||||
| 17 (VII) | HCl ICl |
HClO 2 ClF 3 |
ClO 2 |
IF 5 HClO 3 |
IF 7 Cl 2O 7 HClO 4 |
1, 3, 5 and 7 | |||
| 18 (VIII) | KrF 2 |
XeF 4 |
XeO 3 |
XeO 4 |
0, 2, 4, 6 and 8 |
Many elements have a common valence related to their position in the periodic table, and nowadays this is rationalised by the octet rule.
The Greek/Latin numeral prefixes (mono-/uni-, di-/bi-, tri-/ter-, and so on) are used to describe ions in the charge states 1, 2, 3, and so on, respectively. Polyvalence or multivalence refers to species that are not restricted to a specific number of valence bonds. Species with a single charge are univalent (monovalent). For example, the Cs+
cation is a univalent or monovalent cation, whereas the Ca2+ cation is a divalent cation, and the Fe3+ cation is a trivalent cation. Unlike Cs and Ca, Fe can also exist in other charge states, notably 2+ and 4+, and is thus known as a multivalent (polyvalent) ion.[16] Transition metals and metals to the right are typically multivalent but there is no simple pattern predicting their valency.[17]
| Valence | More common adjective‡ | Less common synonymous adjective‡§ |
|---|---|---|
| 0-valent | zerovalent | nonvalent |
| 1-valent | monovalent | univalent |
| 2-valent | divalent | bivalent |
| 3-valent | trivalent | tervalent |
| 4-valent | tetravalent | quadrivalent |
| 5-valent | pentavalent | quinquevalent, quinquivalent |
| 6-valent | hexavalent | sexivalent |
| 7-valent | heptavalent | septivalent |
| 8-valent | octavalent | — |
| 9-valent | — | |
| 10-valent | decavalent | — |
| 11-valent | undecavalent | — |
| 12-valent | dodecavalent | — |
| multiple / many / variable | polyvalent | multivalent |
| together | covalent | — |
| not together | noncovalent | — |
† The same adjectives are also used in medicine to refer to vaccine valence, with the slight difference that in the latter sense, quadri- is more common than tetra-.
‡ As demonstrated by hit counts in Google web search and Google Books search corpora (accessed 2017).
§ A few other forms can be found in large English-language corpora (for example, *quintavalent, *quintivalent, *decivalent), but they are not the conventionally established forms in English and thus are not entered in major dictionaries.
Valence versus oxidation state
Because of the ambiguity of the term valence,[18] other notations are currently preferred. Beside the lambda notation, as used in the IUPAC nomenclature of inorganic chemistry,[19] oxidation state is a more clear indication of the electronic state of atoms in a molecule.
The oxidation state of an atom in a molecule gives the number of valence electrons it has gained or lost.[20] In contrast to the valency number, the oxidation state can be positive (for an electropositive atom) or negative (for an electronegative atom).
Elements in a high oxidation state have an oxidation state higher than +4, and also, elements in a high valence state (hypervalent elements) have a valence higher than 4. For example, in perchlorates ClO−
4, chlorine has 7 valence bonds (thus, it is heptavalent, in other words, it has valence 7), and it has oxidation state +7; in ruthenium tetroxide RuO
4, ruthenium has 8 valence bonds (thus, it is octavalent, in other words, it has valence 8), and it has oxidation state +8.
In some molecules, there is a difference between valence and oxidation state for a given atom. For example, in disulfur decafluoride molecule S
2F
10, each sulfur atom has 6 valence bonds (5 single bonds with fluorine atoms and 1 single bond with the other sulfur atom). Thus, each sulfur atom is hexavalent or has valence 6, but has oxidation state +5. In the dioxygen molecule O
2, each oxygen atom has 2 valence bonds and so is divalent (valence 2), but has oxidation state 0. In acetylene H−C≡C−H, each carbon atom has 4 valence bonds (1 single bond with hydrogen atom and a triple bond with the other carbon atom). Each carbon atom is tetravalent (valence 4), but has oxidation state −1.
Examples
| Compound | Formula | Valence | Oxidation state | Diagram |
|---|---|---|---|---|
| Hydrogen chloride | HCl | H = 1 Cl = 1 | H = +1 Cl = −1 | H−Cl |
| Perchloric acid * | HClO 4 |
H = 1 Cl = 7 O = 2 | H = +1 Cl = +7 O = −2 | 
|
| Methane | CH 4 |
C = 4 H = 1 | C = −4 H = +1 | 
|
| Dichloromethane ** | CH 2Cl 2 |
C = 4 H = 1 Cl = 1 | C = 0 H = +1 Cl = −1 | 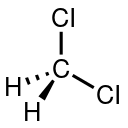
|
| Ferrous oxide *** | FeO | Fe = 2 O = 2 | Fe = +2 O = −2 | Fe=O |
| Ferric oxide *** | Fe 2O 3 |
Fe = 3 O = 2 | Fe = +3 O = −2 | O=Fe−O−Fe=O |
| Sodium hydride | NaH | Na = 1 H = 1 | Na = +1 H = −1 | Na−H |
* The perchlorate ion ClO−
4 is monovalent, in other words, it has valence 1.
** Valences may also be different from absolute values of oxidation states due to different polarity of bonds. For example, in dichloromethane, CH
2Cl
2, carbon has valence 4 but oxidation state 0.
*** Iron oxides appear in a crystal structure, so no typical molecule can be identified. In ferrous oxide, Fe has oxidation state +2; in ferric oxide, oxidation state +3.
| Compound | Formula | Valence | Oxidation state | Diagram |
|---|---|---|---|---|
| Hydrogen | H 2 |
H = 1 | H = 0 | H−H |
| Chlorine | Cl 2 |
Cl = 1 | Cl = 0 | Cl−Cl |
| Hydrogen peroxide | H 2O 2 |
H = 1 O = 2 | H = +1 O = −1 | 
|
| Hydrazine | N 2H 4 |
H = 1 N = 3 | H = +1 N = −2 | 
|
| Disulfur decafluoride | S 2F 10 |
S = 6 F = 1 | S = +5 F = −1 | 
|
| Dithionic acid | H 2S 2O 6 |
S = 6 O = 2 H = 1 | S = +5 O = −2 H = +1 | 
|
| Hexachloroethane | C 2Cl 6 |
C = 4 Cl = 1 | C = +3 Cl = −1 | 
|
| Ethylene | C 2H 4 |
C = 4 H = 1 | C = −2 H = +1 | 
|
| Acetylene | C 2H 2 |
C = 4 H = 1 | C = −1 H = +1 | H−C≡C−H |
| Mercury(I) chloride | Hg 2Cl 2 |
Hg = 2 Cl = 1 | Hg = +1 Cl = −1 | Cl−Hg−Hg−Cl |
تعريف "العدد الأقصى للروابط"
Frankland took the view that the valence (he used the term "atomicity") of an element was a single value that corresponded to the maximum value observed. The number of unused valencies on atoms of what are now called the p-block elements is generally even, and Frankland suggested that the unused valencies saturated one another. For example, nitrogen has a maximum valence of 5, in forming ammonia two valencies are left unattached; sulfur has a maximum valence of 6, in forming hydrogen sulphide four valencies are left unattached.[21][22]
The International Union of Pure and Applied Chemistry (IUPAC) has made several attempts to arrive at an unambiguous definition of valence. The current version, adopted in 1994:[23]
- The maximum number of univalent atoms (originally hydrogen or chlorine atoms) that may combine with an atom of the element under consideration, or with a fragment, or for which an atom of this element can be substituted.[3]
Hydrogen and chlorine were originally used as examples of univalent atoms, because of their nature to form only one single bond. Hydrogen has only one valence electron and can form only one bond with an atom that has an incomplete outer shell. Chlorine has seven valence electrons and can form only one bond with an atom that donates a valence electron to complete chlorine's outer shell. However, chlorine can also have oxidation states from +1 to +7 and can form more than one bond by donating valence electrons.
Hydrogen has only one valence electron, but it can form bonds with more than one atom. In the bifluoride ion ([HF
2]−
), for example, it forms a three-center four-electron bond with two fluoride atoms:
- [F−H F−
↔ F−
H−F]
Another example is the three-center two-electron bond in diborane (B
2H
6).
التكافؤات القصوى للعناصر
Maximum valences for the elements are based on the data from list of oxidation states of the elements. They are shown by the color code at the bottom of the table.
| أخفMaximum valences of the elements | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||
| Group → | ||||||||||||||||||||||||||||||
| ↓ Period | ||||||||||||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||||||||||||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||||||||||||
| 6 | 55 Cs |
56 Ba |
71 Lu |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | ||||||||||||
| 7 | 87 Fr |
88 Ra |
103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | ||||||||||||
| 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
|||||||||||||||||
| 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No | |||||||||||||||||
| Maximum valences are based on the List of oxidation states of the elements | ||||||||||||||||||||||||||||||
|
0 1 2 3 4 5 6 7 8 9 غير معروف لون الخلفية يبين التكافؤ الأقصى للعنصر الكيميائي
| ||||||||||||||||||||||||||||||
انظر أيضاً
المصادر
- ^ فاروق قنديل. "رباعي تكافؤ". الموسوعة العربية.
- ^ أ ب Partington, James Riddick (1921). A text-book of inorganic chemistry for university students (1st ed.). OL 7221486M.
- ^ أ ب IUPAC Gold Book definition: valence
- ^ Greenwood, N. N. (1997). Chemistry of the Elements (2nd Edition ed.). Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
{{cite book}}:|edition=has extra text (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ قالب:OEtymD
- ^ أ ب Partington, J.R. (1989). A Short History of Chemistry. Dover Publications, Inc. ISBN 0-486-65977-1.
- ^ Frankland, E. (1852). "On a New Series of Organic Bodies Containing Metals". Philosophical Transactions of the Royal Society of London. 142: 417–444. doi:10.1098/rstl.1852.0020. S2CID 186210604.
- ^ Alan J. Rocke (1984). Chemical Atomism in the Nineteenth Century: From Dalton to Cannizzaro. Ohio State University Press.
- ^ أ ب Parkin, Gerard (May 2006). "Valence, Oxidation Number, and Formal Charge: Three Related but Fundamentally Different Concepts". Journal of Chemical Education. 83 (5): 791. Bibcode:2006JChEd..83..791P. doi:10.1021/ed083p791. ISSN 0021-9584.
While the concepts and definitions of valence have been refined over the years, that described by Sidgwick remains the most useful and simple definition for covalent molecules: the valence of an atom in a covalent molecule is simply the number of electrons that an atom has used in bonding.
- ^ Sidgwick, N. V. (1927). The electronic theory of valency. London: Oxford University Press (Clarendon Press). p. 199.
On the whole the best definition of absolute valency seems to be that adopted by Grimm and Sommerfeld, that it is numerically equal to the number of electrons of the atom 'engaged' (beansprucht) in attaching the other atoms.
- ^ Grimm, H.G.; Sommerfeld, A (1926). "Über den. Zusammenhang des Abschlusses der Elektronengruppen im Atom mit den chemischen Valenzzahlen". Zeitschrift für Physik. 36 (1): 36–59. Bibcode:1926ZPhy...36...36G. doi:10.1007/bf01383924. S2CID 120248399.
- ^ Smith, Derek W. (2005). "Valence, Covalence, Hypervalence, Oxidation State, and Coordination Number". Journal of Chemical Education. 82 (8): 1202. Bibcode:2005JChEd..82.1202S. doi:10.1021/ed082p1202. ISSN 0021-9584.
- ^ Langmuir, Irving (1919). "The Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society. 41 (6): 868–934. doi:10.1021/ja02227a002.
- ^ Magnusson, Eric (1990). "Hypercoordinate molecules of second-row elements: d functions or d orbitals?". J. Am. Chem. Soc. 112 (22): 7940–7951. doi:10.1021/ja00178a014.
- ^ Frenking, Gernot; Shaik, Sason, eds. (May 2014). "Chapter 7: Chemical bonding in Transition Metal Compounds". The Chemical Bond: Chemical Bonding Across the Periodic Table. Wiley – VCH. ISBN 978-3-527-33315-8.
- ^ Merriam-Webster, Merriam-Webster's Unabridged Dictionary, Merriam-Webster, http://unabridged.merriam-webster.com/unabridged/, retrieved on 2017-05-11.
- ^ "Lesson 7: Ions and Their Names". Clackamas Community College. Archived from the original on 21 January 2019. Retrieved 5 February 2019.
- ^ The Free Dictionary: valence
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Lambda".
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Oxidation state".
- ^ Frankland, E. (1870). Lecture notes for chemical students(Google eBook) (2d ed.). J. Van Voorst. p. 21.
- ^ Frankland, E.; Japp, F.R (1885). Inorganic chemistry (1st ed.). pp. 75–85. OL 6994182M.
- ^ Muller, P. (1994). "Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)". Pure and Applied Chemistry. 66 (5): 1077–1184. doi:10.1351/pac199466051077. S2CID 195819485.
المراجع
- روبرت ت.موريسون وروبرت ن. بويد، الكيمياء العضوية، ترجمة فاروق قنديل وصالح القادري وآخرين (المركز العربي للتعريب والترجمة والنشر، دمشق 2000).
- PAULA YURKANIS BRUICE, Organic Chemistry (Prentice Hall , Pearson Education Inc. 2004).
- GEORGE H.SCHMID, Organic Chemistry (Mosby-Year Book, Inc. 1996).