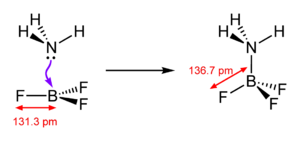ثلاثي فلوريد البورون
|
| |||
| الأسماء | |||
|---|---|---|---|
| أسماء أخرى
Boron fluoride, Trifluoroborane
| |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.699 | ||
| رقم EC |
| ||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
| UN number | Compressed: 1008. Boron trifluoride dihydrate: 2851. | ||
CompTox Dashboard (EPA)
|
|||
| الخصائص | |||
| الصيغة الجزيئية | BF3 | ||
| كتلة مولية | 67.82 g/mol (anhydrous) 103.837 g/mol (dihydrate) | ||
| المظهر | colorless gas (anhydrous) colorless liquid (dihydrate) | ||
| الكثافة | 0.00276 g/cm3 (anhydrous gas) 1.64 g/cm3 (dihydrate) | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | exothermic decomposition [1] (anhydrous) very soluble (dihydrate) | ||
| قابلية الذوبان | soluble in benzene, toluene, hexane, chloroform and methylene chloride | ||
| ضغط البخار | >50 atm (20°C)[2] | ||
| Dipole moment | 0 D | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
-1137 kJ/mol | ||
| Standard molar entropy S |
254.3 J/mol K | ||
| سعة الحرارة النوعية، C | 50.46 J/mol K | ||
| المخاطر[4][5] | |||
| صفحة بيانات السلامة | ICSC | ||
| ن.م.ع. مخطط تصويري |   
| ||
| ن.م.ع. كلمة الاشارة | DANGER | ||
| H314, H330 [note 1] | |||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | غير قابل للاشتعال | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LC50 (التركيز الأوسط)
|
1227 ppm (mouse, 2 hr) 39 ppm (guinea pig, 4 hr) 418 ppm (rat, 4 hr)[3] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
C 1 ppm (3 mg/m3)[2] | ||
REL (الموصى به)
|
C 1 ppm (3 mg/m3)[2] | ||
IDLH (خطر عاجل)
|
25 ppm[2] | ||
| مركبات ذا علاقة | |||
أنيونات أخرى
|
ثلاثي كلوريد البورون ثلاثي بروميد البورون ثلاثي يوديد البورون | ||
كاتيونات أخرى
|
فلوريد الألومنيوم فلوريد الگاليوم الثلاثي فلوريد الإنديوم الثلاثي فلوريد الثاليوم الثلاثي | ||
مركـّبات ذات علاقة
|
أحادي فلوريد البورون | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
ثلاثي فلوريد البورون هو مركب كيميائي من الفلور والبورون له الصيغة الكيميائية BF3، ويكون على شكل غاز عديم اللون.
التحضير
حضر ثلاثي فلوريد البورون لأول مرة سنة 1808 من قبل لوي جوزيف غي ـ لوساك ولوي جاك تينار، واللذان كانا يحاولان تحضير وعزل حمض الفلوريك (أي حمض الهيدروفلوريك) من تفاعل فلوريد الكالسيوم مع حمض البوريك المزجج، حيث كانت الغازات الناتجة غير قادرة على تنميش الزجاج، فأطلقوا اسم غاز الفلوبوريك عليها.[7][8]
يمكن أن يحضّر ثلاثي فلوريد البورون بعدة طرق، منها إجراء تفاعل بين ثلاثي أكسيد البورون مع حمض الهيدروفلوريك:
تقنياً، يحضّر المركب من تسخين أكسيد البورون أو البوراكس مع معدن الفلوريت بوجود حمض الكبريتيك المركز.[9] ينتج على المستوى الصناعي ما يتراوح بين 2300 إلى 4500 طن من ثلاثي فلوريد البورون سنوياً.[10]
أما مخبرياً، فيمكن التحضير من التفكك الحراري لرباعي فلورو بورات أملاح الديازونيوم.[11]
من طرق التحضير الأخرى، إجراء تفاعل بين رباعي فلوروبورات البوتاسيوم أو رباعي فلوروبورات الصوديوم مع أكسيد البورون:
يمكن أن يجري التفاعل بوجود حمض الكبريتيك المركز:[12]
كما يمكن التحضير من تفاعل حمض البوريك مع حمض فلورو الكبريتيك:[13]
الخواص
إن مركب ثلاثي فلوريد البورون عبارة عن غاز سام عديم اللون وأكّال، وتبلغ قيمة النقطة الحرجة له −12.3 °س. يعد BF3 من أحماض لويس القوية، ويقوم بتشكيل العديد من المعقّدات التناسقية.
يكون لثلاثي فلوريد البورون بنية جزيئية مستوية ثلاثية، ويكون للرابطة B-F طول مقداره 131.3 بيكومتر، والذي يزداد إلى 136.7 عند تشكيل معقدات تناسقية. تستخدم معقدات ثلاثي فلوريد البورون مع ثنائي إيثيل الإيثر (BF3 · O(Et)2) أو مع كبريتيد ثنائي الميثيل (BF3 · S(Me)2) من أجل الحصول على سائل كمصدر للمركب، مما يسهل التعامل معه في المختبر.
يتفاعل ثلاثي فلوريد البورون مع الماء بعنف، حيث يتفكك إلى حمض البوريك وحمض هيدروفلوروبوريك. على العكس من هاليدات البورون الأخرى، فإن BF3 لا يحدث له تفاعل حلمهة مباشر، إنما تحدث هناك سلسلة من عدة تفاعلات يتشكل فيها نواتج إضافة:
إن تفاعل الحلمهة يكون غير مكتملاً في حال وجود هاليدات أخرى للبورون، وذلك بسبب تشكل أيون رباعي فلوروبورات −BF4 رباعي السطوح الخامل.
كما أن نواتج تفاعل الحلمهة تتفاعل لاحقاً لتشكل حمض رباعي فلورو البوريك، والذي يوجد على شكل ملح أكسونيوم.
الاستخدامات
يستخدم ثلاثي فلوريد البورون ككاشف مهم في الاصطناع العضوي وذلك نظراً لخصائص حمض لويس، حيث يقوم بتحفيز تفاعلات البلمرة في مركبات بولي إيثر غير المشبعة.[10][14]
كما يستخدم المركب كحفاز في العديد من تفاعلات التماكب والألكلة والتكاثف، بالإضافة إلى تفاعل إضافة ألدول موكاياما.[15]
الاكتشاف
ثلاثي فلوريد البورون اكتشفه في 1808 كل من جوزيف لوي گي-لوساك و لوي جاك ثينار، اللذان كانا يحاولات عزل "حمض الفلوريك" (أي حمض الهيدروفلوريك) بجمع فلوريد الكالسيوم مع حمض البوريك المزجج. فشلت الأبخرة الناتجة في أن تخدش الزجاج، ولذلك سمياها غاز الفلوبوريك.[16][17]
المراجع
- ^ http://www.nap.edu/openbook.php?record_id=4911&page=266
- ^ أ ب ت ث NIOSH Pocket Guide to Chemical Hazards 0062
- ^ "Boron trifluoride". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ قالب:CLP Regulation
- ^ قالب:PGCH-ref.
- ^ http://www.newenv.com/resources/nfpa_chemicals
- ^ Gay-Lussac, J. L.; Thénard, L. J. (1809). "Sur l'acide fluorique". Annales de Chimie. 69: 204–220.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Gay-Lussac, J. L.; Thénard, L. J. (1809). "Des propriétés de l'acide fluorique et sur-tout de son action sur le métal de la potasse". Mémoires de Physique et de Chimie de la Société d’Arcueil. 2: 317–331.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Holleman, A. F.; Wiberg, E. Inorganic Chemistry. Academic Press.
{{cite book}}: Cite has empty unknown parameters:|lay-date=,|subscription=,|nopp=,|last-author-amp=,|name-list-format=,|lay-source=,|registration=, and|lay-summary=(help)CS1 maint: multiple names: authors list (link) - ^ أ ب Brotherton, R. J.; Weber, C. J.; Guibert, C. R.; Little, J. L. (2005), "Boron Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a04_309
- ^ قالب:OrgSynth
- ^ Handbook of Preparative Inorganic Chemistry Vol. 1, 2nd Ed. Academic Press. p. 220 & 773.
{{cite book}}: Cite has empty unknown parameters:|lay-date=,|subscription=,|nopp=,|last-author-amp=,|name-list-format=,|lay-source=,|registration=, and|lay-summary=(help) - ^ Georg Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2nd edition. Band 1. Academic Press, New York NY u. a. 1963, S. 219–221.
- ^ قالب:يستشهد موسوعة
- ^ "Boron Trifluoride (BF3) Applications". Honeywell.
- ^ Gay-Lussac, J. L.; Thénard, L. J. (1809). "Sur l'acide fluorique". Annales de Chimie. 69: 204–220.
- ^ Gay-Lussac, J. L.; Thénard, L. J. (1809). "Des propriétés de l'acide fluorique et sur-tout de son action sur le métal de la potasse". Mémoires de Physique et de Chimie de la Société d’Arcueil. 2: 317–331.
خطأ استشهاد: وسوم <ref> موجودة لمجموعة اسمها "note"، ولكن لم يتم العثور على وسم <references group="note"/>