فلوريد الألومنيوم
| |

| |
| الأسماء | |
|---|---|
| أسماء أخرى
Aluminium(III) fluoride
Aluminum trifluoride | |
| المُعرِّفات | |
| رقم CAS | |
| ECHA InfoCard | 100.029.137 |
PubChem CID
|
|
| رقم RTECS |
|
CompTox Dashboard (EPA)
|
|
| الخصائص | |
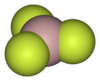
| الصيغة الجزيئية | AlF3 |
| كتلة مولية | 83.9767 g/mol (anhydrous) 101.022 g/mol (monohydrate) 138.023 (trihydrate) |
| المظهر | white, crystalline solid odorless |
| الكثافة | 2.88 g/cm (anhydrous) 2.1 g/cm3 (monohydrate) 1.914 g/cm3 (trihydrate) |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | 0.56 g/100 mL (0 °C) 0.67 g/100 mL (20 °C) 1.72 g/100 mL (100 °C) |
| البنية | |
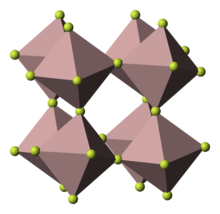
| البنية البلورية | Rhombohedral, hR24 |
| الزمرة الفراغية | R-3c, No. 167 |
| المخاطر | |
تبويب الاتحاد الاوروپي (DSD)
|
Harmful (Xn)[1] |
| توصيف المخاطر | R22, R36/37/38[1] |
| تحذيرات وقائية | S26[1] |
| NFPA 704 (معيـَّن النار) | |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
فلوريد الألومنيوم هو مركب كيميائي له الصيغة AlF3 ، ويكون على شكل مسحوق بلوري عديم اللون.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص
- عملياً يعد فلوريد الألومنيوم عديم الانحلال في الماء، حيث يننحل منه فقط 0.56 غ / 100 مل ماء، كما أنه قليل الانحلال أيضاً في كل من الحموض والأسس.
- يشكل معقدات مع فلوريدات المعادن الأخرى مثل فلوريد الصوديوم،لها الصيغ العامة
Me[AlF4] ، Me2[AlF5] ، Me3[AlF6]
حيث Me ترمز للمعدن
وتكون البنية البلورية لها مثل فلوريد الألمنيوم عبارة عن ثماني وجوه

التحضير
يحضر فلوريد الألومنيوم بشكله النقي من تسخين مركب سداسي فلوروألومينات الأمونيوم (كريوليت الأمونيوم) حنى التوهج في تيار من غاز النيتروجين. أما سداسي فلوروألومينات الأمونيوم فيحضر من تفاعل هيدروكسيد الألمنيوم مع محلول مركز وساخن من فلوريد الأمونيوم، حيث نحصل عليه على شكل راسب من المحلول. التفاعلات:
- 6NH4F + Al(OH)3 → (NH4)3[AlF6] + 3NH3 + 3H2O
- (NH4)3[AlF6] → AlF3 + 3NH4F
كما يمكن الحصول على شكله المائي من تفاعل حل الألمنيوم في حمض فلوريد الهيدروجين، فينتج لدينا ثلاثي هيدرات فلوريد الألومنيوم، والذي من الصعب نزع الماء منه .
المصادر
Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
