اضمحلال مشع
| فيزياء نووية |
|---|
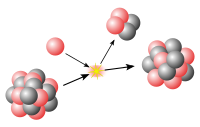 |
الانحلال الاشعاعي هو عملية تطلق فيها نويات الذرات غير المستقرة الإشعاع أو الجسيمات مأيـِّنة أو الأشعة ذات الطاقة العالية من نواتها. يربو عدد الأنواع المختلفة من الذرات المعروفة على 2,300 نوع ، والمشع منها يزيد على الألفي نوع، منها نحو 50 نوعًا توجد في الطبيعة. أما البقية فقد استحدثها العلماء صناعيًا. في هذا النوع من الإحلال، فقدان الطاقة ، يؤدي إلى إنتاج ذرة من نوع واحد ، تسمى النيوكليد الأب والتي تتحول إلى ذرة من نوع مختلف ، تسمى النيوكليد الإبنة. على سبيل المثال: يحدث إنبعاث إشعاعي عن ذرة كربون-14 (الذرة الأبوية) وتتحول إلى ذرة نيتروجين-14 (النواة الإبنة). وتعتبر هذه العملية عشوائية على المستوى الذري ، وفي هذا السياق فإنه من المستحيل التكهن بموعد الإنحلال الذري ، ولكن نظرات لوجود عدد كبير من الذرات المتشابهة فإنه يمكن الخروج بنسبة متوسطة للنشاط الإشعاعي للمادة.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
يعود إكتشاف النشاط الإشعاعي الطبيعي إلى العالم أنتوني هنري بكرل عام 1896 ، وذلك عندما كان يبحث في مخبره في معهد التقانات العليا في باريس في كيفية تصوير الأشعة السينية وابرازهاعلى صفائح فوتوغرافية من صنعه,مصنوعة من كبريتات مختلفة للتوتياء والكالسيوم وأملاح أخرى غير معروفة كثيرا ونادرة, فخلال محاولاته لاحظ تأثر الصفائح في الظلام رغم عدم قذفها بأشعة مهبطية ،بحيث تصدر هذه الأملاح التي تحتوي على اليورانيوم إشعاعات مميزة سماها في سنة 1896 إشعاعات يورانيومية وهي ناتجة عن نشاط إشعاعي يحدث في الطبيعة تلقائيا ، بعدها تأكد كل من ماري كوري وزوجها پيير من سبب هذا النشاط إذ تبين أن صفائح بكرل تحتوي على اليورانيوم هو سبب الحصول على هذه الإشعاعات نظرا للتناسب الطردي بين شدة هذا النشط وكمية اليورانيوم في هذه الأملاح.[1]
في عام 1896 م اكتشف بكرل أن أحد أملاح اليورانيوم يصدر اشعاعا - لم تكن طبيعته واضحة في ذلك الوقت - وأثبت بكريل أن الاشعاع الذي اكتشفه يصدر عن جميع مركبات اليورانيوم وعن اليورانيوم الفزي أيضا بما يعني أن مصدر الاشعاع هو ذرة اليورانيوم واتضح له أن هذا الاشعاع يحدث بصورة تلقائية مستمرة لا تؤثر عليه المؤثرات الخارجية من ضغط ودرجة حرارة ولهذا سمى اشعاع اليورانيوم اشعاع نشط Radioactive Radiation وتسمى هذه الظاهرة النشاط الإشعاعي Radioactivity في عام 1898 م قام بيير كوري وزوجته ماريا سكلودوفسكايا - بولندية الاصل - ومشهورة باسم مدام كوري باكتشاف النشاط الاشعاعي للثوريوم وأيضا اكتشفا في نفس السنة عنصرين جديدين يوجدان في خامات اليورانيوم العنصر الاول أطلق عليه الراديوم وهو عنصر أقوى في نشاطه الاشعاعي من اليورانيوم بمليون مرة بينما العنصر الثاني أطلقا عليه اسم مسقط رأس م كوري وهو بولونيوم وبعد 10 سنوات اكتشف رذرفورد في عام 1908 م الغاز النشط اشعاعيا - الرادون - بواسطة التحليل الطيفي
الشرح

خواصُّ النَّوَى
لكي نفهم ما يحدث داخل ذرة مشعة ، يجب علينا أن نتعرف على تركيب النواة. يسمى عدد البروتونات في نواة الذرة العدد الذري. ولكل عنصر عدد ذري مختلف. فالهيدروجين مثلاً له بروتون واحد، ولذا فإن عدده الذري 1، واليورانيوم عدده الذري 92 لأن نواته تحتوي على 92 بروتونًا. ويسمى العدد الكلي من البروتونات والنيوترونات في نواة الذرة، العدد الكُتلي. وتحتوي نواة الهيدروجين العادي على بروتون واحد، وليس بها نيوترونات، ولذا فإن العدد الكتلي للهيدروجين العادي هو واحد. أما نواة الهيدروجين الثقيل، أي (الديوتريوم) فإنه يوجد بها بروتون واحد ونيوترون واحد، ولذا فإن عدده الكتلي 2. كما أن أحد الأنواع المشعة للهيدروجين والمسمى تريتيوم له العدد الكتلي 3، وذلك لأن به بروتونًا واحدًا ونيوترونين. ولكن الأنواع الثلاثة للهيدروجين لها نفس العدد الذري. وتسمى الذرات التي لها نفس العدد الذري ولها أعداد كتلية مختلفة النظائر. أي أن الهيدروجين العادي والديوتريوم والتريتيوم ، كلها، نظائر لعنصر الهيدروجين، ويكتبها العلماء عادة 31H , 21H , 11H. ويمثل العدد الأسفل العدد الذري، في حين أن العدد الأعلى يمثل العدد الكتلي. وجميع نظائر أيِّ عنصر ذات خصائص كيميائية واحدة.
ابتعاث الإشعاع
تنشأ الأنواع المختلفة من الإشعاع في نوى الذرات المشعَّة. وما جسيم ألفا، المكوَّن من بروتونات ونيوترونات، إلا شَظيَّة من النواة التي أطلقته. أما إلكترون أشعة بيتا، فإنه ينشأ في النواة عندما يحدث تغيُّر لأحد الجسيمات فيها. وعندما تطلق الذرات إشعاع ألفا أو بيتا، فإنها تتغير إلى ذرات عناصر أخرى، يُسمِّي العلماء ذلك التغير التحوُّل أو التبدُّل. أما ابتعاث أشعة گاما فينتج عنه تحرر للطاقة فقط ولا يحدث بسببه تحوُّل.
تغير النشاط الإشعاعي مع الزمن
النشاط الإشعاعى للعناصر المشعة تتغير مع الزمن تبعاً لدالة أسية e-0.693t/T A= A0 حيث A تمثل النشاط الاشعاعى عند الزمن T و A0 عند الزمن T=0 ويسمى T بعمر النصف half life الذى يعرف بأنه الزمـن اللازم لكى تتحلل نصف عدد الأنوية .وهناك عناصر لها عمر نصف كبير يقدر بـ 1010 × 1.39 سنة كعنصــر الثوريوم s232Th وأخرى مثل البولونيوم s212Po يبلغ عمر النصـف فيـها 10 -7 × 3 ثانيـة . ويبين الشكل تغير النشاط الإشعاعى (A) مع الزمن (T).
عمر النصف
عدد الجسيمات المنطلقة من عينة نظير مشعّ في فترة زمنية هو نسبة مئوية محددة من عدد ذرات العينة. فمثلاً، ينحل من أي عينة من 11CC 3,5% منها كل دقيقة. فإذا بدأنا بعينة ما من 11C، فإنه لن يتبقى منها بعد أول دقيقة إلا 96,5%. وفي نهاية الدقيقة الثانية يتبقى 96,5% من العينة عند بدء هذه الدقيقة، أي 96,5% من 96,5% من العينة الأصلية، أي 93,1% من العينة الأصلية. وبعد عشرين دقيقة لن يبقى من الكمية الأصلية إلا نصفها فقط. وهذا معنى قولنا أن عمر النصف 11C 20 دقيقة. ويُسَمَّى هذا الفناء التدريجي للمادة الانحلال الإشعاعي أو التحوُّل النووي. وللنظائر المختلفة أنصاف أعمار مختلفة. ويتراوح نصف العمر من كسور من الثانية إلى بلايين السنين. وفيما عدا استثناءات قليلة، فإن النظائر المشعة الموجودة في الطبيعة بكميات يُمكن ملاحظتها هي فقط تلك التي لها نصف عمر يبلغ ملايين كثيرة من السنين، أو حتى بلايين السنين. ويعتقد العلماء أنه عندما تكوَّنت عناصر الأرض، كانت كلُّ النظائر الممكنة موجودة. وفي الغالب، تحللت تلك التي لها أنصاف أعمار قصيرة بحيث لم يبق منها إلا كميات أصغر من أن تلاحظ. ولكن بعض النظائر ذات العمر القصير، الموجودة في الطبيعة، تكوَّنت نتيجة انحلال نظائر مشعة طويلة العمر. فمثلاً، ينتج الثوريوم 234، الذي له نصف عمر قصير، من اليورانيوم الذي له نصف عمر طويل. كذلك تُنتج الأشعة الكونية، الكربون 14، وهو نظير نصف عمره قصير نسبيًّا. ومن النظائر المشعة ذات العمر الطويل الموجودة على الأرض، البوتاسيوم 40، والثوريوم 232، واليورانيوم 235، واليورانيوم 238.
ويُنتج المفاعل النووي صناعيا مئات النظائر المشعة قصيرة العمر، وذلك بإطلاق نيوترونات أو جسيمات نووية سريعة على النوى. فإذا أُطلق نيوترون أو جسيم آخر على نواة ذرة، يصبح من المحتمل أن تقوم النواة بأسر ما ارتطم بها. وفي بعض الأحيان تقوم النواة بأسر جسيم فيها ثم يلي ذلك مباشرة أن تقوم النواة بطرد أحد جسيماتها.
تقانة إنتاج العناصر المشعة
يمكن توليد العناصر المشعة عن طريق قذف نوى ذرات العناصر بسيل من النترونات في مفاعل نووي، أو من نواتج عمليات الانشطار، أو باستخدام مولدات العناصر المشعة وستعرض هذه الطرائق الثلاث فيما يأتي:
التوليد بالنترونات
إن أهم التفاعلات في هذا الصدد هي التفاعلات (n, γ) و(n, α) و(n,p) التي تعطي بنتيجتها إشعاعات گاما (γ) أو جسيمات ألفا (α) أو بروتونات (p) على التوالي.[2]
يعد التفاعل (n, γ) أكثر أنواع التفاعلات استخداماً والأكثر احتمالاً للحدوث، وذلك لإمكانية إحداثه باستخدام نيوترونات بطيئة أي حرارية thermal neutrons، وهي نيوترونات يكثر وجودها في محيط المفاعلات حيث تعتبر من نواتج التشعيع. ومن العناصر المشعة التي تنتج بهذه الطريقة الكوبالت m60Co والذهب n198Au وذلك وفقاً للتفاعلين:
n59Co (n,gγ) 60Co; 197Au (n, α)198Au
يتطلب التفاعلان (n, α) و(n,p) نيوترونات ذات طاقة عالية. ويكثر مثل هذه النيوترونات في مراكز المفاعلات، ومن أمثلته اصطناع الفسفور n32P من الكبريت n32S وذلك وفقاً للتفاعل: n32S (n,p) 32P وهو تفاعل يتطلب حدوثه نيوترونات تفوق طاقتها (n1MeV) غير أنه تحدث أحياناً تفاعلات من هذا النوع باستخدام نيوترونات حرارية، ومن أمثلة هذه التفاعلات توليد التريتيوم n3H والكربون n14C وذلك وفقاً للتفاعلين: n14N (n,p) 14C وn6Li (n, α) 3H.
التوليد من نواتج الانشطار
يُحصل على العناصر المشعة هنا نتيجة المعالجات الكيمياوية للبلوتونيوم في معامل خاصة، وهكذا يستحصل على السترونسيوم n90Sr (ودوره أو عمر النصف العائد له 28 عاماً) وعلى السيزيوم n137Cs (ودوره ثلاثون عاماً).
باستخدام المولدات
كثيراً ما يحتاج الأطباء إلى عناصر مشعة ذات دور قصير نسبياً، وهم يستخدمون لهذه الغاية مولدات للنظائر المشعة radioelements generators.
يتألف مولِّد العناصر المشعة من نكليد أم mother nuclide دوره طويل نسبياً محمول على حامل يسمح بفضل بنيته الكيمياوية استخلاص نكليد بنت ذات دور قصير بسرعة وسهولة، وذلك نتيجة تفكك النكليد الأم، كما يمكن بتكرار الاستحصال الحصول على كمية كبيرة ذات نشاط إشعاعي عال . فمثلاً يمكن الحصول من ميلي كوري واحد (n1m Ci) من الجرمانيوم n68Ge خلال ثلاثة أدوار للنكليد على 860 ميلي كوري من الغاليوم n68Ga وذلك بتكرار الاستحصال لمدة عشر ساعات.
ويبين الجدول التالي عدداً من مولدات العناصر المشعة المعروفة تجارياً، في حين يبين الشكل (1) بنية مولِّد عناصر مشعة من هذا القبيل.
| الاسم | الرمز | الدور | نوع الإشعاع الصادر وطاقته Me V | الاسم | الرمز | الدور | نوع الإشعاع الصادر وطاقته Me V | |||||
| أسر K | γ | β | تحول آيزومتري | α | β | |||||||
| السزيوم | n137Cs | 30عاماً | 0.5, 1.2 | الباريوم | n137Bam(1) | 2.55 دقيقة | نعم | 0.66 | ||||
| إتريوم | 87Y | 80عاماً | 0.48 | 0.7 | السترونسيوم | 89Srm | 2.8 ساعة | نعم | 0.39 | |||
| جرمانيوم | 68Ge | 275 يوماً | نعم | الغاليوم | n68Ga | 68.3دقيقة | 1.08، 0.08 | 1.9 | ||||
| قصدير | 113Sn | 115يوماً | نعم | 0.26 | الإنديوم | 113In | 1.66ساعة | نعم | 0.39 | |||
| مولبدنم | 99Mo | 66.7ساعة | 0.74، 0.18 | 1.2 | التكنسيوم | 99Tc | 6 ساعة | نعم | 0.14 | |||
| التلّور | n137Te | 78 ساعة | 0.23، 0.50 | 0.2 | اليود | 137I | 2.4ساعة | 0.77، 0.67 | 2.1 | |||
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
مخاطر المواد المشعة
يدمِّر الإشعاع الخلايا الحية. ولذا تجب حماية الأفراد الذين يتعاملون مع المواد المشعة من الإشعاع. وتُمتص جسيمات ألفا وبيتا بشيء من السهولة، أما أشعة گاما فلها قدرة عالية على الاختراق. وتمتص العناصر ذات العدد الذريّ الكبير أشعة گاما بدرجة أفضل من تلك التي لها عدد ذري صغير.
ومن جهة ثانية يمكن استخدام الأشعة النفوذة بطريقة المعالجة الكورية نسبة إلى العالم كوري لقتل الخلايا السرطانية من دون إلحاق أي ضرر بالخلايا المجاورة لها.
أنواع الانحلال

توجد ثلاثة أنواع من الإشعاع النشط: جسيمات ألفا ، وكان بكرل أول من تعرف عليها؛ وجسيمات بيتا التي تعرف عليها النيوزيلندي إرنست رذرفورد ؛ وأشعة گاما التي تعرف عليها الزوجان الفرنسيان ماري وپيير كوري.
كان العالم فيرمي ( Enrico Fermi) في العام 1934 يقوم ببعض التجارب للحصول على نظائر العناصر عن طريق قذف النوى بالنيوترونات . وعندما وصل إلى عنصر اليورانيوم ( العنصر الأخير في الجدول الدوري في ذلك الوقت ) . توقع أن قذف العنصر بالنيوترونات سيؤدي إلى وجود نواة غير متسقرة تقوم بإطلاق جسيمات بيتا وبالتالي ازدياد العدد الذري من 92 إلى 93 وانتاج عنصر جديد في الجدول الدوري ، ولكنه لم يحصل على ما توقعه ولم يستطع التعّرف على نواتج التفاعل.
واستمرت الأبحاث والدراسات من العام 1935 إلى العام 1938 حيث قام عالم كيميائي ألماني يسمى إدا نوداك ( Ida Noddack) بالتعرف على نواتج التفاعل وأوضح أن نواة اليورانيوم انشطرت إلى نواتين متوسطتي الكتلة . وقد أكدت الدراسات صحة ما افترضه هذا العالم . وبذلك يكون الإنشطار النووي " انقسام نواة ثقيلة إلى نواتين متوسطتي الكتلة ، وانتاج كميات هائلة من الطاقة نتيجة تفاعل نووي " ولإحداث الإنشطار تقذف النواة الثقيلة مثل اليورانيم /ذري92\ كتلي235 يوارانيوم ـ 235 بجسيمات خفيفة نسبياً مثل النيوترونات التي تعد أفضل القذائف لأنها لا تحمل شحنة.[4]
جسيمات ألفا
هو جسيمات مادية ذات شحنة كهربائية موجبة تساوي ضعف شحنة الإلكترون، أي 3.2 × 10-19 كولون، وذات كتلة أكبر من كتلته وتساوي 6.2 × 10-27 كغ، وليس جسيم ألفا إلا نواة الهليوم 2He4 (بروتونان + نترونان). إن كتلة جسيم ألفا وشحنته مستقلتان عن العنصر المشع الذي يصدره، وتُراوح طاقة جسيمات ألفا التي تصدرها العناصر المشعة الشائعة الاستعمال بين (5و 10) مليون إلكترون فولط (م. إ. ف) وعدد الجسيمات التي تصدر في الثانية كبير جداً، فمثلاً يُصْدِر غرامٌ واحد من اليورانيوم 235 عدداً منها يبلغ (64) ألفاً في الثانية، ويصدر غرام من البلوتونيوم 239 عدداً يبلغ (2.3) مليار في الثانية.
أما مسارات جسيمات ألفا فهي مسارات مستقيمة وقصيرة، كما تظهرها حجرة وِلْسُن، ويرجع ذلك إلى كونها جسيمات ثقيلة، فهي لا تنحرف لدى اصطدامها بذرةٍ ما مالم تُصِبها في جوار النواة. ويتوقف هذا المسار على عدد من العوامل أهمها طاقة الجسيم أو سرعته وطبيعة المادة التي تخترقها.
وهناك صيغ تجريبية تعطي المسار «مس» في الهواء بدلالة الطاقة «طا»، منها الصيغة التالية التي تصلح في المجال مابين 8.3 مليون إِلكترون
فولط (م. إِ. ف) مس (سم) = 0.318طا3/2 (1)
حيث تقدر الطاقة طا بـ (م. إِ. ف). ويراوح طول المسار في الهواء بين 2 و10سم: (اليورانيوم 2.6سم والراديوم 3.4سم والبولونيوم 3.9سم).
ويمكن القول إن جسيمات ألفا تفقد من طاقتها 2 م. إِ. ف في كل سنتمتر من مسارها في الهواء. وهناك دساتير تمكِّن من حساب مسار جسيم ألفا في مادة عددها الذري Z فيما إذا عُرف مساره في الهواء.
وقد دلت نتائج التجارب على أن السرعات التي تصدُر بها جسيمات ألفا هي من رتبة 910 سم/ثا. وفي كثير من الحالات يتألف طيف الطاقة من خط واحد كما تدل على ذلك جسيمات ألفا في حجرة ولْسُن مثلاً، ممايدل على أن لكل جسيمات ألفا الصادرة عن هذا الصنف من العناصر السرعة نفسها. ويلاحظ في مجموعة كبيرة من العناصر إضافة إلى هذا الخط، وجود خطوط أخرى في جواره، ويوصف إشعاع ألفا في هذه الحالة بأنه ذو بنية دقيقة وأن طيفه خطي حاد.
ولما كانت الطاقة طا ترتبط مع السرعة سر بالعلاقة فإنه
ينتج من هذا أن المسار مس يتناسب مع مكعب السرعة وفقاً للعلاقة (1) التي تكتب عندئذ كما يلي:
مس (سم) = 9.76 × 10-28سر3.
حيث تقدر السرعة سر بـ سم/ثا.
وعلى هذا يكون المسار نحو سنتمترين من أجل سرعة مقدارها (13) ألف كم/ثا، ويصبح ثلاثة أضعاف ذلك من أجل السرعة (20) ألف كم/ثا.
أما مايتصل بنفوذ جسيمات ألفا فقد تبين أنه ضعيف، وقد اصطُلح على أن يقدَّر تأثير وسطٍ ما، من حيث تبطئته الجسيمات التي تجتازه، بثخن طبقة الهواء التي لها التأثير نفسه والتي تعرف بالمدى range.
جسيمات بيتا
إن شحنة جسيم بيتا وكتلته لا تختلفان عن شحنة الإلكترون وكتلته.
الشحنة e=
1.6 × 10-19 كولون
الكتلة ك = 9.11 × 10-31 كغ
وجسيمات بيتا المشحونة سلباً(-β) ماهي إلا نيغاتونات، أي إلكترونات عادية كالأشعة المهبطية cathode rays. أما جسيمات بيتا المشحونة إيجاباً (+β) فليست سوى بوزِِتْرونات، أي إلكترونات موجبة. وتصدر أشعة بيتا +β عن النواة. ولما كانت الإلكترونات لا تنشأ من داخل النواة، فإن إصدار الإلكترونات هنا يتم خارج النواة نتيجة تحولٍ يقع في داخلها.
ويمكن فحص مسارات بيتا في حجرة ولْسُن، إلا أنه يوجد فارق أساسي بين جسيمات ألفا وبيتا يعود إلى أنه في إصدار جسيمات بيتا لا تكون الجسيمات ذات طاقة واحدة تقريباً كما هو الحال في إصدار ألفا، بل يكون لها مجموعة طاقات يعبَّر عنها بالقول إن لها طيف طاقة. ويوجد نمطان متميِّزان ظاهرياً لأطياف أشعة بيتا: أحدهما طيف خطي حاد، والآخر طيف مستمر. وقد تبين بما لا يقبل الشك أن الأطياف الخطية الحادة تعود إلى إلكترونات كانت قد طرحتها طبقات الذرة المختلفة بفعل إشعاعات گاما الصادرة عن نواة الذرة نفسها أو الذرات المجاورة. أما طيف أشعة بيتا المستمر فهو الذي تولده الإلكترونات التي كانت قد طرحتها نوى الذرات المشعة.
ويختلف طيف إشعاعات بيتا لعنصر ما اختلافاً بيِّناً عن معظم الأطياف الأخرى المميزة للعنصر نفسه من حيث أن هذه الأطياف المميزة هي أطياف خطية، سواءً أكانت ضوئية أم أشعة سينية أم أشعة ألفا أم أشعة گاما، في حين يكون طيف أشعة بيتا طيفاً مستمراً.
إن طاقة جسيمات بيتا التي تصدرها العناصر المشعة المستعملة تبلغ نحو 5 مليون إلكترون فولط عادة. وتتمتع جسيمات بيتا بسرعة عالية، إذ تصل سرعة الإشعاعات السريعة منها، والناتجة عن الثوريوم Th، إلى ما يقارب 0.999 من سرعة الضوء. وعلى الرغم من هذه السرعة العالية فإن كتلتها الخفيفة بالمقارنة بكتلة جسيم ألفا (كتلة جسيم بيتا أخف من كتلة جسيم ألفا بنحو 8000 مرة) تجعل مساراتها غير منتظمة إذ تنحرف عن مسارها في كل مرة تصطدم بذرة غاز، كما أن معظم الصدمات تحدث بالقرب من النوى.
وتتعين طاقات جسيمات أشعة بيتا الصادرة عن النظائر المشعة وسرعاتها بطرائق كثيرة، منها مثلاً قياس أنصاف أقطار تقوس مساراتها في حقل مغنطيسي معلوم الشدة.
ويمكن التحقق من أن المدى يساوي 0.8 من المسار على وجه التقريب. وتوجد صيغ تعطي المسارات بدلالة الكتلة السطحية كس (غ/سم2) (وهي كتلة واحدة السطوح من المادة ثخنها يساوي المسار (مس) وبدلالة الكتلة النوعية φ(غ/سم3) والطاقة طا، منها الصيغة التالية:
ك س(غ/سم2) = φ مس = 0.530 طا -0.106
إن الطاقة التي تظهر في هذه العلاقة هي الطاقة العظمى لجسيمات بيتا التي تُراوح قيمها بين 2.5 و20 مليون إلكترون فولط.
إن طول مسار إلكترون طاقته (80) كيلو (إ.ف) في الهواء يساوي 8سم، أي يساوي تقريباً طول مسار جسيم ألفا طاقته 8 ملايين (م.إ.ف)، وهذا يدل على أن طاقة جسيم بيتا (الإلكترون) أشد بمئة ضعف من طاقة جسيم ألفا.
إن جسيمات بيتا أكثر نفوذاً من جسيمات ألفا. ويعود ذلك لسرعتها الكبيرة التي تصل حتى 250000 كم/ثا. وتقطع أشعة بيتا نحو 10 أمتار في الهواء إذا كانت طاقتها 3 ملايين (م.أ.ف)، أما أشعة بيتا الناتجة من الانشطار في الانفجارات النووية فطاقاتها لاتتجاوز 2 مليون (م.أ. ف)، ولا تتجاوز مساراتها 8 أمتار في الهواء، وبضع سنتمرات في الماء و0.1 سم في الرصاص.
أشعة گاما
إن الجسيمات التي تكوّن إشعاعات گاما ما هي إلا الفوتونات التي ليس لها شحنة أو كتلة، فهي لذلك لا تنحرف في الحقول الكهربائية أو المغنطيسية، وهي من طبيعة الأشعة السينية لكنها تصدر عن النواة في حين تصدر الأشعة السينية عن البنية الخارجية من نواة الذرة، كما أن لها أطوالاً موجية أقصر وطاقات أكبر من مثيلاتها في الأشعة السينية. وتُراوح أطوالها الموجية بين 5 × 10-3 و 5 × 10-1 أنغستروم (أنغستروم = 10-10 متر).
تصدر أشعة گاما عن نوى الذرات المشعة في عملية التفكك dissociation مصاحبة أشعة ألفا أو أشعة بيتا في أغلب الأحيان. فعندما تتحول ذرةٌ مصدرةً جسيم ألفا أو جسيم بيتا، فقد تبقى النواة الناتجة في حالةٍ مثارةٍ تؤدي بها إلى إصدار أشعة گاما لدى عودتها إلى حالات مثارة أدنى أو إلى الحالة الدنيا.
إن طاقة الإشعاع الكهرمغنطيسي تساوي الجداء h × تو، حيث تو: تواتر (تردد) الإشعاع وh: ثابت بلانك Planck، وقيمته 625،6 × 10-34 جول. ثانية وتُراوح طاقة الفوتونات في الحالة العامة بين بضعة آلاف إلكترون فولط وبضع مئات الملايين إلكترون فولط. ولا تظهر حجرة ولْسُن آثار أشعة گاما فيها لأنها معدومة الشحنة.
وتعد أشعة گاما أكثر الإشعاعات التي تصدرها المواد المشعة نفوذاً، فهي تنتقل بسرعة الضوء، لذلك كانت مساراتها مستقيمة وطويلة جداً. فيمكن لأشعة گاما أن تجتاز مئات الأمتار في الماء وعدة سنتمترات في الرصاص، وتنخفض شدة أكثرها نفوذاً إلى النصف لدى اختراقها صفيحة من الرصاص ثخنها 1.4سم.
ويمكن التفريق بين إشعاعات ألفا وبيتا وگاما من حيث مقدرة كل منها على النفوذ. فورقة كتابة عادية تكفي لامتصاص إشعاع ألفا، وتكفي وريقة من الألمنيوم لامتصاص إشعاع بيتا، أما أشعة گاما فلا تُمتص امتصاصاً كاملاً بأي منهما.
الخواص المشتركة للإشعاعات النووية الناشطة الثلاثة
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
تألق الإشعاعات بعض الأجسام
فبعض السوائل النقية تتألق عندما تخترقها أشعة گاما. ويكون لون التألق luminescence مائلاً إلى الزرقة ويمتد بعض المسافة في سوائل. ويختلف هذا التألق أساساً عن التفلور fluorescence الذي ينشأ عن تبادل الطاقة بين ذرات المادة.
وقد بين العالم الفيزيائي الروسي تشرنكوڤ Tcherenkov أن هذا التألق لا تولده أشعة گاما مباشرة بل تولده الإلكترونات التي تتحرك بسرعة أكبر من السرعة الطورية phase velocity لانتشار الضوء في ذلك السائل. وتعرف هذه الظاهرة بأثر تشرنكوڤ. وهي تحدث عندما يتحرك جسيم مشحون بسرعة تزيد على السرعة الطورية لانتشار الضوء في العازل. وهي تشبه ظاهرة أمواج الصدم الصوتية ولكنها هنا تولِّد تألقاً في السائل.
ويمكن مشاهدة هذه الظاهرة بوضع طبقة رقيقة من أحد أملاح الراديوم على كبريت الزنك فُيرى باستعمال مكبِّرة مناسبة تألقات يسببها اصطدام جسيمات ألفا بكبريت الزنك. وكانت هذه الطريقة البدائية هي الطريقة التي انطلق منها الباحثون لإجراء تجاربهم في النشاط الإشعاعي.
الإشعاعات تؤيِّن الذرات وتثيرها وتفكِّكها
ففي حالة التأين بإشعاعات ألفا وبيتا يعود الأمر أساساً إلى تأين مباشر يعقبه تأين ثانوي مهم جداً، لأن 40 في المئة من حوادث التأين بإشعاعات ألفا هي من التأين المباشر. ويتطلب إنتاج زوجين من الأيونات في الهواء طاقة تقدر بنحو 32.5 (إ. ف). ويكون التأين بإشعاعات ألفا أشد في نهاية المسارات لأنها تصبح أبطأ، لذلك فإن كثافة مسارات جسيمات ألفا تزداد عند نهايتها.
وينتج إلكترون طاقته تساوي 3 ملايين (م.إ.ف) نحو 25 زوجاً من الأيونات في السنتمتر الواحد في الهواء، في حين أن جسيم ألفا ذا الطاقة ذاتها ينتج 35000 زوج من الأيونات في السنتمتر الواحد من الهواء.
ويمكن لإشعاعات بيتا أن تولد تأيناً ثانوياً مهماً قد يصل إلى نحو 70 في المئة من مجموع التأينات، ويؤدي تباطؤ الجسيمات إلى إصدار إشعاع كهرمغنطيسي يدعى إشعاع الكبح brake radiation أو bremsstrahlung الذي ينبغي أخذه بالحسبان. وأخيراً، وفي حالة أشعة گاما فإن مايحدث هو التأين غير المباشر فقط.
ويمكن للفوتونات الساقطة على المادة أن تؤثر وفق ثلاث آليات مختلفة إذ يتعلق احتمال حدوث كل آلية منها بطاقة الفوتونات وبالعدد الذري Z للمادة التي تجتازها.
أما الآلية الأولى فهي الأثر الكهرضوئي photoelectricity إذ تكون طاقة الفوتونات ضعيفة وقيمة Z مرتفعة. وبموجب هذا الأثر يتخلى الفوتون عن كل طاقته إلى الإلكترون المقذوف من المادة ثم يختفي تماماً.
وأما الآلية الثانية فهي تأثير كومپتون Compton، إذ يكون للفوتونات طاقة متوسطة وتكون Z ذات قيمة منخفضة. وفي هذه الآلية لا يفقد الفوتون المرتد على الإلكترون سوى جزء من طاقته الابتدائية، ويكتسب الإلكترون المقتلَع طاقة حركية بالفرق في الطاقة.
وأما الآلية الثالثة فهي إنتاج الزوجين pair production، وهي عملية يتطلب حدوثها فوتوناً ذا طاقة عالية (لا تقل عن مليون (إ. ف) تقريباً)، كما تكون قيمة Z عالية، ويفنى الفوتون في هذه العملية وتستخدم طاقته لتوليد إلكترونين أو إلكترون سالب وإلكترون موجب (جسيم جديد موجب الشحنة) هو البوزِترون.
وفي هذه الحالات الثلاث، يكون الإلكترون المقذوف مع زوج الأيونين الناتج هو المسؤول عن التأين وليس الفوتون الوارد المعتدل؛ وهذا مايعنيه بالضبط التأين غير المباشر.
تولِّد الإشعاعات آثاراً كيمياوية مختلفة إذ يؤثر الإشعاع النووي الناشط في ألواح التصوير كما تفعل الأشعة السينية. فهو يحلل الماء ويلون باللون البنفسجي أو البني بعض المواد كالزجاج والكوارتز والمينا.
يرافق إصدار الإشعاع النووي الناشط تحرر طاقة
فإذا وضع جسم صلب مشع داخل أنبوب من الرصاص، فإن الأنبوب يمتص الإشعاع ويظهر كامل الطاقة بشكل حرارة. يطلق غرام واحد من الراديوم 135 حريرة في الساعة الواحدة، يعود 120 حريرة منها إلى جسيمات ألفا و9 حريرات إلى جسيمات بيتا و6 حريرات إلى جسيمات گاما.
إن مشكلة تحرير الطاقة هذه هي إحدى الصعوبات التي تعوق مشكلة التخلص من النفايات المشعة المتبقية من عمل المفاعلات النووية.
أنماط الانحلال في صيغة جدول
| نمط التحلل | الجسيمات المشاركة | النواة الإبنة |
|---|---|---|
| تحللات مصحوبة بانبعاث نيوكليونات: | ||
| Alpha decay | An alpha particle (A=4, Z=2) emitted from nucleus | (A–4, Z–2) |
| Proton emission | A proton ejected from nucleus | (A–1, Z–1) |
| Neutron emission | A neutron ejected from nucleus | (A–1, Z) |
| Double proton emission | Two protons ejected from nucleus simultaneously | (A–2, Z–2) |
| Spontaneous fission | Nucleus disintegrates into two or more smaller nuclei and other particles | - |
| Cluster decay | Nucleus emits a specific type of smaller nucleus (A1, Z1) smaller than, or larger than, an alpha particle | (A–A1, Z–Z1) + (A1,Z1) |
| Different modes of beta decay: | ||
| Beta-Negative decay | A nucleus emits an electron and an antineutrino | (A, Z+1) |
| Positron emission, also Beta-Positive decay | A nucleus emits a positron and a neutrino | (A, Z–1) |
| Electron capture | A nucleus captures an orbiting electron and emits a neutrino - The daughter nucleus is left in an excited and unstable state | (A, Z–1) |
| Double beta decay | A nucleus emits two electrons and two antineutrinos | (A, Z+2) |
| Double electron capture | A nucleus absorbs two orbital electrons and emits two neutrinos - The daughter nucleus is left in an excited and unstable state | (A, Z–2) |
| Electron capture with positron emission | A nucleus absorbs one orbital electron, emits one positron and two neutrinos | (A, Z–2) |
| Double positron emission | A nucleus emits two positrons and two neutrinos | (A, Z–2) |
| Transitions between states of the same nucleus: | ||
| Isomeric transition | Excited nucleus releases a high-energy photon (gamma ray) | (A, Z) |
| Internal conversion | Excited nucleus transfers energy to an orbital electron and it is ejected from the atom | (A, Z) |
الانحلال الاشعاعي
عملية تلقائية يتحول فيها العنصر إلى عنصر اخر نتيجة فقد جسيمات الفا أو جسيمات بيتا وانطلاق أشعة گاما.
الفرق بين الانحلال الاشعاعي والتحول الكيميائي
يختلف الانحلال الاشعاعي عن التحول الكيميائي في
- الانحلال الاشعاعي عملية تلقائية مستمرة
- يعتمد على العنصر المشع ولا يرتبط بالمركب الكيميائي
- لا يتوقف على الظروف الفيزيائية ( الضغط ، درجة الحرارة )
- تنطلق منه طاقة هائلة
وحدة قياس النشاطية الاشعاعية
تقاس النشاطية الاشعاعية بوحدة بكرل. البكرل هو عدد الاشعاعات التي تصدرها العينة المشعة في الثانية ما معنى أن النشاطية الاشعاعية لعينة واحد بكريل ؟ المعنى : نشاطية العينة تصدر اشعاعا واحدا في الثانية. هل هناك وحدات أخرى لقياس النشاطية الاشعاعية ؟ نعم توجد وحدة انحلال / ثانية ووحدة الكوري Ci وفي بعض المراجع Cu وأيضا توجد وحدة ثالثة هي الرذرفورد Rd وهو نشاط يناظر مليون انحلال / ثانية
الكوري
الكوري هو نشاط عينة تنحل فيها في الثانية الواحدة 3.7x1010 من الأنوية المشعة.
تصنيف العناصر المشعة
تصنف العناصر المشعة وفق ثلاثة أصناف وذلك بحسب سمِّيتها الإشعاعية ومن أهمها:
ـ الفئة I: درجة سمّيتها الإشعاعية عالية جداً و من أمثلتها: n226Ra, 241Am
ـ الفئة II-A: درجة سمّيتها الإشعاعية عالية ومن أمثلتها:
n170Tm,204 T1, 90Sr, 192Ir ,131I, 137Cs, 60Co
ـ الفئة II-B: درجة سميتها الإشعاعية معتدلة ومن أمثلتها:
n171Tm, 35S, 147Pm, 32P
ـ الفئة III: وهي ذات سمية إشعاعية ضعيفة ومن أمثلتها:
n238U, 235U, 85Kr
ولتجنب التلوث تزوَّد المنابع المشعة في حاويات مغلقة تتحمل درجات حرارة مرتفعة تصل إلى 1000 ْس مدة 200 ساعة، كما تتحمل ضغطاً يصل إلى 700 بار وثقلاً يصل إلى 10000 نيوتن.
ويقدر النشاط الإشعاعي لعنصر مشع بالكوري و رمزه Ci أو ما يقابله بالكتلة.
إذ يعادل (n1Ci) من الـ n226Ra جراماً واحداً.
ويعادل (n1Ci) من الـ n90Sr م4.6 مليجرام.
ويعادل (n1Ci) من الـn32P م5.3 ميكروجرام.
وبصورة عامة تعطى الكتلة m لعنصر مشع، دوره T مقدراً بالأعوام بدلالة العدد الكتلي A بالعلاقة:
يشار هنا إلى أن الخطر الذي يرافق استخدام العناصر المشعة تابع لدوره ولطاقه الإشعاعات الصادرة عنه. فالكوبالت n60Co على سبيل المثال دوره (5.3 عاماً) ويصدر إشعاعات طاقتها تساوي n0.3MeV ونوعين من إشعاعات طاقتاهما n1.33MeV وn1.17MeV.
أهمية العناصر المشعة
تستخدم الصناعة العناصر المشعة لأغراض عدة، ولهذه العناصر تطبيقات في ميادين الطب والزراعة وفي تقدير أعمار الآثار. وبالإمكان استخدامها لإجراء قياسات هندسية وميكانيكية. وقد استخدمت العناصر المشعة كمقتفيات لسير التفاعلات الكيمياوية؛ إذ يمكن استخدامها للكشف عن تطور تفاعل كيمياوي أو تحوّل فيزيائي والكشف عن آليته. وتُعرض فيما يلي هذه الاستخدامات وفق القطَّاع الذي تستخدم فيه:
التطبيقات الصناعية
من هذه التطبيقات قياس السماكات، وقياس سويات السوائل، واستخدام أشعة گاما لأغراض التصوير، وتمثل هذه التطبيقات ما يقارب 75% من التطبيقات الصناعية، وفيما يأتي تفصيل ذلك:
- قياس السماكات: تستخدم هنا طريقتان؛ مباشرة وغير مباشرة. ففي الطريقة المباشرة يستخدم منبع S تصدر عنه إشعاعات ما، ويوضع أمامه كاشف D. فإذا سجل الكاشف قراءة I0، ثم وُضِع بينهما حاجز سميك، فإن بعض الإشعاعات يتم امتصاصه ضمن الحاجز، ويسجل الكاشف قراءة I أخفض من I0. إن الفرق I - I0 يسمح بقياس سماكة الحاجز بين المنبع S والكاشف D. أما الطريقة غير المباشرة فيوضع فيها المنبع والكاشف في جهة واحدة كما في الشكل (2) أمام الحاجز، ويقيس الكاشف عندها الإشعاعات المرتدة.
يشار هنا إلى أن إشعاعات γ هي أكثر الإشعاعات نفوذاً في المادة. ولذا فهي تستخدم لقياس السماكات الكبيرة التي تقدر في مجال الفيزياء النووية بواحدة الكتلة لوحدة المساحة أي kg/m2 وهي تمثل جداء كثافة المادة بسماكتها. وإذا قدرت السماكة بالسنتمتر والكثافة بالغرام على السنتمتر المكعب فإن الكثافة السطحية تكون بواحدة g/cm2. ويمكن باستخدام الكوبلت n60Co أو السيزيوم n137Cs أوالتاليوم n170Tm قياس سماكات من الفولاذ تصل إلى n6cm بتقريب جيد. ويأخذ الكاشف عندها شكل عداد وميض يتصل بمضاعف ضوئي photomultiplier، كما يمكن باستخدام جهاز قياس مناسب تحرّي التآكل داخل الأنابيب حتى أثناء عملها.
إن المقاييس التي تستخدم إشعاعات β كثيرة التنوع وهي تفوق عدداً الكواشف المستخدمة لإشعاعات γ. وهنا يتم عادة استخدام مواد مشعة ذات دور طويل تجنباً للأخطاء. ومن الاستخدامات الصناعية في هذا المجال قياس سماكة الورق والمواد البلاستيكية والمعادن الرقيقة. ولا تقتصر أهمية العدادات هنا على قياس السماكات وإنما تتعداها إلى أمور التحكُّم. يضم النظام في هذه الحالة إضافة إلى المنبع حجرة تأين يتصل بها مقياس كهربية ومضخم ومقياس ميكرو أمبير يستخدم كمؤشر للسماكة. وتستخدم طريقة الانتثار المرتد لإشعاعات لقياس سماكة الدهان أو الأغشية الرقيقة المرسَّبة على السطوح المعدنية.
أما إشعاعات α فهي أقل الإشعاعات نفوذاً في المادة ، ولذا فهي تستخدم لقياس سماكات من رتبة n5mg/cm2 كالورق الرقيق جداً. وغالباً ما يستخدم هنا منبع الراديوم. أما العداد المناسب لمثل هذه الأغراض فهو عداد غايغر ـ مولر Geiger-Müller أو عداد الوميض.
يبين الجدول التالي أشهر المنابع المستخدمة لقياس السماكات من النوعين γ أو β:
المنابع γ الرئيسية المستخدمة لقياس السماكات المنبع الدور طاقة الإشعاع الوسطية MeV الكوبالت n60Co 5.3عاماً n1.33-1.17 السيزيوم n137Cs 30عاماً n0.66 الثاليوم n170Tm 127يوماً n0.08
المنابع β الرئيسية المستخدمة لقياس السماكات المنبع الدور الطاقة العظمى MeV الثاليوم n204TI 2.7عاماً n0.77 الكريبتون n85Kr 10.6عاماً n0.66 السترزنسيوم n90Sr 28عاماً n0.54 البروميثيوم n147Pr 26عاماً n0.22
الجدول (2) المنابع الرئيسي المستخدمة لقياس السماكات
- قياس مستويات السوائل: يمكن استخدام عنصر مشع يصدر إشعاعات γ مثلاً لقياس سوية السائل في وعاء محكم الإغلاق كتيم، وهنا يمكن اللجوء إلى عدة طرق هي:
(أ) تَحمل عوَّامةٌ المنبعَ داخل الوعاء، ويعلو الكاشف بدوره العوامة ويعاير الجهاز بحيث يقابل كل تسجيل للكاشف ارتفاعاً للسائل في الوعاء.
(ب) يمكن كذلك وضع المنبع في قعر الوعاء وقياس الإشعاع الذي يصل إلى الكاشف لدى اجتيازه سماكة السائل و الهواء فوقه، وبرسم منحني معايرة يمكن استنتاج ارتفاع السائل في الوعاء.
(ج) يمكن وضع منبع إشعاعات γ والكاشف جنباً إلى جنب وبالتالي قياس ارتفاع السائل في الوعاء عن طريق الإشعاعات المرتدة عن سطحه.
- التصوير بإشعاعات گاما:
تعدُّ طريقة التصوير بإشعاعات گاما سهلة واقتصادية، إلا أنه ينبغي تطبيق تعليمات وقاية صارمة من خطر الإشعاعات عند مزاولة عملية التصوير. ويتضمن الجدول التالي عدداً من العناصر المشعة المستخدمة لأغراض التصوير الشعاعي:
المنبع طاقة الإشعاع الوسطية MeV الدور مجال الاستخدام (السماكة بالسنتمتر) الجرعة لكل كوري على بعد متر بواحدة (R/h) الكوبالت 60 n60Co n1.33-1.17 5.3عاماً 5 حتى 12 (فولاذ) n1.35 السيزيوم 137 n137Cs n0.66 30عاماً 2حتى 7 (فولاذ) n0.35 الإيريديوم 192 n192Ir n0.3-0.6 74عاماً 0.5 حتى 4 (فولاذ) n0.5 الثاليوم n170Tm n0.08 127يوماً 0حتى 6 (ألمنيوم) n0.04
الجدول (3): العناصر المشعة بإصدار γ المستخدمة لأغراض التصوير الشعاعي
استخدام العناصر المشعة مقتفيات
تستخدم هنا لأغراض التعدين عناصر مشعة مثل الكربون n14C والكبريت n32S والكلور n36Cl والحديد n55Fe والحديد n59Fe. وهكذا يدرس اهتراء السِّوار الحابس segments للزيت في المكابس والدواليب والجدران الاستنادية في الأفران باستخدام الكوبلت n60Co، كما يدرس تسرب السوائل في الأقنية باستخدام الصوديوم n24Na والبروم n82Br واليود n131I. وفي مجال الصناعات النفطية تستخدم ذات العناصر المشعة للتعرف على نوعية المواد المارة في الأنابيب. أما دراسات التهوية فتستخدم الأرغون n141A والزينون n135Xe.
التطبيقات الطبية للعناصر المشعة
تستخدم العناصر المشعة في الطب النووي nuclear medicine في جميع أنحاء العالم. وتُستخدم إشعاعات بيتا و/أو گاما في نحو مئة عنصر مشع في تشخيص وعلاج أمراض كثيرة. وقد اكتشف عدد كبير من هذه العناصر منذ الربع الثاني من القرن العشرين، وكان أهمها اليود n131I (1938) والكوبلتn60Co (1937) والتكنسيوم n99mTc (1938) والسيزيوم n137Cs (1941)، وتلا ذلك اكتشاف عناصر كثيرة أخرى.
يستعمل اليود n131I، ونصف عمره 8 أيام، في تشخيص ومعالجة بعض أمراض الغدد الدرقية بنجاح كبير، وقد يُغني ذلك في بعض الحالات عن التدخل الجراحي. ويحتل التكنسيوم n99mTc، ونصف عمره 6 ساعات، المكانة الأولى في الطب النووي. فمثلاً يُقدر أنه يستعمل في أكثر من 10 ملايين حالة تشخيصية في الولايات المتحدة الأمريكية كل عام. ويُستخدم في دراسات الدماغ والعظام والكبد والطحال والكلية والرئة والغدة الدرقية وغيرها.
تستعمل أشعة گاما التي يطلقها الكوبلت n60Co لقتل الخلايا السرطانية، وقد تبين أن السيزيوم n137Cs يمتلك تطبيقات مهمة في الطب النووي كمصدر لأشعة گاما، وهي مماثلة في استخداماتها لتلك الخاصة بالكوبلت n60Co. وقد اكتسبت معالجة السرطان بحُزم من الأيونات المنتجة من أجهزة خاصة تدعى المسرِّعات الخطِّية linear accelerators انتشاراً واسعاً في العقد الماضي. وعلى عكس أشعة گاما التي توزع طاقتها على كل من الخلايا السليمة والخلايا السرطانية، فإن معظم طاقة الجزيئات ستتركز في الخلايا السرطانية، وليس في الأنسجة السليمة المحيطة بالأورام.
تُستخدم العناصر المشعة أيضاً في تقدير نسبة الهرمونات (هرمون النمو والهرمون المنشط للغدة الدرقية والهرمونان المنشطان للجنس gonadotrophins وهرمونات الدرقية والهرمونات الجنسية وغيرها) في الدم. كما تستخدم في حالات المسح الإشعاعي لأعضاء كثيرة في جسم الإنسان، فمثلاً يستخدم المسح الشعاعي للكبد liver scan لتحديد حجمه وشكله وموضعه، وتحديد أورام البطن ومعرفة ما إذا كانت في الكبد أو خارجه، واكتشاف نوع وسبب تضخم الكبد مثل حالات خراجات الكبد وأورامه وأكياسه أو أي تجمع دموي فيه، وتحديد مكان أي ورم فيه، والمقارنة بين حالته قبل العلاج وبعده، وكذلك معرفة وتحديد أمراض الكبد المزمنة مثل تليّف الكبد والتهابه.
وتستخدم العناصر المشعة في علاج بعض الأورام الخبيثة ومن أمثلتها ما يأتي:
ـ الكوبلت وهو من العناصر المشعة المستخدمة منذ وقت بعيد في علاج بعض الأورام السرطانية مثل سرطان الحنجرة وسرطان المثانة البولية وسرطان المخ والعظام وسرطان الرحم.
ـ السيزيوم المش الذي يستخدم في علاج سرطان الثدي ومرض هودجكن.
ـ الراديوم المشع ويستخدم على هيئة بذور أو إبر تزرع في مكان المرض في حالات مثل سرطان اللثة وسرطان عنق الرحم.
ـ الذهب المشع ويستخدم في حالات سرطان وأورام الغدة النخامية.
ـ اليود المشع وهو نظير مشع يستعمل بكثرة في تشخيص أمراض الغدة الدرقية وأيضاً في علاج بعض منها.
ومن جهة أخرى تستخدم بعض العناصر المشعة لتخفيف الآلام، فمثلاً يستخدم السترونسيوم n89Sr لتخفيف آلام العظام الناجمة عن السرطان.
التطبيقات الزراعية للعناصر المشعة
بدأ استخدام العناصر المشعة عقب إنتاجها اصطناعياً في المفاعلات النووية والمسرّعات عام 1946، ومنذ ذلك التاريخ استخدمت في التطبيقات الزراعية على نطاق واسع، فأسهمت في الكشف عن غوامض كثيرة من الوظائف الفيزيولوجية للنباتات، وفي تغيير منحى التفكير والاتجاه العلمي فيها، وخير مثال على ذلك هو تفسير ماهية التركيب الضوئي أو التمثيل الضوئي ـ اليخضوري باستخدام الكربون المشع n14C والعديد من النظريات الخاصة بعمليات الاستقلاب في النباتات وتغذيتها. وقد أمكن بفضل العناصر المشعة دراسة إمكانية التغذية النباتية بوساطة الأوراق أو المجموعة الخضرية، وزراعة النسج النباتية باستخدام عناصر مشعة مختلفة، مما ساعد على تلافي عوز النباتات بالعناصر المغذية المهمة. كما أمكن تحديد أنسب الأوقات لرش الأسمدة الورقية، واستخدمت في تحديد درجة نفاذية عناصر معينة أو مواد مكتشفة لمعالجة أعراض مرضية غذائية في النبات، وذلك بإدخالها عبر النسج الورقية وخاصة مركبات العناصر الصغرى الدينامية مثل الحديد والمنغنيز والمغنزيوم والنحاس والزنك وغيرها وفي تحديد التمركز الغذائي للعناصر المغذية في الأشجار.
وأسهمت هذه العناصر في تقدير مدى إفادة النبات من الميزان المعدني الغذائي المضاف إلى التربة ومقدار العنصر الذي أخذه النبات من التربة، إذ أن المهم هو معرفة استفادة النبات من عناصر التربة الأخرى المضافة على شكل سماد. وأمكن أيضاً تحديد نوع المركب الفسفوري اللازم في تسميد التربة، وأفضل موعد لاستعماله في أثناء مراحل نمو وتطور النباتات الحولية والمعمرة وذلك باستخدام الفسفور المشع n32P، وأدت هذه البحوث إلى حقائق علمية مهمة وأهمها:
ـ تحديد احتياج النباتات من المخصبات الفسفورية المختلفة بحسب نوع النبات ونوع التربة ومرحلة النمو والتطور.
ـ تحديد أنسب الطرائق لوضع السماد في التربة وعمقه، وعمق الحراثة، وكميات مياه الري، وتحديد سرعة النمو الجذري بحسب عمر الأشجار.
ـ أمكن أيضاً قياس سرعة حركة الماء في أجزاء النبات وقدرت بنحو 14م في الساعة في بعض الأشجار العالية وسرعة انتقال المواد المغذية من الجذور إلى الأوراق وقدرت بنحو 2-3م/سا. إضافة إلى تحديد مسالك المواد الغذائية بين الأنسجة باستخدام النظير المشع n42K وتبين أن عنصر البوتاسيوم ينتقل في الخشب من الجذور إلى الأوراق إلى جانب انتقاله الجانبي من الخشب إلى اللحاء.
ـ كما كان الفضل الكبير للعناصر المشعة في بيان تأثير المطر على إزاحة مقدار كبير لبعض العناصر مثل البوتاسيوم من الأوراق وأن غسل العناصر يتم من سطوح الأوراق الهرمة أكثر من الأوراق الفتية وهي حقائق مهمة لا بد من مراعاتها عند استخدام المطر الاصطناعي أو الري بالرذاذ، وعند تهيئة العينات للتحليل.
ـ كما أوضحت طريقة اقتفاء الأثر العنصري ضرورة إجراء تسميد جيد في المناطق الغزيرة الأمطار بالعناصر المعدنية K وثم Mn وNa بالدرجة الأولى وCa وMg وS بالدرجة الثانية.
ـ استعملت هذه العناصر أيضاً في مجال تعقيم ذكور الحشرات، وفي مقاومة الآفات الضارة بالمحاصيل.
ـ كما أمكن باستخدام طريقة الاقتفاء للعناصر المشعة من تحديد محاور الدراسات العالمية للإشعاعات النووية الطبيعية التي تدور حولها المؤتمرات العالمية وأهمها:
ـ التناثر الحيوي المشع والإسقاطات النووية المشعة في البيئة.
ـ تحديد منشأ النشاط الإشعاعي وانتقاله في الترب والنباتات والأوساط المائية، وتسربه إلى المنتجات النباتية والحيوانية وأغذية الاستهلاك.
ـ تحديد مستويات التدخل التقني الحديث لتحقيق الأمن الشعاعي.
ـ تحويل العناصر الشعاعية الطويلة الحياة عبر القنوات الخاصة داخل السلسلة الغذائية لتحديد ما ينتج منها فعلياً من أمراض وكوارث وغيرها ومن هذه العناصر المشعة: n140Ba, 90Sr, 134Cs, 137Cs, 132 I, 131I وغيرها.
ـ تحري التسربات الإشعاعية في المواد الغذائية النباتية والحيوانية والبيئية عموماً.
استخدمت العناصر المشعة أيضاً في مجال تربية النبات بإحداث الطفرات الوراثية مما أدى إلى الحصول على سلالات جديدة وفيرة الإنتاج وجيدة النوعية ومقاومة للأمراض.
وخلاصة القول إن استخدام العناصر النووية المشعة يمكنه أن يؤدي دوراً مهماً في أبحاث المستقبل وأن يؤمل منه الكثير من النتائج المهمة في مجال التطبيقات الزراعية المختلفة وتغذية النباتات وتربيتها وإنتاجها وزراعة النسج وغيرها. وصار من المؤكد أن لاستخدامها آفاقاً مستقبلية باهرة وكبيرة في المجالات الزراعية ويمكن الاعتماد عليها في حل الكثير من المشكلات المعقدة في العلم والتكنولوجيا في بلدان العالم أجمع.
تطبيقات أخرى
تستخدم العناصر المشعة مثل السترونيوم n90Sr والتلور n204Te والبوتونيوم n210Po لانتزاع الشحنات الكهربائية الساكنة التي يحملها النسيج أثناء التصنيع بفعل الاحتكاك.كما يمكن استخدام خاصة التفلور للإشعاعات، فتضاف بضع كميات من أملاح الراديوم n226Ra أو التريتيوم n3H أو الكربون n14C أو الكريبتون n85Kr وغيرها إلى الدهانات فتبدو لمّاعة.
طالع أيضاً
الهامش
- ^ الموسوعة المعرفية الشاملة
- ^ أحمد حصري، أسامة العوا، هشام قطنا. "العناصر المشعة". الموسوعة العربية. Retrieved 2011-11-03.
- ^ This symbol is included in ISO 21482:2007. ISO International Standards are protected by copyright and may be purchased from ISO or its members (please visit www.iso.org for more information). ISO has not reviewed the accuracy or veracity of this information.
- ^ محمد قعقع. "الإشعاع النووي الناشط". الموسوعة العربية. Retrieved 2012-04-01.
المصادر
- "Radioactivity", Encyclopædia Britannica. 2006. Encyclopædia Britannica Online. 18 Dec. 2006
- Radio-activity by Ernest Rutherford Phd, Encyclopedia Brit. 11th Edit. 1911
المراجع
- هشام قطنا، ثمار الفاكهة إنتاجها، تداولها، تخزينها، (منشورات جامعة دمشق 1978).
- هشام قطنا، وآخرون، الأمراض الفيزيولوجية والبيئية البنائية (منشورات جامعة دمشق 1995 الجزء النظري وعام 2000 الجزء العملي).
- PAUL MAZLIAK, Physiologie végétale - Nutrition et métabolisme (Harman - collection, Paris 1991).
- AL- SAFADI et Al, Differences in Quantitave and Qualitative Characteristics of Local and Introduced Cultivars and Mutated lines of Garlic (Jour. of vegetable crop prouduction, vol /9 New York 2003).
- C.G-Clayton , Radioisotope Instruments ( Oxford 1971).
- H . Piraux ,les Radio -isotopes et leur applications industrielles ( Dunod ,1963).
وصلات خارجية
- NUCLEONICA Nuclear Science Portal
- NUCLEONICA wiki: Decay Engine
- General information
- Nomenclature of nuclear chemistry
- Some theoretical questions of nuclear stability
- Decay heat rate|quantity calculation
- Specific activity and related topics.
- The Lund/LBNL Nuclear Data Search - Contains tabulated information on radioactive decay types and energies.
- The Karlsruhe Nuclide Chart
- Monte Carlo Simulation of Radioactive Decay





