أوكسالات الكالسيوم
| |
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Calcium oxalate
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.008.419 |
PubChem CID
|
|
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
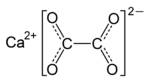
| الصيغة الجزيئية | CaC2H2O5 (monohydrate) CaC2O4 (anhydrous) |
| المظهر | صلب ابيض |
| الكثافة | 2.20 g/cm3, monohydrate[1] |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | 0.67 mg/L (20 °C) |
| المخاطر | |
| خطر رئيسي | ضار، مهيج |
| NFPA 704 (معيـَّن النار) | |
| مركبات ذا علاقة | |
أنيونات أخرى
|
كربونات الكالسيوم خلات الكالسيوم فورمات الكالسيوم |
كاتيونات أخرى
|
أوكسالات الصوديوم أوكسالات البريليوم أوكسالات المغنسيوم أوكسالات السترونشم أوكسالات الباريوم أوكسالات الراديوم أوكسالات الحديد الثنائي أوكسالات الحديد الثلاثي |
مركـّبات ذات علاقة
|
حمض الأوكساليك |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |

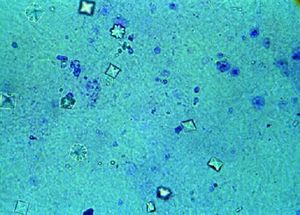
اوكسالات كالسيوم Calcium Oxalate هو مركب كيميائي له الصيغة CaC2O4 ، ويكون على شكل مسحوق بلوري أبيض إبري، وهو ملح الكالسيوم لحمض الأكساليك. يوجد منه شكل مائي أحادي الهيدرات، حيث تدخل جزيئة ماء في البنية البلورية.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص
- أكسالات البوتاسيوم غير منحل عملياً في الماء، لكنه ينحل في الأحماض المعدنية الممددة.
- بتسخين المركب إلى درجة حرارة بين 180 و 200°س يبدأ المركب أحادي الهيدرات بفقدان الماء البلوري ويتحول إلى الشكل الخالي من الماء. بمتابعة التسخين يتفكك المركب إلى كربونات الكالسيوم وأحادي أكسيد الكربون.
- تتبع بلورات اوكسالات البوتاسيوم تتبع النظام البلوري المعيني المستقيم.
الوفرة الطبيعية والتحضير
يدخل مركب أكسالات الكالسيوم في تركيب الحصى الكلوية. كما يوجد في بعض النباتات مثل ديفنباخيا، كما يوجد في بعض أوراق الراوند. يمكن أن يعثر على مركب أكسالات الكالسيوم في الطبيعة أيضاً على شكل معدن هيويليت Whewellite.
يحضر اوكسالات البوتاسيوم مخبرياً كناتج ثانوي من عملية تحضير حمض الأكساليك، حيث يتفاعل أكسالات الصوديوم مع هيدروكسيد الكالسيوم حيث يترسب اوكسالات الكالسيوم من المحلول. للحصول على حمض الاوكساليك يضاف حمض الكبريتيك لاحقاً.
Na2C2O4 + Ca(OH)2 → CaC2O4 + 2NaOH
الاستخدامات
نظراً لعدم انحلالية مركب أكسالات الكالسيوم فإنه يستخدم في الكيمياء التحليلية للتحليل الكمي لأيونات الكالسيوم.
المصادر
- موسوعة رومب الكيميائية Römpp Lexikon Chemie, Georg Thieme Verlag
المراجع
- ^ أ ب S. Deganello (1981). "The Structure of Whewellite, CaC2O4.H2O, at 328 K". Acta Crystallogr. B. 37: 826–829. doi:10.1107/S056774088100441X.