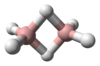أرسين

| |||
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاكs
Arsenic trihydride
Arsane Trihydridoarsenic | |||
| أسماء أخرى
Arseniuretted hydrogen,
Arsenous hydride, hydrogen arsenide Arsenic hydride | |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.029.151 | ||
| رقم EC |
| ||
| مرجع Gmelin | 599 | ||
PubChem CID
|
|||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | AsH3 | ||
| كتلة مولية | 77.9454 g/mol | ||
| المظهر | colourless gas | ||
| الكثافة | 4.93 g/l, gas; 1.640 g/mL (−64 °C) | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | 0.07 g/100 ml (25 °C) | ||
| ضغط البخار | 14.9 atm[1] | ||
| البنية | |||
| الشكل الجزيئي | trigonal pyramidal | ||
| Dipole moment | 0.20 D | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
+66.4 kJ/mol | ||
| Standard molar entropy S |
223 J.K−1.mol−1 | ||
| المخاطر | |||
| خطر رئيسي | explosive, flammable, potential occupational carcinogen[1] | ||
تبويب الاتحاد الاوروپي (DSD)
|
Extremely flammable (F+) Highly toxic (T+) Harmful (Xn) Dangerous for the environment (N) | ||
| توصيف المخاطر | R12, R26, R48/20, R50/53 | ||
| تحذيرات وقائية | (S1/2), S9, S16, S28, قالب:S33, S36/37, S45, S60, S61 | ||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | −62 °C (−80 °F; 211 K) | ||
| حدود الانفجار | 5.1%-78%[1] | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
2.5mg/kg(Intravenous)[2] | ||
LC50 (التركيز الأوسط)
|
120 ppm (rat, 10 min) 77 ppm (mouse, 10 min) 201 ppm (rabbit, 10 min) 108 ppm (dog, 10 min)[3] | ||
LCLo (المنشورة الأقل)
|
250 ppm (human, 30 min) 300 ppm (human, 5 min) 25 ppm (human, 30 min)[3] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
TWA 0.05 ppm (0.2 mg/m3)[1] | ||
REL (الموصى به)
|
C 0.002 mg/m3 [15-minute][1] | ||
IDLH (خطر عاجل)
|
3 ppm[1] | ||
| مركبات ذا علاقة | |||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
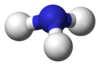
ثلاثي هيدريد الزرنيخ مركب كيميائي له الصيغة AsH3 ، ويكون على شكل غاز عديم اللون له رائحة تشبه رائحة الثوم. يعد غاز الأرسين من الغازات شديدة السمية، كما أنه قابل للاشتعال.
التاريخ
ذكر كارل شيلي غاز الأرسين في مذكراته عام 1775 وذلك عندما قام باختزال أكسيد الزرنيخ الثلاثي باستخدام الزنك بوجود وسط حمضي.
- As2O3 + 6Zn + 6H2SO4 → 2AsH3 + 6ZnSO4 + 3H2O
استعمل غاز الأرسين كسلاح كيميائي في الحرب العالمية الأولى من قبل القوات الألمانية وكان ضمن فئة الأسلحة المرمزة بالصليب الأخضر.
الخواص
الفيزيائية
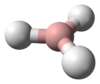
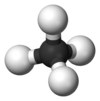
يتكون الأرسين بنيوياً من هرم ثلاثي تشكل فيه ذرات الهيدروجين قاعدة مثلثة، وتكون ذرة الزرنيخ على رأس ذلك الهرم. زاوية الرابطة H-As-H مقدارها 91.83°، وهي بذلك أقل من زاوية رباعي السطوح 109.5°، وذلك نتيجة وجود زوج إلكتروني على ذرة الزرنيخ، والذي يؤدي أثر التدافع الكهربائي الساكن له إلى نقصان مقدار انفراج الزاوية، كما تلعب طول الرابطة As-H والتي تبلغ 1.519 أنغستروم دوراً في انخفاض تلك القيمة. لدى الأرسين عزم ثنائي قطب ضعيف مقداره 0.22 ديباي.
الكيميائية
- التفكك الحراري
إن مركب الأرسين غير ثابت بالمقارنة مع العناصر المكونة له، أي أنه ثابت حركياً ولكنه غير ثابت ترموديناميكياً. يعد تفاعل التفكك هذا أساس اختبار مارش للكشف عن الزرنيخ الفلزي.
- 2 AsH3 → 3 H2 + 2 As
- الأكسدة
يحترق الأرسين بأكسجين الهواء بلهب أزرق خافت إلى أكسيد الزرنيخ الثلاثي والماء:
- 2 AsH3 + 3 O2 → As2O3 + 3 H2O
في حال عدم وجود كمية كافية من الأكسجين أو عند درجة حرارة احتراق منخفضة، حيث يحترق (يتأكسد) الهيدروجين فقط إلى الماء. أما المؤكسدات القوية مثل فوق منغنات البوتاسيوم وتحت كلوريت الصوديوم وحمض النتريك.[4]
- تفاعلات حمض-أساس
لا يعد الأرسين AsH3 من القواعد مقارنة مع الأمونياك NH3، لكن حمضيته بالمقابل هي موضع نقاش، إذ أنه من الممكن نزع بروتون منه كما في التفاعل مع أميد الصوديوم:
- AsH3 + NaNH2 → NaAsH2 + NH3
كما من الممكن أن يفقد الأرسين إحدى ذرات الهيدروجين وذلك في التفاعل مع ثلاثي ألكيل الألومنيوم حيث يشكل ثلاثي الوحدات R2AlAsH2]3] حيث R = (CH3)3C ثالثي البوتيل.[5]
من جهة أخرى يمكن برتنة الأرسين بالأحماض الفائقة ليعطي الملح +[AsH4] والذي يمكن فصله.[6]
- تفاعلات أخرى
يتفاعل الأرسين في المحاليل المائية بصفة اختزالية حيث يقوم مثلاً باختزال محلول نترات الفضة مشكلاً الفضة الفلزية:
AsH3 + 3H2O + 6Ag+ → As(OH)3 + 6H+ + 6Ag
يتضمن هذا التفاعل إحدى مراحل الكشف عن الزرنيخ في اختبار غوتسايت Gutzeit test.[7] يتضمن هذا الاختبار اختزال مركبات الزرنيخ المائية بالزنك بوجود حمض الكبريتيك، حيث ينتج الأرسين من هذا التفاعل، والذي يمرر على محلول الفضة، مما يؤدي إلى ترسب الفضة حيث تشكل مرآة فضية على إناء التفاعل.
التحضير
ينتج غاز الأرسين من تفاعل أملاح الزرنيخيدات مع الماء أو الأحماض الممددة (تفاعل حلمهة) [8]:
- Zn3As2 + 6 H+ → 2 AsH3 + 3 Zn2+
بإجراء عملية اختيار مناسبة للمواد الداخلة في التفاعل يمكن الحصول على شكل نقي من الأرسين.[9]
كما يمكن إجراء عملية التحضير من تفاعل أملاح الزرنيخ الثلاثي مع الهيدريدات [10][11] مثل تفاعل بورهيدريد الصوديوم مع كلوريد الزرنيخ الثلاثي كما في المعادلة:
- 4 AsCl3 + 3 NaBH4 → 4 AsH3 + 3 NaCl + 3 BCl3
الاستخدامات
تطبيقات إلكترونية مكروئية
يستخدم الأرسين في تحضير المواد الداخلة في تركيب أشباه الموصلات في الإلكترونيات المكروئية Microelectronics، وليزر الجسم الصلب Solid-state laser. مثال على ذلك زرنيخيد الغاليوم GaAs الذي يحضر من عملية ترسيب كيميائي للبخار عند درجات حرارة تتراوح بين 700-900°س.
- Ga(CH3)3 + AsH3 → GaAs + 3 CH4
نظرا لسمية المركب فإن إصدار الغاز يتم عن طريق امتزاز الأرسين على مركب له خواص مسامية مكروئية Microporous material حيث يمكن التحكم بدرجة إصدار الغاز السام، مما يوفر شروط سلامة ملائمة أثناء العمل.
علم الأدلة الجنائية
للأرسين تطبيقات في علم الأدلة الجنائية حيث يتشكل كمركب وسطي أثناء الكشف عن التسمم بالزرنيخ. من إحدى طرق الكشف عن التسمم بالزرنيخ اختبار مارش Marsh test، والذي يولد الأرسين في حال وجود الزرنيخ.[11] يتضمن الاختبار، الذي اكتشفه الكيميائي البريطاني James Marsh عام 1836، مفاعلة عينة يشك أنها حاوية على الزرنيخ من جسد الجثة (المعدة غالباً) مع الزنك بوجود حمض الكبريتيك الممدد. في حال وجود الزرنيخ يتشكل لدينا غاز الأرسين والذي يمرر على أنبوب زجاجي، حيث يخضع إلى عملية تفكك حراري، مما يؤدي إلى تشكل راسب أسود من الزرنيخ (مرآة سوداء).
انتشر استخدام هذا الاختبار في نهاية القرن التاسع عشر وبداية القرن العشرين، إلا أنه حالياً تستخدم أجهزة تحليلية مثل المطيافية الذرية Atomic spectroscopy وفلورية الأشعة السينية والبلازما المقترنة بالتحريض inductively coupled plasma.
حدود التعرض المهني
| البلد | Limit[12] |
|---|---|
| الأرجنتين | Confirmed human carcinogen |
| أستراليا | TWA 0.05 ppm (0.16 mg/m3) |
| بلجيكا | TWA 0.05 ppm (0.16 mg/m3) |
| Bulgaria | Confirmed human carcinogen |
| Colombia | Confirmed human carcinogen |
| Denmark | TWA 0.01 ppm (0.03 mg/m3) |
| Egypt | TWA 0.05 ppm (0.2 mg/m3) |
| France | VME 0.05 ppm (0.2 mg/m3)
VLE 0.2 ppm (0.8 mg/m3) |
| Hungary | TWA 0.2 mg/m3STEL 0.8 mg/m3 |
| Japan | Occupational Exposure Limit 0.01 ppm (0.032 mg/m3)
Continuous 0.1 ppm (0.32 mg/m3) |
| Jordan | Confirmed human carcinogen |
| Mexico | TWA 0.05 ppm (0.2 mg/m3) |
| Netherlands | MAC-TCG 0.2 mg/m3 |
| New Zealand | TWA 0.05 ppm (0.16 mg/m3) |
| Norway | TWA 0.003 ppm (0.01 mg/m3) |
| Philippines | TWA 0.05 ppm (0.16 mg/m3) |
| Poland | TWA 0.2 mg/m3 STEL 0.6 mg/m3 |
| Russia | STEL 0.1 mg/m3 |
| Singapore | Confirmed human carcinogen |
| South Korea | TWA 0.05 ppm (0.2 mg/m3) |
| Sweden | TWA 0.02 ppm (0.05 mg/m3) |
| Switzerland | MAK-week 0.05 ppm (0.16 mg/m3) |
| تايلند | TWA 0.05 ppm (0.2 mg/m3) |
| تركيا | TWA 0.05 ppm (0.2 mg/m3) |
| United Kingdom | TWA 0.05 ppm (0.16 mg/m3) |
| الولايات المتحدة | 0.05 ppm (0.2 mg/m3) |
| Vietnam | Confirmed human carcinogen |
انظر أيضاً
- Arsenic
- Cacodylic acid
- Cacodyl oxide
- Devarda's alloy, also used to produce arsine in the lab
- List of highly toxic gases
- Marsh test first used to analyse AsH3
- James Marsh invented in 1836 the test bearing now his name
- Stibine
الهامش
- ^ أ ب ت ث ج ح NIOSH Pocket Guide to Chemical Hazards 0040
- ^ Levvy, G.A. (1946). "The Toxicity of Arsine Administered by Intraperitoneal Injection". Wiley Online Library. 1: 287–290. doi:10.1111/j.1476-5381.1946.tb00049.x. Retrieved 3 December 2014.
- ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةIDLH - ^ Institut National de Recherche et de Sécurité. "Fiche toxicologique nº 53: Trihydrure d'arsenic" (نسق المستندات المنقولة).
- ^ Atwood, D. A.; Cowley, A. H.; Harris, P. R.; Jones, R. A.; Koschmieder, S. U.; Nunn, C. M.; Atwood, J. L.; Bott, S. G. "Cyclic Trimeric Hydroxy, Amido, Phosphido, and Arsenido Derivatives of aluminum and gallium. X-ray Structures of [tert-Bu2Ga(m-OH)]3 and [tert-Bu2Ga(m-NH2)]3" Organometallics (1993), vol. 12, pages 24–29
- ^ R. Minkwitz, R.; Kornath, A.; Sawodny, W.; Härtner, H. "Über die Darstellung der Pnikogenoniumsalze AsH4+SbF6−, AsH4+AsF6−, SbH4+SbF6−" Zeitschrift für anorganische und allgemeine Chemie Vol. 620, pages 753–756.
- ^ King, E. J. "Qualitative Analysis and Electrolytic Solutions" Harcourt, Brace, and World; New York (1959)
- ^ Helmut Sitzmann, in: Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ^ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 593-5.
- ^ Bellama, J. M.; MacDiarmid, A. G. "Synthesis of the Hydrides of Germanium, Phosphorus, Arsenic, and Antimony by the Solid-Phase Reaction of the Corresponding Oxide with Lithium Aluminum Hydride" Inorganic Chemistry, 1968, vol. 7, page 2070–2
- ^ أ ب Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001
- ^ "Arsine". RTECS. National Institute for Occupational Safety and Health (NIOSH).
قراءات أخرى
- Hatlelid K. M. (1996). "Reactions of Arsine with Hemoglobine". Journal of Toxicology and Environmental Health Part A. 47 (2): 145–157. doi:10.1080/009841096161852.
- Nielsen H. H. (1952). "The Molecular Structure of Arsine". The Journal of Chemical Physics. 20 (12): 1955–1956. doi:10.1063/1.1700347.
- Fowler B. A., Weissberg J. B. (1974). "Arsine poisoning". New England Journal of Medicine. 300: 1171–1174.
وصلات خارجية
- International Chemical Safety Card 0222
- IARC Monograph "Arsenic and Arsenic Compunds"
- NIOSH Pocket Guide to Chemical Hazards
- قالب:Inrs
- Data on arsine from Air Liquide
المصادر
- ECHA InfoCard ID from Wikidata
- Chemical articles with unknown parameter in Chembox
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Short description is different from Wikidata
- هيدريدات فلزية
- مركبات الزرنيخ
- غازات صناعية
- مسرطنات المجموعة 1 حسب تصنيف الوكالة الدولية لأبحاث السرطان
- Highly Hazardous Chemicals