علم الجينوم
| جزء من سلسلة عن |
| علم الوراثة |
|---|
 |
| المكونات الرئيسية |
| التاريخ والموضوعات |
| الأبحاث |
| الطب الشخصي |
| الطب الشخصي |
علم الجينوم Genomics، هو أحد فروع علم الوراثة يهتم بدراسة المادة الوراثية في أجسام الكائنات الحية. يتضمن المجال جهودا مكثفة لتحديد تسلسل الحمض النووي بشكل كامل ورسم الخرائط الدقيقة للجينوم. كما يشتمل هذا التخصص على دراسة عدد من الظواهر التي تحدث داخل الجينوم مثل الهجين heterosis، القشوة وغيرها من التفاعلات بين المواضع المختلفة والأليلات داخل الجينوم. وفي المقابل، عندما يتم دراسة عدد محدود من الجينات (وليس كل الجينات(يطلق عليها الأحياء الجزيئية molecular biology أو علم الوراثة الجزيئي genetics، وهو موضوع عادة ما ينتشر في البحوث الطبية البيولوجية. ان اجراء البحوث على جين واحد (أو عدد محدود من الجينات) لا يندرج ضمن تعريف علم الجينوم مالم يكن الهدف من هذا البحث هو دراسة تأثير الجين على كامل الشبكات داخل الجينوم بأكمله. الجينوم هو مجموع الجينات كائن الفرد بأكلمها. وبالتالي، فعلم الجينوم هو دراسة الجينات في الخلية، أو النسيج، على مستوى الحمض النووي دنا.
التاريخ
في أبريل 2003، اكتملت دراسات مشروع الجينوم البشري، وتوافرت معلومات لاتقدر بثمن بشأن تسلسل القواعد في الحمض الريبي النووي المنقوص الأكسجين (الدنا DNA) في صبغيات الإنسان التي تشكل نحو 35000 مورثة في خلاياه. وقد أوضح هذا المشروع أن نحو 99.9% من المعلومات المتوافرة في المورثات متماثلة عند جميع الناس، وأن الفروق الصغيرة المتبقية هي المفتاح المميز لشخصية الإنسان ووظائف جسمه. ومع أن هذه الفروق لاتسبب عادة مشكلات تتعلق بنمو الفرد وتطوره، أو بوظائفه الحيوية، إلا أنها قد تؤثر في استعداده للتعرض لمشكلات صحية معينة، وقد تحدد كيفية تفاعل الجسم مع معاملات مختلفة، منها مايتعلق بكيفية استقلاب metabolism الأدوية المختلفة ومدى الاستفادة منها. وكان من جملة فوائد هذا المشروع تطور الدراسات الخاصة بالعلاج الجينومي، التي تبحث في تحديد التداخلات interactions بين المورثات والعقاقير الدوائية. ويؤمل في أنه في بضع سنوات، سيوفِّر التعرف الدقيق إلى الصيغ الوراثية للمرضى فرص معالجتهم بعقاقير دوائية ذات كفاءة وسلامة مرتفعتين، وبمعنى آخر أن يصف الطبيب الجرعة المناسبة من الدواء المناسب للمريض، وهذا تحقيق لمايُدعى الطب «الإفرادي أو الشخصي» personalized medicine.
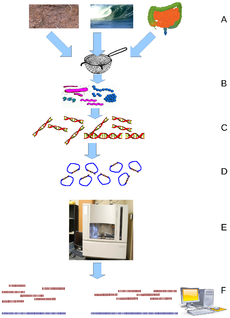
DNA sequencing technology developed
Shotgun sequencing
High-throughput sequencing
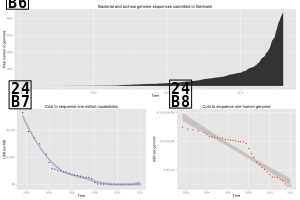
The high demand for low-cost sequencing has driven the development of high-throughput sequencing (or next-generation sequencing [NGS]) technologies that parallelize the sequencing process, producing thousands or millions of sequences at once.[1][2] High-throughput sequencing technologies are intended to lower the cost of DNA sequencing beyond what is possible with standard dye-terminator methods. In ultra-high-throughput sequencing as many as 500,000 sequencing-by-synthesis operations may be run in parallel.[3][4]
Illumina (Solexa) sequencing

Sequencing pipelines and databases
The need for reproducibility and efficient management of the large amount of data associated with genome projects mean that computational pipelines have important applications in genomics.[6]
Research areas
Structural genomics
Epigenomics
علم الجينوم البيئي Metagenomics
تتوافر في المراجع العلمية أمثلة عدة حول الارتباط القوي بين التباين الوراثي genetic variation والاستجابة للدواء. وقد أمكن وصف الأسس الجزيئية لبعض منها، متضمنة أمثلة عن تباين المورثات (الجينات) genes المسؤولة عن امتصاص الدواء واستقلابه، وقد شهدت تسعينيات القرن العشرين ثورة عظيمة في علوم الحياة (البيولوجيا)، ومن المتوقع أن التقانات التي طُوِّرت والاكتشافات التي تحققت بهذا المشروع ستؤدي إلى تغيير كل من مستقبل صناعة الأدوية والممارسات الطبية المعروفة حالياً؛ إذ إن معرفة الأطباء والصيادلة بشأن العلاقة بين النمط الجيني للمريض وكفاءة الدواء الذي يتناوله سوف تزداد، وسوف يؤدي تصنيف المرضى بحسب أنماطهم الجينية إلى انتقاء الأدوية التي تزيد من كفاءة تأثيراتها العلاجية وتُنقِص في الوقت ذاته آثارها الجانبية.[7]
العلاج الجينومي، أو الأدوية الجينومية، علم جديد لم يكن موجوداً قبل منتصف التسعينيات من القرن العشرين، وهو يجمع بين علوم صيدلانية تقليدية، مثل علوم الكيمياء الحيوية والأدوية، وبين المعلومات الحديثة التي توافرت عن مشروع الجينوم البشري، وأشكال المورثات والطفرات والبروتينات وآثار العوامل البيئية، ومايرتبط بكل ذلك من علوم ومعارف، ويضم هذا العلم الوراثة الدوائية التي تهتم بدراسة الفروق بين الأفراد من حيث الاستجابة للدواء بسبب اختلافات تراكيبهم الوراثية، وتستكشف طرائق استخدام هذه الاختلافات للتنبؤ باستجابة مريض لدواء: هل هي استجابة جيدة، أو رديئة، أو معدومة؟
ليست الاستجابة للدواء محددة بالمورثات وحسب، بل تتأثر أيضاً بالشروط البيئية المحيطة بالمرضى. ومع أنه يمكن تحديد عدد كبير من العوامل البيئية، إلا أن تحديد المورثات المسؤولة عن تلك الاستجابة ليس أمراً يسيراً؛ ولهذا فإن دراسات العلاجات الجينومية تتجه نحو تحديد التباينات الوراثية التي تحدد نوعية الاستجابة للدواء، وفي أحيان كثيرة قد يصف بعض الأطباء عقاراً دوائياً معيناً، فيكتشف المريض أن له آثاراً جانبية رديئةً، أو أنه لم يحقق أي فائدة، ويضطر الطبيب إلى استخدام أدوية أخرى بقصد العثور على علاج مناسب للمرض. ويُتوقع أن يُوفر العلاج الجينومي طرائق تشخيص ومعالجة بديلة أفضل من المعمول بها حالياً، ويؤمل أن يذهب المريض في المستقبل غير البعيد إلى عيادة طبيبه، فيقوم بتشخيص مرضه، ويحلل عينة من الدنا منه، أو يدرسها من شريحة إلكترونية يحملها المريض معه مبينة كل المعلومات عن جينومه، ومن ثم يصف العلاج المناسب له.
الجينوم البشري
جينوم العاثيات
جينوم البكتريا الزرقاء
العلاج الجينومي
تُصنَّع الأدوية حالياً وفق أسس جماعية، ولكن المريض هو مَنْ يجب الاهتمام به، فمثلاً: لايستجيب حتى 35% من المرضى لحاصرات بيتا ß blockers ، ولايستجيب حتى 50% منهم لمضادات الاكتئاب الثلاثية الحلقات tricyclic antidepressants، مما يجعل استفادة هؤلاء المرضى منها معدومة، أو أنها قد تؤدي إلى نتائج ضارة. وإن كمية معينة من الأدوية المسكنة للآلام، مثل الكوديين codeine، قد تنتج الأثر المرغوب في بعض الأفراد، ولكنها قد تكون عديمة التأثير في أناس آخرين، بل قد تنتج آثاراً سيئة، وقد تهدد حياة بعضهم. وفي بعض الأمراض، قد ينتظر المريض فترة طويلة قبل أن يكتشف إذا ما كان العلاج الذي يستخدمه مفيداً بشكل مقبول أم لا، وقد يضطر إلى تكرار ذلك بتجربة علاجات أخرى، ويُؤمل في أن توفر العلاجات الجينومية السبل اللازمة ليقول الطبيب للمريض: «هذا هو الدواء لمرضك، وهذه هي الجرعات المناسبة منه».
ليس اختبار التباينات الوراثية بين البشر أمراً سهلاً أو رخيصاً، ولكنه سيصبح كذلك بتقدم البحوث وتطور التقانات والإمكانات. وسيؤدي ذلك في المستقبل إلى تحقيق وفر كبير، انطلاقاً من نواحٍ اقتصادية مثل: التكاليف المرتفعة نتيجة إخفاق الدواء الذي لايحقق أي فائدة علاجية، ولو كان ذلك لعدد صغير من المرضى، أو كالدواء الذي يسبب زيادة تكاليف الرعاية الصحية، أو تكاليف علاج المرضى الذين أصيبوا بسمية دوائية أو بآثار جانبية سيئة أخرى، أو تكاليف زياراتهم المتكررة لعيادات الأطباء أو المستشفيات.
ويضع الباحثون نصب أعينهم أن كفاءة الدواء مرهونة بقبوله للامتصاص، وأن يكون استقلابه صحيحاً، وأن يرتبط بهدفه، وليس بمكونات أخرى في جسم المريض، وأن تطرح بقايا استقلابه فلا تتراكم في الجسم. إن أي اختلافات وراثية في أي من هذه الوظائف قد يؤدي إلى اختلافات كبيرة أو صغيرة في الاستجابة للدواء. ومن أفضل الأمثلة على ذلك المورثات التي تُرمِّز لإنتاج إنزيمات استقلاب العقاقير الدوائية، مثل مجموعة إنزيمات السيتوكروم P450 (cytochrome P450 CYP450) المسؤولة عن استقلاب مجموعة كبيرة من الأدوية البشرية، ويختلف الأفراد في سرعة استقلاب الدواء وفقاً لنوعية الإنزيمات التي يمتلكونها، إذ إن الأشخاص الممتلكين لاستقلاب بطيء يتعرضون إلى المواد الفعالة في الدواء مدة أطول، ويتعرضون للمُستقلَبَات metabolites على نحو أقل من الممتلكين للآليلات المسببة لزيادة سرعة الاستقلاب، والإنزيم CYP2D6 مسؤول عن استقلاب عدد كبير من أدوية القلب، بما فيها حاصرات بيتا. ويتصف الأفراد بطيئو الاستقلاب بتركيز دوائي في أمصالهم يبلغ الضعفين أو الثلاثة أضعاف، فيسبب ذلك دواراً وقد يؤدي إلى آثار جانبية ضارة، وقد أمكن توصيف عدد كبير من هذه الإنزيمات، لأنها مرتبطة بالنماذج الاستقلابية المختلفة للأدوية، وتوفر اختبارات لتحديد الصيغة الوراثية لعدد من هذه الإنزيمات، كما يجري إعداد عدد آخر من هذه الاختبارات.
يتوفر حالياً اختبار لقياس قدرة الفرد على إنتاج الإنزيم thiopurine S-methyltransferase (TPMT) الضروري لاستقلاب الأدوية الثيوبورينية المستخدمة في علاج الابيضاض اللمفاوي الحاد acute lymphoblastic leukemia (ALL)، وهو أكثر سرطانات الأطفال شيوعاً. ويوفر الاختبار فرصة للأطباء لتصنيف المرضى حسب أنماطهم الجينية الخاصة بإنتاج هذا الإنزيم، ويساعدهم على تحديد الجرعة الدوائية المناسبة لكل منهم، فمثلاً إذا وُجِدَ أن المريض ضعيف القدرة على إنتاج الإنزيم (ومن ثم أقل تحملاً للأدوية الثيوبورينية)؛ فإن جرعته الدوائية تُنقص كثيراً.
ومن جهة أخرى، لازالت أسئلة كثيرة متعلقة بالأطر القانونية والأخلاقية والتنظيمية لهذه الدراسات تنتظر الإجابة. ولاشك في أن من الضروري تنفيذ حملات تثقيفية واسعة لكل من المرضى والأطباء والصيادلة مرافقة للتوسع في تنفيذ هذه الدراسات الجديدة وتطبيقها.
آفاق مستقبلية
أوضحت دراسة علمية في عام 1998 نُشِرَتْ في مجلة الجمعية الطبية الأمريكية JAMA أن التفاعلات الدوائية المضادة أدت إلى حدوث أكثر من 2.2 مليون إصابة خطيرة، فضلاً عن وفاة أكثر من مئة ألف مريض في المستشفيات الأمريكية، وهذا مايجعل التفاعلات المذكورة من الأسباب الرئيسة للوفيات في تلك البلاد. وفي الوقت الحاضر، لاتتوافر طرائق سهلة للتنبؤ بإمكان حدوث استجابات جيدة للعقاقير الدوائية أو مضادة لها، أو عدم حدوث أي استجابة. ولازالت شركات صناعة الأدوية تستخدم حتى اليوم نظام «قياس واحد يناسب الجميع»، اعتماداً على متوسط استجابة المرضى للدواء، على الرغم من أن ذلك قد يسبب إصابات مرضية أو وفيات كثيرة. وستوفر دراسات العلاج الجينومي الحل الناجع لهذه المشكلات. وسيكون لها فوائد تطبيقية مهمة، منها مايأتي:
- كشف طفرات وراثية جديدة كثيرة، ومعلومات مهمة تتعلق بالتداخلات بين الوراثة والبيئة، وتحديد أنماط جينية وشذوذات صبغية مرتبطة بأمراض مختلفة.
- إضافة التشخيص الجينومي للأمراض إلى التشخيصات الطبية الأخرى، وذلك لتحريّها في وقت مبكر.
- تمكين شركات صناعة الأدوية من صنع عقاقير دوائية مستندة إلى البروتينات والإنزيمات وجزيئات الحمض الريبي النووي (الرنا RNA) المرتبط بالمورثات والأمراض. وإنتاج علاجات موجهة نحو أمراض معينة بدقة بالغة. وسيحقق ذلك زيادات كبيرة في الآثار العلاجية للدواء وإنقاص الإضرار بالخلايا السليمة.
- إنتاج لقاحات vaccines مصنوعة من مادة وراثية (دنا أو رنا) قادرة على تنشيط الجهاز المناعي، وستكون أكثر أماناً وأرخص كلفة وأسهل تخزيناً، إضافة إلى إمكان هندستها وراثياً لتؤثر في سلالات عدة من العامل الممرض في آن معاً.
- إنقاص طول المدة اللازمة لصنع دواء جديد، وصولاً إلى طرحه في الأسواق الصيدلانية، (في أمريكا مثلاً: من 15 سنة حالياً إلى نحو سنتين)، وتخفيض تكاليف إنتاجه كثيراً.
انظر أيضا
المراجع
- ^ Hall N (May 2007). "Advanced sequencing technologies and their wider impact in microbiology". J. Exp. Biol. 210 (Pt 9): 1518–25. doi:10.1242/jeb.001370. PMID 17449817.
- ^ Church GM (January 2006). "Genomes for all". Sci. Am. 294 (1): 46–54. doi:10.1038/scientificamerican0106-46. PMID 16468433.
- ^ PMID 18832462 (PubMed)
Citation will be completed automatically in a few minutes. Jump the queue or expand by hand - ^ PMID 19679224 (PubMed)
Citation will be completed automatically in a few minutes. Jump the queue or expand by hand - ^ Monya Baker (2012-09-14). "Benchtop sequencers ship off" (Blog). Nature News Blog. Retrieved 2012-12-22.
- ^ DOI:10.1007/978-1-60327-429-6 10.1007/978-1-60327-429-6
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ^ أسامة عارف العوا. "علم الأدوية الجينومي". الموسوعة العربية. Retrieved 2011-06-23.
للاستزادة
- Vadim N., Gladyshev; Zhang, Yan (2013). "Chapter 16 Comparative Genomics Analysis of the Metallomes". In Banci, Lucia (Ed.) (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. doi:10.1007/978-94-007-5561-10_16. ISBN 978-94-007-5560-4. electronic-book ISBN 978-94-007-5561-1 قالب:Issn electronic-قالب:Issn
وصلات خارجية
- Annual Review of Genomics and Human Genetics
- BMC Genomics: A BMC journal on Genomics
- Genomics journal
- Genomics.org: An openfree genomics portal.
- NHGRI: US government's genome institute
- JCVI Comprehensive Microbial Resource
- KoreaGenome.org: The first Korean Genome published and the sequence is available freely.
- GenomicsNetwork: Looks at the development and use of the science and technologies of genomics.
- Institute for Genome Sciences: Genomics research.
- MIT OpenCourseWare HST.512 Genomic Medicine A free, self-study course in genomic medicine. Resources include audio lectures and selected lecture notes.
- ENCODE threads explorer Machine learning approaches to genomics. Nature (journal)
- Global map of genomics laboratories
- Genomics: Scitable by nature education