ثنائي أكسيد الكربون

| |||
|
| |||
| الأسماء | |||
|---|---|---|---|
أسماء أخرى
| |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| 3DMet | |||
| مرجع بايلستاين | 1900390 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.004.271 | ||
| رقم EC |
| ||
| E number | E290 (preservatives) | ||
| مرجع Gmelin | 989 | ||
| KEGG | |||
| عناوين مواضيع طبية MeSH | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
| UN number | 1013 (gas), 1845 (solid) | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | CO2 | ||
| كتلة مولية | 44 g mol-1 | ||
| المظهر | غاز عديم اللون | ||
| الرائحة |
| ||
| الكثافة |
| ||
| 194.6855(30) K (−78.4645(30) °C) at 1 atm (0.101325 MPa) | |||
| قابلية الذوبان في الماء | 1.45 g/L عند درجة 25 °C (77 °F)، 100 kPa (0.99 atm) | ||
| ضغط البخار | 5.7292(30) MPa, 56.54(30) atm (20 °C (293.15 K)) | ||
| الحموضة (pKa) | 6.35, 10.33 | ||
| القابلية المغناطيسية | −20.5·10−6 cm3/mol | ||
| التوصيل الحراري | 0.01662 W·m−1·K−1 (300 K (27 °C; 80 °F))[2] | ||
| معامل الانكسار (nD) | 1.00045 | ||
| اللزوجة |
| ||
| Dipole moment | 0 D | ||
| البنية | |||
| البنية البلورية | Trigonal | ||
| الشكل الجزيئي | Linear | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
−393.5 kJ·mol−1 | ||
| Standard molar entropy S |
214 J·mol−1·K−1 | ||
| سعة الحرارة النوعية، C | 37.135 J/K·mol | ||
| علم الأدوية | |||
| V03AN02 (WHO) | |||
| المخاطر | |||
| صفحة بيانات السلامة | Sigma-Aldrich | ||
| NFPA 704 (معيـَّن النار) | |||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LCLo (المنشورة الأقل)
|
90,000 ppm (human, 5 min)[5] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
TWA 5000 ppm (9000 mg/m3)[4] | ||
REL (الموصى به)
|
TWA 5000 ppm (9000 mg/m3), ST 30,000 ppm (54,000 mg/m3)[4] | ||
IDLH (خطر عاجل)
|
40,000 ppm[4] | ||
| مركبات ذا علاقة | |||
أنيونات أخرى
|
|||
كاتيونات أخرى
|
|||
مركـّبات ذات علاقة
|
|||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
ثاني أكسيد الكربون أو الغاز الفحمي (إنگليزية: carbon dioxide) هو مركب كيميائي وأحد مكونات الغلاف الجوي، يتكون من ذرة كربون مرتبطة بذرتي أكسجين. يرمز له بالرمز CO2. يكون على شكل غاز في الحالة الطبيعية، ولكنه يستخدم أيضا في حالته الصلبة ويـُعرف في هذا الارتباط باسم الثلج الجاف.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخصائص الكيميائية والفيزيائية
ينتج ثاني أكسيد الكربون طبيعيا كناتج احتراق المواد العضوية، وناتج من عمليات التخمر. كما ينتج كناتج ثانوي للعديد من الصناعات الكيميائية. ويشتهر هذا المركب بتسببه في ظاهرة الاحتباس الحراري والتي تؤدي إلى ارتفاع درجة حرارة الأرض.
وفي السنوات الأخيرة، لقي ثنائي أكسيد الكربون اهتماما خاصا وذلك لإمكانية استخدامه في الصناعات المختلفة كبديل عن المذيبات العضوية ذات التأثير السلبي على البيئة والتي يصعب التخلص منها. و الآن يعتبر هذا الغاز مضرا بالبيئة و الإنسان لما له من مضار حيث يخرج الغاز من المصانع. و قدأظهرت دراسة قام بها باحثون من الولايات المتحدة الأمريكية أن طبقة "الثيرموسفير"، وهي الطبقة الخارجية للغلاف الجوي، مهددة بالانكماش نتيجة زيادة انبعاث غاز ثاني أكسيد الكربون الناجم عن احتراق الوقود الأحفوري، والذي يشمل النفط والغاز.
وتشير نتائج الدراسة التي نشرتها دورية "رسائل في البحوث الجيوفيزيائية"، والصادرة عن الاتحاد الجيوفيزيائي الأمريكي، في عددها الأخير إلى توقع انخفاض كثافة طبقة "الثرموسفير"، بمقدار 3 في المائة وذلك بحلول العام 2017.
وكان فريق الباحثين الذي ضم علماء من جامعة بنسلفانيا الأمريكية والمركز القومي لبحوث الغلاف الجوي في الولايات المتحدة الأمريكية، قد استعرض نتائج الدراسة يوم الاثنين، من خلال مؤتمر الاتحاد الجيوفيزيائي الأمريكي والذي ينعقد ما بين الحادي عشر والخامس عشر من الشهر الحالي، في مدينة سان فرانسيسكو في ولاية كاليفورنيا الأمريكية.
وطبقاً للنتائج فإن تأثير التغير المناخي الناجم عن زيادة مستويات غاز ثنائي أكسيد الكربون، لم يعد يقتصر على الطبقات الدنيا من الغلاف الغازي وإنما امتدت آثاره إلى أبعد من ذلك.
وبحسب ما أوضح الباحثون فإنه لدى زيادة تركيز غاز ثنائي أكسيد الكربون فوق سطح الأرض، تصعد تلك الجزيئات إلى طبقة "الثيرموسفير"، لتصطدم بذرات الأوكسجين الموجودة فيها، فتمتص تلك الجزيئات جزءاً من الحرارة الموجودة في هذه الطبقة، لتشعها بعد ذلك إلى الفضاء الخارجي على شكل الأشعة المسماة بتحت الحمراء "Infrared"، وهو ما سيؤدي إلى انخفاض الحرارة في "الثيرموسفير" واستقرار جزئياتها ومن ثم انخفاض كثافتها لاحقاً.
يشار إلى أن طبقة "الثيرموسفير" هي أعلى طبقات الغلاف الجوي، وهي تبدأ من ارتفاع 53 ميلاً فوق سطح الأرض وتمتد مسافة 372 ميلاً تقريباً، و تتكون من النيتروجين والأكسجين بشكل رئيسي، وترتفع درجة الحرارة فيها بحسب النشاط الشمسي، فهي تعمل على امتصاص الأشعة فوق البنفسجية الضارة بهدف حماية الأرض.
الاستخدامات
تمهيد للاستخدامات
لثنائي أكسيد الكربون فوائد مهمة في المنزل والصناعة. فثنائي أكسيد الكربون الذي يصدر عن مسحوق التخمير أو الخميرة يستخدم في صنع الكعك. ويستعمل ثنائي أكسيد الكربون في صنع المشروبات الغازية، والجعة، وبعض المشروبات، حيث يضفي عليها أزيزها المميز. يستعمل ثنائي أكسيد الكربون في بعض أجهزة إطفاء الحريق، لأنه لا يحترق، ولأن ثنائي أكسيد الكربون النقي أثقل وزنًا من الهواء. وهذه الخاصية تمكِّن ثنائي أكسيد الكربون من تغليف وتغطية نار الحريق، وتحجب الأكسجين الموجود في الهواء عن الوصول إلى النار، ومعلوم أنَّ النار تحتاج للأكسجين لتستمر في الاحتراق. وخاصية ثقل وزن ثنائي أكسيد الكربون تجعله يتجمع في قاع الكهوف، والمناجم، والصوامع، والآبار. وقد يمنع الأكسجين من الوصول إلى تلك الأماكن مما يشكل خطورة على الناس والحيوانات حيث لا تستطيع التنفس هنالك.
يتجمد ثنائي أكسيد الكربون في درجة حرارة – 78,5°م، ويسمى ثنائي أكسيد الكربون المجمد الجليد الجاف، لأنه لا يتحول في حالة الضغط العادي إلى سائل عند ارتفاع درجة الحرارة، بل يتسامى، أي يتحول من حالة الصلابة إلى الحالة الغازية رأسًا.
وتتكون جزيئات ثنائي أكسيد الكربون من ذرة واحدة من الكربون وذرتين من الأكسجين. والصيغة الكيميائية لثنائي أكسيد الكربون هي CO2. وكان الكيميائي جوزيف بلاك أول من حدد خواص الغاز في منتصف القرن الثامن عشر الميلادي، وكان بلاك، الأسكتلندي الجنسية، كيميائيا وطبيبًا.
المشروبات
يستخدم ثاني أكسيد الكربون لإنتاج المشروبات المكربنة وماء الصوداء. تقليدياً، تستخدم الكربنة في صناعة البيرة والنبيذ الفوار، من خلال التخمير الطبيعي، لكن بعض الشركات المصنعة تقوم بكربنة هذه المشروبات اصطناعياً.
الأغذية
پوپو روكس، هي حلوى مضغوطة بغاز ثاني أكسيد الكربون عند حوالي 40 بار (600 رطل / بوصة مربعة). عند وضعها في الفم، تذوب (تمامًا مثل الحلوى الصلبة الأخرى) وتطلق فقاعات الغاز بصوت مسموع.
تُنتج عوامل التخمير غاز ثاني أكسيد الكربون لتسبب ارتفاع العجين. تًنتج خميرة الخبز ثاني أكسيد الكربون عن طريق تخمير السكريات داخل العجين، بينما تطلق المخمرات الكيميائية مثل مسحوق الخبز وصودا الخبز ثاني أكسيد الكربون عند تسخينها أو في حالة تعرضها للأحماض.
اللحام
يستخدم ثنائي أكسيد الكربون أيضاً كغلاف جوي لـ اللحام، على الرغم من أنه يتفاعل في قوس اللحام مع أكسدة معظم المعادن. يعد الاستخدام في صناعة السيارات أمراً شائعاً على الرغم من الأدلة الهامة على أن اللحامات المصنوعة من ثاني أكسيد الكربون أكثر هشاشة من تلك المصنوعة في أجواء أكثر خاملة، وأن مفاصل اللحام هذه تتدهور بمرور الوقت بسبب تكوين حمض الكربونيك. يتم استخدامه كغاز لحام في المقام الأول لأنه أقل تكلفة بكثير من الغازات الخاملة مثل الأرگون أو الهليوم.
إزالة الكافيين
ثاني أكسيد الكربون السائل مذيب جيد للعديد من المركبات العضوية المحبة للدهون، ويستخدم لإزالة الكافيين من القهوة. أولاً، تنقع حبوب البن الخضراء في الماء. توضع الحبوب في أعلى عمود ارتفاعه سبعون قدماً (21 متراً). ثم يدخل ثاني أكسيد الكربون فوق الحرج في شكل سائل عند حوالي 93 درجة مئوية في الجزء السفلي من العمود. ينتشر الكافيين من الحبوب إلى ثاني أكسيد الكربون.
عمليات صيدلانية وكيميائية
بدأ ثاني أكسيد الكربون في جذب الانتباه في الأدوية وصناعات المعالجة الكيميائية الأخرى كبديل أقل سمية للمذيبات التقليدية مثل الكلوريد العضوي. يستخدمه البعض في المنظفات الجافة لهذا السبب. (انظر green chemistry.)
في الصناعة الكيميائية، يستخدم ثاني أكسيد الكربون لإنتاج اليوريا والكربونات والبيكربونات وساليسيلات الصوديوم.
تخليق النشا
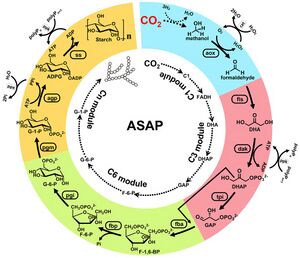
أثناء عملية التمثيل الضوئي، تقوم العديد من النباتات بتحويل الگلوكوز إلى پوليمرات تشكل حبيبات نشا غير قابلة للذوبات، ومثالية لتخزين الطاقة على المدى الطويل في الجذور والبذور. في 22 سبتمبر 2021، طور تشاي وزملائه نظامًا هجينًا يتم فيه اختزال ثاني أكسيد الكربون إلى ميثانول بواسطة محفز غير عضوي ثم تحويله بواسطة الإنزيمات أولاً إلى ثلاث وست وحدات سكر-كربون ثم إلى نشا پوليمري. يعتمد المسار الابتنائي للنشا الاصطناعي هذا على إنزيمات المأشوب المهندسة من العديد من مصادر ختلفة من العديد من الكائنات الحية، ويمكن ضبطه لإنتاج الأميلوز أو الأميلوپكتين بمعدلات وكفاءة ممتازة مقارنة بأنظمة تثبيت الكربون الاصطناعية الأخرى - واعتمادًا على المقياس المستخدم، حتى المحاصيل الحقلية.[8]
التطبيقات الزراعية/الحيوية
الليزر
من الأنواع الشائعة لليزر الغازي الصناعي هو ليزر ثنائي أكسيد الكربون.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الپوليمرات والبلاستيكات
يمكن أيضاً دمج ثاني أكسيد الكربون مع أكسيد الليمونين من قشور البرتقال أو الإيپوكسيدات الأخرى لإنتاج الپوليمرات واللدائن.[9]
إنعاش النفط
يستخدم ثاني أكسيد الكربون في الاستخراج المحسن للنفط حيث يتم حقنه في آبار النفط المنتجة أو بجوارها، عادةً في ظل ظروف فوق الحرجة. يعمل كعامل ضغط، وعندما يذوب في النفط الخام في باطن الأرض، يقلل بشكل كبير من لزوجته، مما يتيح للنفط التدفق بسرعة أكبر عبر الأرض إلى بئر الاستخراج.[10] في حقول النفط الجاهزة للاستخراج، تُستخدم شبكات أنابيب واسعة لنقل ثاني أكسيد الكربون إلى نقاط الحقن.
كمبردات
يعتبر كل من ثاني أكسيد الكربون السائل والصلب مهمَّين كمبردات، خاصة في صناعة الأغذية، حيث يتم استخدامهما أثناء نقل وتخزين المثلجات والأطعمة المجمدة الأخرى. يُطلق على ثاني أكسيد الكربون الصلب اسم "الجليد الجاف" ويستخدم للشحنات الصغيرة حيث تكون معدات التبريد غير عملية.
بحلول نهاية عام 2007، من المتوقع أن تتخذ صناعة السيارات العالمية قراراً بشأن الجيل التالي من المبردات في تكييف هواء السيارة. CO2 هو أحد الخيارات التي تمت مناقشتها. (راجع The Cool War)
إنعاش غاز الميثان المتسخرج من الفحم
في تعزيز استعادة غاز الميثان من طبقة الفحم، يتم ضخ ثاني أكسيد الكربون في طبقات الفحم لإزاحة الميثان.[11]
التحكم في نسبة الحموضة
يمكن استخدام ثاني أكسيد الكربون كوسيلة للتحكم في pH حمامات السباحة، عن طريق إضافة الغاز باستمرار إلى الماء، وبالتالي الحفاظ على مستوى الأس الهيدروجيني من الارتفاع. ومن مزايا ذلك تجنب التعامل مع الأحماض (الأكثر خطورة).
النظم الهوائية
في الغلاف الجوي للأرض


يوجد ثنائي أكسيد الكربون في الغلاف الجوي بنسبة قليلة نحو 0,03% في حين يشكل نحو 96.5% من الغلاف الجوي السميك لـكوكب الزهرة ونحو 95% من الغلاف الجوي لـكوكب المريخ وبنسب أخرى في أماكن سماوية أخرى.
الدور الحيوي
ثاني أكسيد الكربون هو منتج نهائي في الكائنات الحية التي تحصل على الطاقة من تكسير السكريات والدهون والأحماض الأمينية مع الأكسجين كجزء من الاستقلاب، في عملية تُعرف باسم التنفس الخلوي. وهذا يشمل جميع النباتات والحيوانات والعديد من الفطريات وبعض البكتيريا. في الحيوانات العليا، ينتقل ثاني أكسيد الكربون في الدم من أنسجة الجسم إلى الرئتين حيث يتم الزفير. في النباتات التي تستخدم التمثيل الضوئي، يتم امتصاص ثاني أكسيد الكربون من الغلاف الجوي.
دوره في عملية التمثيل الضوئي
السمية

محتوى ثاني أكسيد الكربون في الهواء النقي (المتوسط بين مستوى سطح البحر ومستوى 10 hPa، أي ارتفاع حوالي 30 كم) يتراوح بين 0.036٪ (360 جزء في المليون) و0.039٪ (390 جزء في المليون)، اعتماداً على الموقع (انظر graphical map of CO2).
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الفسيولوجيا البشرية
يُنقل CO2 في الدم بثلاث طرق مختلفة. (تختلف النسب المئوية الدقيقة حسب ما إذا كان الدم شريانياً أم وريدياً).
- يحوَّل معظمها (حوالي 70٪ - 80٪) إلى أيونات بيكربونات HCO3− بواسطة إنزيم الكربونيك أنهيدريز في خلايا الدم الحمراء،[14] من خلال التفاعل CO2 + H2O → H2CO3 → H+ + HCO3−.
- 5% – 10% مرتبط بـ الهيموگلوبين كمركبات كاربامينو[14]
انظر أيضاً
- Bosch reaction
- دورة الكربون
- ثاني أكسيد الكربون (صفحة بيانات)
- بالوعة ثاني أكسيد الكربون
- أول أكسيد الكربون
- ثلج جاف
- Supercritical carbon dioxide
- Center for the Study of Carbon Dioxide and Global Change
- CO2 degassing in Lake Nyos
- Carbon dioxide sensor
- EcoCute - As refrigerants
- Emission standards
- الإحترار العالمي
- Greenhouse gas
- عملية ساباتييه
- CO2 sequestration
المراجع
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةAirProductsMSDS - ^ Touloukian, Y.S., Liley, P.E., and Saxena, S.C. (1970). "Thermophysical properties of matter - the TPRC data series". Thermal Conductivity - Nonmetallic Liquids and Gases. Data book. 3.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Schäfer, Michael; Richter, Markus; Span, Roland (2015). "Measurements of the viscosity of carbon dioxide at temperatures from (253.15 to 473.15) K with pressures up to 1.2 MPa". The Journal of Chemical Thermodynamics. 89: 7–15. doi:10.1016/j.jct.2015.04.015.
- ^ أ ب ت NIOSH Pocket Guide to Chemical Hazards 0103
- ^ "Carbon dioxide". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ "Safety Data Sheet – Carbon Dioxide Gas – version 0.03 11/11" (PDF). AirGas.com. 12 February 2018. Archived (PDF) from the original on 4 August 2018. Retrieved 4 August 2018.
- ^ "Carbon dioxide, refrigerated liquid" (PDF). Praxair. p. 9. Archived from the original (PDF) on 29 July 2018. Retrieved 26 July 2018.
- ^ "Cell-free chemoenzymatic starch synthesis from carbon dioxide". www.science.org. 2021-09-22. Retrieved 2021-12-18.
- ^ Davidson, Sarah (2005-01-17). "Sweet and environmentally beneficial discovery: Plastics made from orange peel and a greenhouse gas". Cornell News. Retrieved 2007-09-09.
{{cite web}}: Cite has empty unknown parameter:|coauthors=(help) - ^ Austell, J Michael (2005). "CO2 for Enhanced Oil Recovery Needs - Enhanced Fiscal Incentives". Exploration & Production: the Oil & Gas Review -. Retrieved 2007-09-28.
{{cite journal}}: Cite has empty unknown parameters:|month=and|coauthors=(help) - ^ "Enhanced coal bed methane recovery". ETH Zurich. 2006-08-31.
- ^ Dr. Pieter Tans (3 May 2008) "Annual CO2 mole fraction increase (ppm)" for 1959-2007 National Oceanic and Atmospheric Administration Earth System Research Laboratory, Global Monitoring Division (additional details.)
- ^ Dr. Pieter Tans (3 May 2008) "Annual CO2 mole fraction increase (ppm)" for 1959-2007 National Oceanic and Atmospheric Administration Earth System Research Laboratory, Global Monitoring Division (additional details.)
وصلات خارجية
- Articles with changed EBI identifier
- ECHA InfoCard ID from Wikidata
- E number from Wikidata
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Short description is different from Wikidata
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- مقالات للتوسيع
- Articles with hatnote templates targeting a nonexistent page
- أكاسيد حمضية
- مركبات كربون لاعضوية
- غازات
- غازات دفيئة
- مركبات كيميائية
- مبردات