بيكربونات

| |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك النظامي
Hydroxidodioxidocarbonate(1−)[1] | |
| أسماء أخرى
Hydrogencarbonate[1]
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| 3DMet | |
| مرجع بايلستاين | 3903504 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| مرجع Gmelin | 49249 |
| KEGG | |
PubChem CID
|
|
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | HCO−3 |
| كتلة مولية | 61.0168 g mol−1 |
| log P | −0.82 |
| الحموضة (pKa) | 10.3 |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
في الكيمياء اللاعضوية، البيكربونات bicarbonate (تسمية-IUPAC الموصى بها: بيكربونات الهيدروجين[2])، هي الصيغة الوسيطة في نزع پروتون حمض الكربونيك. وهو أنيون صيغته الكيميائية HCO3−.
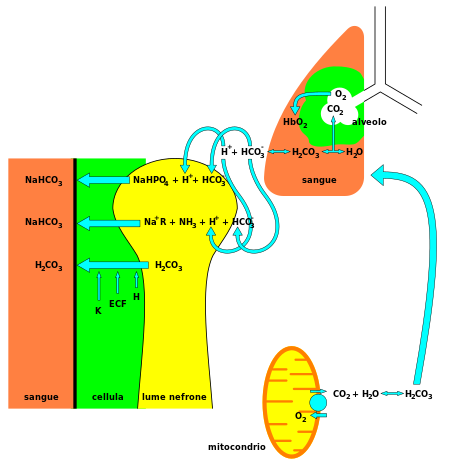
للبيكربونات دور كيميائي حيوي رئيسي في تنظيم الأس الهيدروجيني.[3]
الخواص الكيميائية
البيكربونات هي أملاح حيث ينشأ بين أيونات الهيدروكربونات والكاتيونات رابطة أيونية التي تميل إلى تنظيم هيكل بلوري. والبيكربونات ليس لها رائحة ولا لون إلا في حالة أتيان الكاتيون بلون خاص به وتكون فيهيئة مسحوق. وتكون معظم البيكربونات التي تذوب في الماء كهارل موصلة للتيار الكهربائي حيث أن الكاتيونات تكون حرية الحركة وكذلك أنيونات الهيدروجين كربونات.
التحلل:
تتحلل البيكربونات فوق درجة حرارة أعلى من 50 درجة مئوية وينتج منها ماء وثاني أكسيد الكربون.
تعتبر بيكربونات الفلزات القلوية الترابية: الكالسيوم والمغنسيوم والباريوم والسترونتيوم جيدة الذوبان في الماء، في حين أن كربونات تلك الفلزات ضعيفة الذوبان في الماء.
الدور الكيميائي الحيوي
البيكربونات (HCO3−)، هو مادة قلوية، وعنصر حيوي في تنظيم الأس الهيدروجيني (التوازن الحمضي القاعدي). 70-75% من CO2 في الجسم يتحول إلى أكسيد كربونيك (H2CO3)، الذي يمكنه أن يتحول سريعأً إلى بيكربونات.
البيكربونات في البيئة
في المياه العذبة، النشاط الضوئي لنباتات المياه العذبة في النهار يطلق غاز الأكسجين في المياه، في الوقت نفسه تُنتج أيونات البيكربونات. يؤدي هذا إلى تصاعد تحويل الأسس الهيدروجيني حتى، في ظروف محددة، تصبح القلوية سامة لبعض العضيات أو يمكنها أن تصنع مواد كيميائية أخرى مثل الأمونيا السامة. في الظلام، عندما لا يكون هناك تمثيل ضوئي، ينتج عن عملية التنفس ثاني أكسيد الكربون، ولا تنتج أيونات بيكربونات جديدة، مما يؤدي إلى هبوط سريع في الأس الهيدروجيني.
استخدامات أخرى
في معظم أملاح البيكربونات الشائعة يكون الأيون هو بيكربونات الصوديوم،NaHCO3، الذي يعرف باسم خميرة الخبز. عند التسخين أو التعرق لحمض مثل حمض الخليك (الخل)، بيكربونات الصودويوم تطلب ثاني أكسيد الكربون. يستخدم هذا كمادة رافعة في الخبز.
تدفق أيونات البيكربونات من الصخور المعرضة للحمض الكربوني الموجود في مياه الأمطار هو جزء مهم من دورة الكربون.
كذلك للبيكربونات دور في الجهاز الهضمي. ترفع البيكربونات الأس الهيدروجيني الداخلي في المعدة، بعد أن تنهي العصائر الهضمية عالية الحموضة هضمها للغذاء. بيكربونات الأمونيوم تستخدم في صنع بسكويت دايجستيڤ.
التشخيص الطبي
في التشخيص الطبي، محتوى الدم من البيكربونات هو واحد من المؤشرات المختلفة لحالة acid-base physiology في الجسم.
متغير تركيز البيكربونات القياسي (SBCe) هو تركيز البيكربونات في الدم عند PaCO2 ل40 mmHg (5.33 kPa)، التشبع الكامل للأكسجين و 36 °س.[4]
مركبات البيكربونات
انظر أيضاً
المصادر
- ^ أ ب "hydrogencarbonate (CHEBI:17544)". Chemical Entities of Biological Interest (ChEBI). UK: European Institute of Bioinformatics. IUPAC Names.
- ^ Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005, IUPAC, p. 137, http://old.iupac.org/publications/books/rbook/Red_Book_2005.pdf
- ^ "Clinical correlates of pH levels: bicarbonate as a buffer". Biology.arizona.edu. October 2006.
- ^ Acid Base Balance (page 3)