أسيتات الگلاتيرامر
 | |
| البيانات السريرية | |
|---|---|
| الأسماء التجارية | Copaxone,[1] Glatopa,[2] Brabio |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a603016 |
| License data |
|
| فئة السلامة أثناء الحمل |
|
| مسارات الدواء | Subcutaneous injection |
| رمز ATC | |
| الحالة القانونية | |
| الحالة القانونية | |
| المعرفات | |
| رقم CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider |
|
| UNII | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.248.824 |
| Chemical and physical data | |
| التركيب | C25H45N5O13 |
| الكتلة المولية | 623٫66 g·mol−1 |
| | |
أسيتات الگلاتيرامر Glatiramer acetate (يُعرف ايضاً باسم باسم كوبوليمر 1 ، كوب -1 ، أو كوباكسون ) هو دواء مناعي يستخدم حالياً لعلاج التصلب المتعدد تمت الموافقة على أسيتات الگلاتيرامر في الولايات المتحدة للحد من وتيرة الانتكاسات ، ولكن ليس للحد من تدهور الإعاقة.تشير الدراسات القائمة على الملاحظة ، ولكن ليس التجارب العشوائية المضبطة ، إلى أنها قد تقلل من تدهور الإعاقة. في حين أن التشخيص النهائي للتصلب المتعدد يتطلب تاريخًا من نائبتين أو أكثر من الأعراض والعلامات ، تمت الموافقة على أسيتات الگلاتيرامر لعلاج النائبة الأولى التي تتوقع التشخيص. كما أنه يستخدم لعلاج التصلب المتعدد المحول للانتكاس. يدار عن طريق الحقن تحت الجلد.
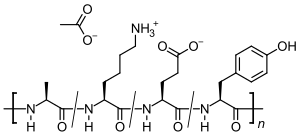
إنه مزيج من الببتيدات ذات الحجم العشوائي التي تتكون من الأحماض الأمينية الأربعة الموجودة في بروتين الميالين الأساسي ، وهي حمض الگلوتاميك ، والايسين ، والألانين ، والتايروسين . بروتين المايلين الأساسي هو المستضد في الغمد المياليني للخلايا العصبية التي تحفز تفاعل المناعة الذاتية لدى الأشخاص المصابين بمرض التصلب المتعدد ، لذلك قد يعمل الببتيد كمخادع للخلايا المناعية المهاجمة.
الاستخدامات الطبية
نتجت مراجعة كوكرين لعام 2010 إلى أن أسيتات الگلاتيرامر كانت لها فعالية جزئية في "النتائج السريرية المتعلقة بالانتكاس" ولكن ليس لها تأثير على تطور المرض.[5]نتيجةً لذلك ، تمت الموافقة عليه من قبل إدارة الغذاء والدواء (FDA) لتقليل تكرار حدوث الانتكاسات ، ولكن ليس لتقليل تدهور الإعاقة.[6]
قام متابع من التجربة الأصلية لمدة 15 عامًا بمقارنة المرضى الذين واصلوا استخدام الگلاتيرامر مع المرضى الذين خرجوا من التجربة. المرضى الذين يستخدموا الگلاتيرامر قد خفضت معدلات الانتكاس لديهم ، وانخفاض تدهور الإعاقة والانتقال إلى مرض التصلب المتعدد التدريجي الثانوي ، مقارنة مع المرضى الذين لم يواصلوا استخدام الگلاتيرامر. ومع ذلك ، فإن المجموعتين لم تكن بالضرورة قابلة للمقارنة ، لأنها لم تعد تجربة عشوائية. لم تكن هناك قضايا خاصة بالسلامة طويلة الاجل.[7]
الآثار الجانبية
قد تشمل الآثار الجانبية كتلة في موقع الحقن (تفاعل موقع الحقن) في حوالي 30 ٪ من المستخدمين ، واوجاع، حمى ، قشعريرة (أعراض تشبه أعراض الأنفلونزا) في حوالي 10 ٪ من المستخدمين.[8] اعراض الآثار الجانبية خفيفة بشكل عام في الطبيعة. تم الإبلاغ عن تفاعل يتضمن الاحمرار وضيق في التنفس والقلق ونبض القلب السريع بعد فترة قصيرة من الحقن في 5٪ من المرضى (عادة بعد الحقن مباشرة في الوريد). هذه الآثار الجانبية تهدأ في غضون ثلاثين دقيقة. بمرور الوقت ، يمكن أن تحدث نقرة مرئية في موقع الحقن بسبب التدمير المحلي للأنسجة الدهنية ، والمعروفة باسم الضمور الشحمي ، والتي قد تطور.
تم الإبلاغ عن آثار جانبية أكثر خطورة لأسيتات الگلاتيرامر ، وفقًا لوصف الدواء الصادر من إدارة الغذاء والدواء ، وتشمل هذه الآثار الجانبية الخطيرة على القلب والأوعية الدموية والجهاز الهضمي (بما في ذلك الكبد) ، مكون للدم ، الجهاز الليمفاوي, الجهاز العضلي الهيكلي ، الجهاز العصبي ، الجهاز التنفسي والجهاز البولي التناسلي وايضا الحواس الخاصة (خاصة العينين). كما تم الإبلاغ عن الاضطرابات الاستقلابية والغذائية. ومع ذلك لم يتم تأسيس صلة بين أسيتات الگلاتيرامر وهذه الآثار الضارة.[9]
من الممكن ان يسبب تخلل جينسير الليمفاوي.[10]
آلية العمل
أسيتات الگلاتيرامر عبارة عن بوليمر عشوائي (متوسط الكتلة الجزيئية 6.4 كيلو دالتون ) تتكون من أربعة أحماض أمينية موجودة في البروتين الأساسي المياليني . لم يتم توضيح آلية عمل أسيتات الگلاتيرامر بشكل كامل. يُعتقد أنها تعمل عن طريق تعديل العمليات المناعية التي يُعتقد حالياً أنها مسؤولة عن التسبب في مرض التصلب المتعدد. إعطاء أسيتات الگلاتيرامر تحول تجمع الخلايا التائية من الخلايا التائية T1 الالتهابية إلى خلايا T2 التنظيمية التي تثبط الاستجابة الالتهابية.[11] نظرًا للتشابه مع البروتين الأساسي للميالين ، قد تعمل أسيتات الگلاتيرامر كمخادعة ، مما يؤدي إلى تحويل استجابة المناعة الذاتية ضد الميالين. يتم دعم هذه الفرضية من خلال نتائج الدراسات التي أجريت لاستكشاف التسبب في التهاب الدماغ التجريبي المناعي الذاتي (EAE) ، وهي حالة نتجت عن عدة أنواع حيوانية من خلال التطعيم ضد المواد المشتقة من الجهاز العصبي المركزي التي تحتوي على الميالين وغالبًا ما تستخدم كنموذج حيواني تجريبي للتصلب المتعدد. تشير الدراسات التي أجريت على الحيوانات والأنظمة المختبرية إلى أنه عند إعطائها ، يتم تحفيز الخلايا التائية التنظيمية الخاصة بأسيتات الگلاتيرامر (Tregs) وتنشيطها في الأطراف ، مما يثبط تفاعل الالتهاب مع بروتين الميالين الأساسي.[12]
مع ذلك ، لا تتأثر سلامة حاجز دموي دماغي بشكل ملحوظ مع أسيتات الگلاتيرامر، على الأقل في المراحل المبكرة من العلاج. تم عرض أسيتات الگلاتيرامر في التجارب السريرية لتقليل عدد وشدة التفاقم التصلبي المتعدد.[13]
التاريخ
تم اكتشاف أسيتات الگلاتيرامر في الأصل بواسطة مايكل سيلا و روث أرنون ودفورا تيتلبوم في معهد وايزمان للعلوم في رحوڤوت، إسرائيل. اتبعت ثلاث تجارب سريرية رئيسية لإثبات السلامة والفعالية: أجريت أول تجربة في مركز واحد ، تجربة مزدوجة التعمية ، تجربة تحت تحكم دواء غفل وشملت 50 مريضا.[14] كانت التجربة الثانية لمدة عامين ، متعددة المراكز ، عشوائية ، مزدوجة التعمية ، تحت تحكم دواء غفل وشارك فيها 251 مريضا .[15] كانت التجربة الثالثة هي دراسة التصوير بالرنين المغناطيسي مزدوجة التعمية التي تشمل مشاركة 239 مريضا.[16]
الثقافة والمجتمع
التسويق
تمت الموافقة على أسيتات الگلاتيرامر للتسويق في العديد من البلدان في جميع أنحاء العالم ، بما في ذلك الولايات المتحدة وإسرائيل وكندا و 24 دولة من دول الاتحاد الأوروبي.[17][18] تم الحصول على الموافقة في الولايات المتحدة في عام 1997.[19] تمت الموافقة على أسيتات الگلاتيرامر للتسويق في المملكة المتحدة في أغسطس 2000 ، وتم إطلاقها في ديسمبر.[20] Eأدت هذه الموافقة الأولى في السوق الأوروبية الكبرى إلى الموافقة عبر الاتحاد الأوروبي بموجب إجراء الاعتراف المتبادل. إيران تمضي قدما في تصنيع أسيتات الگلاتيرامر المحلية.[21][22]
براءة الاختراع
Sandoz التابعة لشركة نوڤارتس بتسويق Glatopa منذ عام 2015 ، وهي نسخة عامة من تيفا 20 ملغ الأصلي تركيبة يتطلب حقن يومي..[23]
طورت تيفا 40 ملغ تركيبة طويلة المفعول ، تم تسويقها منذ عام 2015 ، مما أدى إلى تقليل الحقن المطلوبة إلى ثلاثة في الأسبوع.[24] في أكتوبر 2017 ، وافقت إدارة الغذاء والدواء على إصدار [kds، يتم تصنيعه في الهند بواسطة NATCO Pharma ، ويتم استيراده وبيعه بواسطة شركة Mylan الهولندية.[25][26] في فبراير 2018 ، تلقت Sandoz موافقة إدارة الغذاء والدواء على إصدارها الجنيس.[27] بالتوازي مع عمليات التطوير والموافقة ، تنازع المنافسون العامون على براءات اختراع تيفا الأحدث ، أي منها إذا تم التمسك بها ، سيمنع تسويق الأدوية ذات المفعول الطويل..[28]
في حين انتهت براءة الاختراع الخاصة بالعقار الكيميائي في عام2015,[29] حصلت تيفا على براءات اختراع أمريكية جديدة تغطي المستحضرات الصيدلانية للتسليم طويل المفعول.[30] أدى اقامة الدعاوي من المصنعين المنافسين في 2016-2017 إلى اعتبار البراءات الجديدة غير صالح.[31][32] أيدت محكمة الاستئناف الأمريكية للدائرة الفيدرالية إبطال براءة الاختراع للاتضاح.[33][34] تعكس القضية الجدل الأكبر حول ازدهار للأدوية الجنيسة.
.
انظر أيضاً
المصادر
- ^ أ ب "Copaxone- glatiramer acetate injection, solution". DailyMed. 23 July 2020. Retrieved 11 November 2020.
- ^ أ ب "Glatopa- glatiramer acetate injection, solution". DailyMed. 31 July 2020. Retrieved 11 November 2020.
- ^ "Brabio 20 mg/mL Solution for Injection, Pre-filled Syringe - Summary of Product Characteristics (SmPC)". (emc). Retrieved 11 November 2020.
- ^ "Copaxone 20 mg/ml solution for injection in pre-filled syringe - Summary of Product Characteristics (SmPC)". (emc). 29 September 2020. Retrieved 11 November 2020.
- ^ La Mantia L, Munari LM, Lovati R (May 2010). "Glatiramer acetate for multiple sclerosis". The Cochrane Database of Systematic Reviews. 5 (5): CD004678. doi:10.1002/14651858.CD004678.pub2. PMID 20464733.
- ^ "COPAXONE (glatiramer acetate) solution for subcutaneous injection: Full Prescribing Information (Package insert)" (PDF). United States Food and Drug Administration.
Label approved on 02/27/2009 (PDF) for COPAXONE, NDA no. 020622
- ^ Ford C, Goodman AD, Johnson K, Kachuck N, Lindsey JW, Lisak R, et al. (March 2010). "Continuous long-term immunomodulatory therapy in relapsing multiple sclerosis: results from the 15-year analysis of the US prospective open-label study of glatiramer acetate". Multiple Sclerosis. 16 (3): 342–50. doi:10.1177/1352458509358088. PMC 2850588. PMID 20106943.
- ^ "Copaxone". MediGuard.
- ^ "COPAXONE (glatiramer acetate for injection)" (PDF). Food and Drug Administration. Archived from the original (PDF) on 23 April 2003.
NDA 20-622/S-015/S-015
{{cite web}}:|archive-date=/|archive-url=timestamp mismatch; 25 أبريل 2003 suggested (help) - ^ Krafchik, Bernice R (2011). "Reaction Patterns". In Schachner, Lawrence A.; Hansen, Ronald C. (eds.). Pediatric Dermatology. Elsevier Health Sciences. p. 1022. ISBN 978-0-7234-3665-2.
{{cite book}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Arnon, Ruth; Sela, Michael (1999). "The chemistry of the Copaxone drug" (PDF). Chem. Israel. 1: 12–17.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ "Copaxone (glatiramer acetate) injection, solution". DailyMed.
- ^ "Copaxone". All About Multiple Sclerosis.
- ^ Bornstein MB, Miller A, Slagle S, Weitzman M, Crystal H, Drexler E, Keilson M, Merriam A, Wassertheil-Smoller S, Spada V (August 1987). "A pilot trial of Cop 1 in exacerbating-remitting multiple sclerosis". The New England Journal of Medicine. 317 (7): 408–14. doi:10.1056/NEJM198708133170703. PMID 3302705.
- ^ Johnson KP, Brooks BR, Cohen JA, Ford CC, Goldstein J, Lisak RP, Myers LW, Panitch HS, Rose JW, Schiffer RB (July 1995). "Copolymer 1 reduces relapse rate and improves disability in relapsing-remitting multiple sclerosis: results of a phase III multicenter, double-blind placebo-controlled trial. The Copolymer 1 Multiple Sclerosis Study Group". Neurology. 45 (7): 1268–76. doi:10.1212/WNL.45.7.1268. PMID 7617181.
- ^ Comi G, Filippi M, Wolinsky JS (March 2001). "European/Canadian multicenter, double-blind, randomized, placebo-controlled study of the effects of glatiramer acetate on magnetic resonance imaging--measured disease activity and burden in patients with relapsing multiple sclerosis. European/Canadian Glatiramer Acetate Study Group". Annals of Neurology. 49 (3): 290–7. doi:10.1002/ana.64. PMID 11261502.
- ^ McKeage K (May 2015). "Glatiramer Acetate 40 mg/mL in Relapsing-Remitting Multiple Sclerosis: A Review". CNS Drugs. 29 (5): 425–32. doi:10.1007/s40263-015-0245-z. PMID 25906331.
- ^ Comi, G.; Amato, M. P.; Bertolotto, A.; Centonze, D.; De Stefano, N.; Farina, C.; et al. (2016). "The heritage of glatiramer acetate and its use in multiple sclerosis". Multiple Sclerosis and Demyelinating Disorders. 1 (1). doi:10.1186/s40893-016-0010-2.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help)CS1 maint: unflagged free DOI (link) - ^ "Copaxone". CenterWatch.
- ^ "Teva's Copaxone approved in UK". The Pharma Letter.
- ^ "Glatiramer Acetate". Tofigh Daru Research and Engineering Company.
- ^ Isayev S, Jafarov T (1 May 2012). "Iran to manufacture multiple sclerosis cure". Trend News Agency.
- ^ "Sandoz announces US launch of Glatopa". Novartis. 2015.
- ^ Silva, Patricia (9 October 2015). "New 3-Times-Per-Week Regimen For Teva's Copaxone". Multiple Sclerosis News Today.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Erman, Michael; Grover, Divya (3 October 2017). "Mylan surges, Teva slumps after FDA okays Copaxone copy". Reuters. Retrieved 4 October 2017.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ "NATCO's marketing partner Mylan receives final approval of generic glatiramer acetate, for both 20 mg/mL and 40 mg/mL versions". NATCO Pharma (India). 3 October 2017. Retrieved 4 October 2017.>
- ^ "Sandoz announces US FDA approval and launch of Glatopa 40 mg/mL". Novartis International AG. February 13, 2018. Retrieved May 10, 2018.
- ^ "Teva's Copaxone still growing despite patent risks". BioPharmaDive.
- ^ Helfand, Carly. "Copaxone". FiercePharma.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Decker, Susan (1 September 2016). "Teva loses decision on validity of 302 copaxone patent". Bloomberg Markets.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Decker, Susan; Flanagan, Cristin; Benmeleh, Yaacov (30 January 2017). "Teva loses ruling invalidating patents on copaxone drug". Bloomberg Markets.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ "Teva loses patent ruling". Briefcase. The Philadelphia Inquirer. Bloomberg News. September 2, 2017. p. A12. Retrieved June 23, 2018 – via Newspapers.com (Publisher Extra).
- ^ "U.S. appeals court upholds ruling that canceled Teva Copaxone patents". Reuters. October 12, 2018. Retrieved October 12, 2018.
- ^ "In Re: Copaxone Consolidated Cases" (PDF). United States Court of Appeals for the Federal Circuit. October 12, 2018. Retrieved October 12, 2018.
وصلات خارجية
- CS1 errors: archive-url
- CS1 errors: unsupported parameter
- CS1 maint: unflagged free DOI
- الصفحات بحلقات قالب
- Short description is different from Wikidata
- Template:drugs.com link with non-standard subpage
- Articles with changed DrugBank identifier
- Chemicals that do not have a ChemSpider ID assigned
- Articles with changed EBI identifier
- ECHA InfoCard ID from Wikidata
- Articles without KEGG source
- Articles without InChI source
- Drugboxes which contain changes to verified fields
- Drugboxes which contain changes to watched fields
- Immunostimulants
- أدوية آلية عملها مجهولة
- Israeli inventions