نيڤولوماب
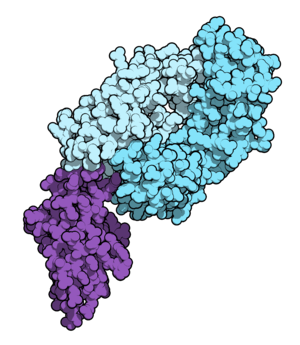 Fab fragment of nivolumab (blue) binding the extracellular domain of PD-1 (purple). From PDB entry 5ggr. | |
| الأجسام المضادة وحيدة النسيلة | |
|---|---|
| النوع | جسم مضاد كامل |
| المصدر | Human |
| الهدف | PD-1 |
| البيانات السريرية | |
| الأسماء التجارية | Opdivo |
| أسماء أخرى | ONO-4538, BMS-936558, MDX1106 |
| AHFS/Drugs.com | Monograph |
| License data | |
| فئة الدواء | Immunotherapy[1] |
| رمز ATC | |
| المعرفات | |
| رقم CAS | |
| ChemSpider |
|
| KEGG | |
| Chemical and physical data | |
| التركيب | C6362H9862N1712O1995S42 |
| الكتلة المولية | 143.6 kg/mol |
نيڤولوماب Nivolumab، يُباع تحت الاسم التجاري أوپديڤو Opdivo هو دواء يستخدم لعلاج عدد من أنواع السرطان.[2] وهذا يشمل الميلانوما وسرطان الرئة وسرطان الخلايا الكلوية ولمفومة هودجكن وسرطان الرأس والرقبة وسرطان القولون وسرطان الكبد.[2] يتم استخدامه عن طريق الحقن البطيء في الوريد.[2]
تشمل الآثار الجانبية الشائعة التعب ، والطفح الجلدي ، ومشاكل في الكبد ، وآلام في العضلات ، والسعال.[2] قد تشمل الآثار الجانبية الشديدة أمراض الرئة المناعية أو الأمعاء أو الكبد أو الكلى أو الجلد أو مشاكل الغدد الصماء المرتبطة بالمناعة.[2] الاستخدام خلال فترة الحمل قد يؤذي الطفل ويستخدم عندما لا يوصى بالرضاعة الطبيعية.[2] نيڤولوماب هو جسم مضاد وحيد النسيلة IgG4 البشري يمنع PD-1.[2] إنه نوع من المعالجة المناعية ويعمل كمثبط لنقطة الفحص ، حيث يحجب الإشارة التي تمنع تنشيط الخلايا التائية من مهاجمة السرطان.[2][1]
تمت الموافقة على نيڤولوماب للاستخدام الطبي في الولايات المتحدة في عام 2014.[2] وهي مدرجة في قائمة منظمة الصحة العالمية للأدوية الأساسية ، وهي الأدوية الأكثر أمانًا والأكثر فعالية المطلوبة في النظام الصحي.[3] في المملكة المتحدة ، يكلف الخدمة الصحية الوطنية حوالي 5266 جنيه إسترليني شهريًا اعتبارًا من عام 2018.[4] في الولايات المتحدة ، يكلف هذا المبلغ حوالي 13556 دولارًا أمريكيًا اعتبارًا من عام 2019 ,[5] بينما في الصين حوالي 7000 دولار أمريكي.[6] وهي مصنوعة باستخدام خلايا مبيض الهامستر الصينية.[7]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الاستخدام الطبي
يستخدم نيڤولوماب كعلاج من الدرجة الأولى ميلانوما النقلي او غير القابل لاجراء عملية جراحية له بالاقتران مع إيبيليموماب إذا لم يكن السرطان لديه طفرة في BRAF,[8] وكعلاج من الدرجة الثانية للميلانوما غير القابل لاجراء عملية جراحية له بعد المعالجة ب إيبيليمومابو السرطان ذو طفرة BRAF ، مثبط BRAF.[8][9] كما أنه يستخدم لعلاج سرطان الرئة الحرشفية ذو الخلايا غير الصغيرة المنتشر مع تقدم مع أو بعد العلاج الكيميائي بالپلاتين ولعلاج سرطان الرئة صغير الخلايا[8][10] ويستخدم أيضًا كخط علاجي ثانٍ لسرطان خلايا الكلوية بعد فشل العلاج المضاد للعائية.[8]
.يستخدم نيڤولوماب أيضًا في سرطان الظهارة البولية الابتدائية أو الثانوية (النقيلي) ، وهو أكثر أشكال سرطان المثانة شيوعًا. يمكن وصفه للورم الموضعي المتقدم أو اذا كان الشكل النقيلي للحالة التي تعاني من تقدم المرض أثناء أو بعد العلاج الكيميائي بالپلاتين أو تتطور في غضون 12 شهرًا من العلاج الجديد أو العلاج المساعد مع االعلاج الكيميائي بالپلاتين.[11]
يبدو أن نيڤولوماب وغيره من مثبطات PD-1 فعالون في الأشخاص الذين يعانون من اورام ثانوية في الدماغ[12]وللسرطان في الأشخاص الذين يعانون من أمراض المناعة الذاتية.[13]
الاثار الجانبية
تحتوي علامة الدواء على تحذيرات فيما يتعلق بزيادة مخاطر الالتهاب الرئوي الوخيم المناعي الحاد في الرئتين والقولون والكبد والكلى (مع اختلال وظائف الكلى المصاحب) ، وكذلك قصور الغدة الدرقية المناعي (قصور الغدة الدرقية) وفرط الدرقية.[8] قصور الغدة الدرقية قد يؤثر على 8.5 ٪ وفرط الدرقية 3.7 ٪.[14] يحدث داء السكري المناعي الذاتي شبيهًا بمرض السكري النمط الأول في حوالي 2٪ من الأشخاص الذين عولجوا بالنيڤولوماب.[14]
Iفي تجارب سرطان الجلد ، حدثت الآثار الجانبية التالية في أكثر من 10 ٪ من الأشخاص وبصورة أكثر تكرارا مع العلاج الكيميائي وحده: طفح جلدي وحكة في الجلد ، والسعال ، والتهابات الجهاز التنفسي العلوي ، وذمة طرفية. الآثار الجانبية الأخرى المهمة سريريًا مع أقل من 10٪ من التكرار هي عدم انتظام ضربات القلب البطيني ، التهاب أجزاء العين (التهاب الجسم الهدبي) ، التفاعلات المرتبطة بالتسريب ، الدوار ، الاعتلال العصبي المحيطي والحسي ، تقشير الجلد ، التهاب احمراري للجلد عديد الأشكال ، البهاق ، والصدفية.[8]
Iفي تجارب سرطان الرئة ، حدثت الآثار الجانبية التالية في أكثر من 10 ٪ من الأشخاص وبصورة أكثر تكرارا مع العلاج الكيميائي وحده: التعب ، الضعف ، الوذمة ، الحمى ، ألم الصدر ، الألم العام ، ضيق التنفس ، السعال ، آلام العضلات والمفاصل ، انخفاض الشهية ، آلام البطن ، الغثيان والقيء ، الإمساك ، فقدان الوزن ، الطفح الجلدي ، وحكة في الجلد.[8]
كما تم اختلال مستويات الشوارد وعدد خلايا الدم.[8]
الحمل والرضاعة
الاستخدام أثناء الحمل سيضر الطفل على الأرجح ؛ انه من غير المعروف ما إذا كان النيڤولوماب يفرز في حليب الأم.[8]
الحرائك الدوائية
استنادًا إلى البيانات من 909 مريضًا ، يبلغ عمر النصف النهائي للنيڤولوماب 26.7 يومًا ، وتم الوصول إلى تركيزات الحالة المستقرة لمدة 12 أسبوعًا عند تناولها بمعدل 3 مجم / كجم كل أسبوعين .[8] العمر ، الجنس ، العرق ، خط الأساس LDH ، عرض PD-L1 ، نوع الورم ، حجم الورم ، اختلال كلوي ، وقصور كبدي خفيف لا تؤثر على إزالة الدواء .[8]
الية العمل
الخلايا التائية تحمي الجسم من السرطان عن طريق قتل بعض الخلايا السرطانية. لكن الخلايا السرطانية تطور البروتينات لحماية نفسها من الخلايا التائية. النيڤولوماب يمنع تلك البروتينات الواقية. وبالتالي ، يمكن للخلايا التائية أن تقتل الخلايا السرطانية.[15][16]وهذا مثال على الحصار المناعي لنقاط الفحص.[15][16]
P1 هو بروتين على سطح الخلايا التائيةالتي تم تنشيطها. إذا كان جزيء آخر ، يسمى موت الخلية المبرمج 1 لجين 1 أو موت خلية مبرمج 1 لجين 2 (PD-L1 أو PD-L2) ، يرتبط بـ PD-1 ، تصبح الخلية T غير نشطة. هذه هي إحدى الطرق التي ينظم بها الجسم الجهاز المناعي ، لتجنب الإفراط في رد الفعل .[16] , العديد من الخلايا السرطانية تصنع PD-L1 ، الذي يمنع الخلايا التائية من مهاجمة الورم. يمنع نيڤولوماب PD-L1 من الربط بـ PD-1 ، مما يسمح لخلية T بالعمل.[15][16] Pيتم عرض PD-L1 في 40-50 ٪ من الميلانوما وله عرض محدود في خلاف ذلك في معظم الأعضاء الحشوية باستثناء الظهارة التنفسية والأنسجة المشيمة.[9]
الخواص الفيزيائية
عبارة عن جسم مضاد وحيد الغلوبيولين المناعي البشري وحيد النسيلة g4 بالكامل لـ PD-1.[9] سلسلة غاما 1 الثقيلة هي 91.8 ٪ تصميم بشري غير معدل بينما سلسلة كابا الخفيفة 98.9 ٪<[17]
التاريخ
تم اكتشافه في Medarex ، تم تطويره بواسطة Medarex و Ono Pharmaceutical ، وتم طرحه في السوق بواسطة بريستول-مايرز سكويب (التي اشترت Medarex في 2009) و Ono.
;تم اختراع نيڤولوماب بواسطة الدكتور تشانجو وانج وفريقه من العلماء في Medarex باستخدام الفئران المعدلة وراثيا في Medarex مع نظام مناعي إنساني ؛ تم اكتشاف الأجسام المضادة و توصيفها في المختبر ، والذي كان يطلق عليه في الأصل MDX-1106 ، (في وقت لاحق كثيرًا) في عام4. [18] رخصت Medarex الحقوق اليابانية في نيڤولوماب لشركة Ono Pharmaceutical في عام 2005 .[19] حصلت بريستول مايرز سكويب على Medarex في عام 2009 مقابل 2.4 مليار دولار ، إلى حد كبير على قوة برنامج مثبط نقاط الفحص .[20][21]
نتائج التجارب السريرية الواعدة التي تم الإعلان عنها في عام 2012 ، تسببت في إثارة بين المحللين في الصناعة وفي وسائل الإعلام الرئيسية ؛ كان يجري السعي وراء تطوير PD-1 كهدف بيولوجي في ذلك الوقت ، مع شركات من بينها مرك مع پمبروليزوماب (كيترودا) و روش (عبر فرعها جينين تك) مع اتيزوليزوماب و گلاكسو سميث كلاين بالتعاون مع شركة ماري لاند بيو تك و Amplimmune ؛ وتيفا بالتعاون مع شركة التكنولوجيا الحيوية الإسرائيلية كير تك المنافسة.[22][23]
تلقى أونو موافقة من السلطات التنظيمية اليابانية لاستخدام نيفولوماب لعلاج سرطان الجلد غير القابل للازالة في يوليو 2014 ، الذي كان أول موافقة تنظيمية لمثبط PD-1 في أي مكان في العالم.[19]
تلقت ميرك أول موافقة من إدارة الأغذية والدواء FDA لمثبط PD-1 پمبروليزوماب (كيترودا) ، في سبتمبر 2014.[24]
تلقى نيڤولوماب موافقة إدارة الأغذية والدواء (FDA) لعلاج الميلانوما في ديسمبر 2014.[9][25] في أبريل 2015 ، أوصت لجنة المنتجات الطبية للاستخدام البشري وكالة الأدوية الأوروپية بالموافقة على نيڤولوماب لعلاج الميلانوما النقيلي كعلاج وحيد.[26]
Iفي مارس 2015 ، وافقت عليه ادارة الغذاء والدواء الأمريكية لعلاج سرطان الرئة الحرشفية.[27]
في 19 يونيو 2015 ، منحت المفوضية الأوروپية ترخيص تسويق ساري المفعول في جميع أنحاء الاتحاد الأوروپي.[28]
في نوفمبر 2015 ، وافقت ادارة الغذاء والدواء على نيڤولوماب كعلاج من الدرجة الثانية لسرطان خلايا الكلى بعد منحها العلاج الاختراقي التطبيقي ، وتعيين التصميم السريع ، ومراجعة ذات اولوية .[29]
في مايو 2016 ، وافقت إدارة الغذاء والدواء على عقار نيڤولوماب لعلاج مرضى لمفومة هودجكن الكلاسيكية (cHL) الذين انتكسوا أو تقدموا بعد عملية زرع الخلايا الجذعية المكونة للدم ذاتيًا (Auto-HSCT) و (برنتوكسيماب فيدوتين) بعد زرعه.[30]
في 20 ديسمبر 2017 ، منحت إدارة الغذاء والدواء FDA موافقة على نيڤولوماب للعلاج المساعد للميلانوما التي تتضمن الغدد الليمفاوية أو لمرض نقيلي مع استئصال تام.[31]
في 16 أبريل 2018 ، منحت إدارة الغذاء والدواء موافقة على نيڤولوماب بالاشتراك مع إيبيليموماب لعلاج الدرجة الأولي من مرضى سرطان الخلايا الكلوية ذات المخاطر المتقدمة المتوسطة والضعيفة .[32]
في 15 يونيو 2018 ، وافقت إدارة العقاقير الصينية على نيڤولوماب ، أول علاج للأورام المناعية في البلاد وأول علاج ل PD-1.[33]
البحث العلمي
لمفومة هودجكن
في لمفومة هودجكن، خَلاَيا ريد شتيرنبِيرْغ هي الملجأ لتضخيم الكروموسوم 9p 24.1 ، الذي يشفر PD-L1 و PD-L2 ويؤدي إلى عرضهم القوامي. في دراسة سريرية صغيرة نُشرت في عام 2015 ، أثار نيڤولوماب معدل استجابة موضوعي قدره 87 ٪ في مجموعة من 20 مريضا.[22]
العلامات الحيوية
تضخم الكروموسوم 9p24 قد يكون بمثابة علامة بيولوجية تنبؤية في ليمفومة هودجكين.[22]
تقوم كل شركة بملاحقة الجسم المضاد وحيد النسيلة ضد PD-1 مثل المقايسات التي تم تطويرها لقياس مستويات PD-L1 كمؤشر حيوي محتمل يستخدم عقاقيره ككاشف خاص بالتحليل في الاختبار. BMS شراكة مع داكو في مقايسة المعتمدة إلى نيڤولوماب. ومع ذلك ، واعتبارًا من عام 2015 ، أدى تعقيد الاستجابة المناعية إلى إعاقة الجهود المبذولة لتحديد الأشخاص الذين من المحتمل أن يستجيبوا جيدًا لمثبطات PD-1;[22] على وجه الخصوص ، يبدو أن مستويات PD-L1 ديناميكية ومعدلة بعدة عوامل ، فشلت الجهود المبذولة لربط مستويات PD-L1 قبل أو أثناء العلاج باستجابة العلاج أو مدة الاستجابة في الكشف عن أي ارتباطات مفيدة اعتبارًا من عام 2015.[9]
سرطان الرئة
في عام 2016 ، أعلنت BMS نتائج تجربة سريرية فشل فيها نيڤولوماب في الوصول إلى نقطة النهاية ولم يكن أفضل من العلاج الكيميائي التقليدي في علاج سرطان الرئة الذي تم تشخيصه حديثًا.[34] Bواصلت BMS في محاولة للحصول على موافقة على الجمع بين العلاج ضد سرطان الرئة والتي تضمنت نيڤولوماب و إيبيليموماب الذي يعد أقدم ادوية BMS. تم سحب الطلب في أوائل عام 2019 بعد بيانات التجارب السريرية المخيبة للآمال .[35]
يبدو أن أوقات التسريب التي تستغرق 60 دقيقة و 30 دقيقة تحتوي على حرائك دوائية مماثلة (الامتصاص ، التوزيع ، التمثيل الغذائي ، وازالة) للعلاج .[36]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
ميلانوما
يتم عرض PD-L1 في 40-50 ٪ من الميلانوما.[37] أظهرت التجارب السريرية في المرحلتين الأولى والثانية أن نيفولوماب كخيار علاج دائم واعد في الميلانوما كعامل وحيد وفي اتحاد مع إيبيليموماب.[38] تجارب المرحلة الثالثة مازالت جارية.
المصادر
- ^ أ ب "Nivolumab (Opdivo) | Cancer information | Cancer Research UK". www.cancerresearchuk.org. Retrieved 15 December 2019.
- ^ أ ب ت ث ج ح خ د ذ "Nivolumab Monograph for Professionals". Drugs.com (in الإنجليزية). Retrieved 14 November 2019.
- ^ World Health Organization model list of essential medicines: 21st list 2019. World Health Organization (WHO). 2019.
- ^ British national formulary : BNF 76 (76 ed.). Pharmaceutical Press. 2018. p. 852. ISBN 9780857113382.
- ^ "Opdivo Prices, Coupons & Patient Assistance Programs". Drugs.com (in الإنجليزية). Retrieved 14 November 2019.
- ^ "Bristol-Myers will sell Opdivo in China at half of US cost, setting precedent for checkpoint wave — report". Endpoints News (in الإنجليزية). Retrieved 2019-09-09.
- ^ Rajan A, Kim C, Heery CR, Guha U, Gulley JL (September 2016). "Nivolumab, anti-programmed death-1 (PD-1) monoclonal antibody immunotherapy: Role in advanced cancers". Human Vaccines & Immunotherapeutics. 12 (9): 2219–31. doi:10.1080/21645515.2016.1175694. PMC 5027703. PMID 27135835.
- ^ أ ب ت ث ج ح خ د ذ ر ز Nivolumab Label. Last updated November 2015.
- ^ أ ب ت ث ج Johnson DB, Peng C, Sosman JA (March 2015). "Nivolumab in melanoma: latest evidence and clinical potential". Therapeutic Advances in Medical Oncology. 7 (2): 97–106. doi:10.1177/1758834014567469. PMC 4346215. PMID 25755682.
- ^ Sundar R, Cho BC, Brahmer JR, Soo RA (March 2015). "Nivolumab in NSCLC: latest evidence and clinical potential". Therapeutic Advances in Medical Oncology. 7 (2): 85–96. doi:10.1177/1758834014567470. PMC 4346216. PMID 25755681.
- ^ Bushey, R. Gains FDA Approval for Common Bladder Cancer. Drug Discovery & Development, Fri, 02/03/2017.
- ^ Caponnetto S, Draghi A, Borch TH, Nuti M, Cortesi E, Svane IM, Donia M (May 2018). "Cancer immunotherapy in patients with brain metastases". Cancer Immunology, Immunotherapy. 67 (5): 703–711. doi:10.1007/s00262-018-2146-8. hdl:11573/1298742. PMID 29520474.
- ^ Donia M, Pedersen M, Svane IM (April 2017). "Cancer immunotherapy in patients with preexisting autoimmune disorders". Seminars in Immunopathology. 39 (3): 333–337. doi:10.1007/s00281-016-0595-8. PMID 27730287.
- ^ أ ب de Filette J, Andreescu CE, Cools F, Bravenboer B, Velkeniers B (March 2019). "A Systematic Review and Meta-Analysis of Endocrine-Related Adverse Events Associated with Immune Checkpoint Inhibitors". Hormone and Metabolic Research = Hormon- und Stoffwechselforschung = Hormones et Metabolisme. 51 (3): 145–156. doi:10.1055/a-0843-3366. PMID 30861560.
- ^ أ ب ت Pardoll DM (March 2012). "The blockade of immune checkpoints in cancer immunotherapy". Nature Reviews. Cancer. 12 (4): 252–64. doi:10.1038/nrc3239. PMC 4856023. PMID 22437870.
- ^ أ ب ت ث Syn NL, Teng MW, Mok TS, Soo RA (December 2017). "De-novo and acquired resistance to immune checkpoint targeting". The Lancet. Oncology. 18 (12): e731–e741. doi:10.1016/s1470-2045(17)30607-1. PMID 29208439.
- ^ WHO Drug Information, Vol. 26, No. 2, 2012. Proposed INN List 107
- ^ Wang C, Thudium KB, Han M, Wang XT, Huang H, Feingersh D, et al. (September 2014). "In vitro characterization of the anti-PD-1 antibody nivolumab, BMS-936558, and in vivo toxicology in non-human primates". Cancer Immunology Research. 2 (9): 846–56. doi:10.1158/2326-6066.CIR-14-0040. PMID 24872026.
- ^ أ ب John Carroll for FierceBiotech 7 Jul 2014 Anti-PD-1 cancer star nivolumab wins world's first regulatory approval
- ^ Allison M (September 2009). "Bristol-Myers Squibb swallows last of antibody pioneers". Nature Biotechnology. 27 (9): 781–3. doi:10.1038/nbt0909-781. PMID 19741612.
- ^ John Carroll for FierceBiotech 23 Jul 2009 Bristol-Myers to buy Medarex for $2.1B
- ^ أ ب ت ث Sharma P, Allison JP (April 2015). "The future of immune checkpoint therapy". Science. 348 (6230): 56–61. Bibcode:2015Sci...348...56S. doi:10.1126/science.aaa8172. PMID 25838373.
- ^ A Pollack (June 2012). "Drug helps immune system fight cancer". New York Times.
- ^ "FDA approves Keytruda for advanced melanoma" (Press release). U.S. Food and Drug Administration. 4 September 2014. Retrieved 24 December 2015.
- ^ "FDA approves Opdivo for advanced melanoma" (Press release). Food and Drug Administration. 22 December 2014.
- ^ "Press Release: New treatment for advanced melanoma". European Medicines Agency. Retrieved 5 May 2015.
- ^ "FDA expands approved use of Opdivo to treat lung cancer" (Press release). Retrieved 4 March 2015.
- ^ [1][dead link]
- ^ FDA. 23 November 2015 FDA Press Release: FDA approves Opdivo to treat advanced form of kidney cancer
- ^ Center for Drug Evaluation and Research (9 February 2019). "Approved Drugs - Nivolumab (Opdivo) for Hodgkin Lymphoma". FDA.
- ^ Center for Drug Evaluation and Research. "Approved Drugs - FDA grants regular approval to nivolumab for adjuvant treatment of melanoma". www.fda.gov (in الإنجليزية). Retrieved 2018-04-12.
- ^ Center for Drug Evaluation and Research. "Approved Drugs - FDA approves nivolumab plus ipilimumab combination for intermediate or poor-risk advanced renal cell carcinoma". www.fda.gov n. Retrieved 2018-04-20.
- ^ "Bristol-Myers' Opdivo ushers in a new era as the first I-O therapy approved in China | FiercePharma". www.fiercepharma.com (in الإنجليزية). Retrieved 2018-06-19.
- ^ Loftus, Peter; Rockoff, Jonathan D.; Steele, Anne (2016-08-05). "Bristol Myers: Opdivo Failed to Meet Endpoint in Key Lung-Cancer Study". Wall Street Journal. ISSN 0099-9660. Retrieved 2016-08-21.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Erman, Michael (24 January 2019). "Bristol-Myers has Opdivo lung cancer setback as sales beat estimates". Reuters. Retrieved 24 January 2019.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Waterhouse. "Safety profile of nivolumab administered as 30-minute infusion: Analysis of data from CheckMate 153" (PDF).
- ^ Dong H, Strome SE, Salomao DR, Tamura H, Hirano F, Flies DB, et al. (August 2002). "Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion". Nature Medicine. 8 (8): 793–800. doi:10.1038/nm730. PMID 12091876.
- ^ Johnson DB, Peng C, Sosman JA (March 2015). "Nivolumab in melanoma: latest evidence and clinical potential". Therapeutic Advances in Medical Oncology. 7 (2): 97–106. doi:10.1177/1758834014567469. PMC 4346215. PMID 25755682.
وصلات خارجية
- Articles with dead external links from June 2019
- CS1 errors: unsupported parameter
- Template:drugs.com link with non-standard subpage
- Chemicals that do not have a ChemSpider ID assigned
- Infobox-drug molecular-weight unexpected-character
- Pages using infobox drug with unknown parameters
- Infobox drug articles with non-default infobox title
- Articles without EBI source
- Chemical pages without DrugBank identifier
- Articles without InChI source
- Articles without UNII source
- Drugs with no legal status
- Drug has EMA link
- Articles containing unverified chemical infoboxes
- Drugs that are a monoclonal antibody
- أدوية مضادة للأورام
- علاجات اختراقية
- بريستول-مايرز سكويب
- أجسام مضادة وحيدة النسيلة لعلاج الأورام
- أجسام مضادة وحيدة النسيلة
- الأدوية الأساسية حسب منظمة الصحة العالمية
- RTT