نتريد الكالسيوم
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
نتريد الكالسيوم
| |
| المُعرِّفات | |
| رقم CAS | |
| ECHA InfoCard | 100.031.435 |
PubChem CID
|
|
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | Ca3N2 |
| كتلة مولية | 148.25 غ/مول |
| المظهر | بلورات حمراء بنية |
| الكثافة | 2.670 غ/سم3 |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | يتفكك |
| المخاطر | |
تبويب الاتحاد الاوروپي (DSD)
|
 F F
|
| توصيف المخاطر | R11-R29-R34 |
| تحذيرات وقائية | S16-S22-S26-S36/37/39-S45 [1] |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
نتريد الكالسيوم مركب كيميائي له الصيغة Ca3N2، ويكون على شكل بلورات حمراء بنية.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص
- يتفاعل نتريد الكالسيوم مع الماء في تفاعل حلمهة حيث يتشكل الأمونياك وهيدروكسيد الكالسيوم.
- Ca3N2 + 6 H2O → 3 Ca(OH)2 + 2 NH3
- يمتص نتريد الكالسيوم غاز الهيدروجين عند درجات حرارة تفوق 350°س. [2]
- Ca3N2 + 2 H2 → 2 CaNH + CaH2
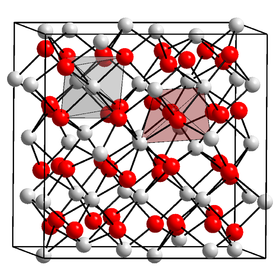
البنية
لمركب نتريد الكالسيوم عدة أشكال، أكثرها توافراً هو الشكل ألفا α-Ca3N2، والذي له بنية معاكسة للبكسبيت bixbyite المشابه لبنية Mn2O3، أي أن مواقع الأيونات تكون متعاكسة، حيث تحل أيونات الكالسيوم (2+Ca) موقع الأكسيد (O2−)، وتحل أيونات النتريد (N3−) مكان أيونات المنغنيز (3+Mn).
التحضير
ينتج نتريد الكالسيوم كناتج ثانوي عند حرق فلز الكالسيوم في الهواء بجانب الناتج الرئيسي وهو أكسيد الكالسيوم. كما ينتج من التفاعل المباشر للعناصر المكونة عند درجات حرارة مرتفعة.
- 3 Ca + N2 → Ca3N2
المراجع
- ^ http://www.sigmaaldrich.com/catalog/ProductDetail.do?N4=415103%7CALDRICH&N5=SEARCH_CONCAT_PNO%7CBRAND_KEY&F=SPEC
- ^ Heyns, A (1998). "The Vibrational Spectra and Decomposition ofα-Calcium Nitride (α-Ca3N2) and Magnesium Nitride (Mg3N2)". Journal of Solid State Chemistry. 137: 33. doi:10.1006/jssc.1997.7672.