فوران (مركب كيميائي)
|
| |||
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك المفضل
Furan[2] | |||
| اسم أيوپاك النظامي
Oxoline | |||
| أسماء أخرى
Oxole
1,4-Epoxybuta-1,3-diene 1,4-Epoxy-1,3-butadiene 5-Oxacyclopenta-1,3-diene 5-Oxacyclo-1,3-pentadiene Furfuran Furane (misspelling)[1] Divinylene oxide | |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.390 | ||
| KEGG | |||
PubChem CID
|
|||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | C4H4O | ||
| كتلة مولية | 68.07 g mol-1 | ||
| المظهر | سائل متطاير عديم اللون | ||
| الكثافة | 0.936 گ/م.ل. | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| القابلية المغناطيسية | -43.09·10−6 cm3/مول | ||
| المخاطر | |||
| صفحة بيانات السلامة | Pennakem | ||
| توصيف المخاطر | R26/27/28, R45 | ||
| تحذيرات وقائية | S16, S37, S45, S28 | ||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | −69 °C (−92 °F; 204 K) | ||
| 390 °C (734 °F; 663 K) | |||
| حدود الانفجار | الأدنى: 2.3% الأقصى: 14.3% عند درجة حرارة 20 °س | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
> 2 g/kg (rat) | ||
| مركبات ذا علاقة | |||
المركبات الحلقية الغير متجانسة ذات العلاقة
|
پيرول ثيوفين | ||
مركـّبات ذات علاقة
|
Tetrahydrofuran (THF) 2,5-Dimethylfuran Benzofuran Dibenzofuran | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
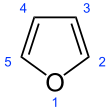
الفوران Furan، هو مركب عضوي حلقي غير متجانس، يتكون من حلقة عطرية خماسية بأربع ذرات كربون وذرة أكسجين. المركبات الكيميائية التي تحتوي على مثل هذه الحلقات يشار إليها أيضاً بالفورانات.
الفوران هو سائل عديم اللون، [[قابلية الاشتعال قابل للاشتعال]]، شديد التطاير تقترب نقطة غليانه من درجة حرارة الغرفة. وهو قابل للذوبان في المذيبات العضوية الشائعة، ومنها الكحول، الإثير، والأسيتون، وهو قليل الذوبان في الماء.[3] ويعتبر الفوران مركباً ساماً وقد يكون مسرطناً في البشر. يستخدم الفوران كنقطة بادئة للكيماويات المتخصصة.[4]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
اسم "الفوران" مشتق من اللاتينية furfur، وتعني المخ.[5] عام 1780 وصف كارل ڤلهلم شيل أول مشتق للفوران والذي أطلق عليه حمض الفوريك-2. وهناك مشتق هام آخر للفوران وهو الفورفورال، والذي وصفه يوهان ڤولفگانگ دوبراينر عام 1831 وبعد تسع سنوات حدد خصائصه جون ستنهاوس. أما الفوران نفسه فقط قام بتحضيره لأول مرة هنريش ليمپريشت عام 1870، بالرغم من أنه كان يطلق عليه اسم "ثلاثي الفينول" (حيث أن هناك أربع ذرات كربون مرتبطة بالفينول، C6H6O).[6][7]
الخواص
- الفوران مركب عطري (أروماتي)، لديه ستة إلكترونات من النمط باي π، أربعة منها للرابطتين المضاعفتين والاثنان الباقيان هما الزوج الإلكتروني لذرة الأكسجين، فهو يحقق قاعدة هوكل.
- الفوران مركب متطاير حيث أن لديه ضغط بخار مرتفع، لذا درجة غليانه منخفضة 32 °س فقط. له رائحة تشبه رائحة الكلوروفورم.
- الفوران ضعيف الانحلال في الماء لكنه ينحل في أغلب المحلات العضوية الأخرى.
تحضير الفوران
يحضر من الفورفورال بالأكسدة، من ثم تنزع مجموعة الكربوكسيل من حمض الفوران-2 الكربوكسيلي.
الكيمياء
السلامة
انظر أيضاً
- BS 4994 – Furan resin as thermoset FRP for chemical process plant equipments
- Furanoflavonoid
- فورانوز
- Furantetracarboxylic acid
- الحلقات العطرية البسيطة
- الأحماض الدهنية الفورانية
المصادر
- ^ Webster's Online Dictionary
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 392. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Jakubke, Hans Dieter; Jeschkeit, Hans (1994). Concise Encyclopedia of Chemistry. Walter de Gruyter. pp. 1–1201. ISBN 0-89925-457-8.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةullmann - ^ Senning, Alexander (2006). Elsevier's Dictionary of Chemoetymology. Elsevier. ISBN 0-444-52239-5.
- ^ Limpricht, H. (1870). "Ueber das Tetraphenol C4H4O". Berichte der deutschen chemischen Gesellschaft. 3 (1): 90–91. doi:10.1002/cber.18700030129.
- ^ Rodd, Ernest Harry (1971). Chemistry of Carbon Compounds: A Modern Comprehensive Treatise. Elsevier.