رباعي هيدرو فوران
|
| |||

| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
Oxolane
| |||
| أسماء أخرى
THF, tetrahydrofuran, 1,4-epoxybutane, butylene oxide, cyclotetramethylene oxide, oxacyclopentane, diethylene oxide, furanidine, hydrofuran, tetra-methylene oxide
| |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.389 | ||
PubChem CID
|
|||
| رقم RTECS |
| ||
CompTox Dashboard (EPA)
|
|||
| الخصائص | |||
| الصيغة الجزيئية | C4H8O | ||
| كتلة مولية | 72.1 g mol-1 | ||
| المظهر | سائل شفاف | ||
| الرائحة | ether-like[1] | ||
| الكثافة | 0.8892 گ/سم3 @ 20 °س، سائل | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | قابل للمزج | ||
| ضغط البخار | 132 mmHg (20°س)[1] | ||
| اللزوجة | 0.48 cP عند 25 °س | ||
| البنية | |||
| الشكل الجزيئي | envelope | ||
| Dipole moment | 1.63 D (غاز) | ||
| المخاطر | |||
تبويب الاتحاد الاوروپي (DSD)
|
قابل للاشتعال (F) مهيج (Xi) | ||
| توصيف المخاطر | R11, R19, R20/21/22, R36/37 | ||
| تحذيرات وقائية | S16, قالب:S29, قالب:S33 | ||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | −14 °C (7 °F; 259 K) | ||
| حدود الانفجار | 2%-11.8%[1] | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
1650 mg/kg (جرذان، فموي) 2300 mg/kg (جرذان، فموي) 2300 mg/kg (خنزير غينيا، فموي)[2] | ||
LC50 (التركيز الأوسط)
|
21000 ppm (rat, 3 hr)[2] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
TWA 200 ppm (590 mg/m3)[1] | ||
REL (الموصى به)
|
TWA 200 ppm (590 mg/m3) ST 250 ppm (735 mg/m3)[1] | ||
IDLH (خطر عاجل)
|
2000 ppm[1] | ||
| مركبات ذا علاقة | |||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
رباعي هيدرو الفوران Tetrahydrofuran (يرمز له اختصاراً THF)، هو مركب كيميائي له الصيغة C4H8O، وهو من المذيبات العضوية. يوجد المركب على شكل سائل عديم اللون في الشروط العادية من درجة الحرارة والضغط. ينتمي المركب إلى الإيثرات الحلقية.
الخصائص
الفيزيائية
رباعي هيدرو الفوران سائل عديم اللون، قابل للاشتعال، له رائحة تشبه الإيثر. يمتزج المركب مع الماء حتى درجة الحرارة 71.8 °س وذلك بشكل كامل، إلا أنه فوق تلك الدرجة تظهر بوادر عدم الامتزاج وذلك إلى الدرجة 137.1°س، حيث يعود الامتزاج إلى كماله.[4][5] يمتزج رباعي هيدرو الفوران مع باقي المذيبات العضوية مثل الإيثانول والأسيتون والإيثر الإيثيلي.
يشكل رباعي هيدرو الفوران عندما يكون محتواه من الماء 19.9 % مولي مزيجاً ثابت الغليان (أزيوتروبي) عند الدرجة 63.8°س.[6] أما مع الكحولات فإن المزائج ثابتة الغليان لا تحدث إلا مع الإيثانول والميثانول عند الضغط الجوي، [7] أما الكحولات ذات السلسة الكربونية الأطول مثل 1-بروبانول و2-بروبانول فهي ليست ثابتة الغليان.[7] في حين أنه عند ضغوط منخفضة فإن الإيثانول مثلاُ لا يظهر خاصية ثباتية الغليان مع رباعي هيدرو الفوران.[8]
الكيميائية
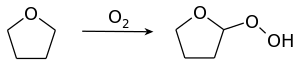
كما يحدث مع الإيثرات فإن رباعي هيدرو الفوران يشكل مركبات فوق الأكاسيد عن طريق الأكسدة الذاتية جراء التعرض لأكسجين الهواء ومن أثر الأشعة فوق البنفسجية. لذلك ينصح قبل إجراء عملية تقطير المذيب حال استخدام رباعي هيدرو الفوران إجراء اختبار لمعرفة نسبة فوق الأكاسيد، كما ينصح بإضافة هيدروكسيد البوتاسيوم الصلب.
يؤدي تسخين رباعي هيدرو الفوران بوجود حمض الهيدروكلوريك إلى تفككه أولا إلى 4-كلور البوتانول ثم إلى 4،1-ثنائي كلور البوتان.[9]
التحضير
إحدى طرق تحضير رباعي هيدرو الفوران تتضمن إجراء عملية بلمهة محفزة حمضياً لمركب 4،1-بوتانديول، وذلك بشكل مشابه لطريقة تحضير ثنائي إيثيل الإيثر من الإيثانول. يحصل على بوتانديول من إضافة كربوكسيل إلى الأسيتيلين ثم بإجراء عملية هدرجة. طورت شركة دو بونت طريقة لتحضير رباعي هيدرو الفوران من أكسدة نظامي البوتان إلى بلاماء الماليك متبوعاً بعملية هدرجة حفزية.[10] كما يمكن التحضير من إجراء تفاعل أوكسو للكحول الأليلي ثم بالهدرجة للبوتانديول.
بالمقابل يمكن تحضير رباعي هيدرو الفوران من هدرجة الفوران.[11][12] يمكن الحصول على الفوران من البنتوز، وهذ الطريقة يمكن أن تتضمن استخدام مصادر متجددة. على الرغم من ذلك فإن وسيلة التحضير هذه غير منتشرة على نطاق واسع.
التطبيقات
يستخدم رباعي هيدرو الفوران بشكل واسع في الصناعة كمذيب لبولي فينيل كلوريد وللورنيش.[13] يعد رباعي هيدرو الفوران من المذيبات اللابروتونية وقطبيته متوسطة، بحيث أنه يمكنه حل عدد كبير من المركبات الكيميائية القطبية واللاقطبية.[14] يستخدم رباعي هيدرو الفوران أيضاً كمذيب للمركبات العضوية الفلزية مثل مركبات الليثيوم العضوية وكواشف غرينيار.[15]
كمذيب
التنقية
| عامل التجفيف | مدة التجفيف | المحتوى المائي |
|---|---|---|
| لا يوجد | 0 ساعة | 108 ppm |
| Sodium/benzophenone | 48 h | 43 ppm |
| 3 A molecular sieves (20% by volume) | 72 h | 4 ppm |
الاستخدامات والأبحاث المحتملة
استخدامات أخرى
ميثال رباعي الهيدرو فوران-2
الاحتياطات
انظر أيضاً
المصادر
- ^ أ ب ت ث ج ح NIOSH Pocket Guide to Chemical Hazards 0602
- ^ أ ب "Tetrahydrofuran". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ http://www.newenv.com/resources/nfpa_chemicals/#S
- ^ J. Matous, J. Hrancirik, J. P. Novak, J. Sobr: Liquid-liquid equilibrium in the system water-tetrahydrofuran, in: Coll. Czech. Chem. Commun. 1970, 35, 1904–1905.
- ^ J. Matous, J. P. Novak, J. Sobr, J. Pick: Liquid-liquid equilibrium in the system water-tetrahydrofuran (2), in: Coll. Czech. Chem. Commun 1972, 37, 2653–2663.
- ^ W. Hayduk, H. Laudie, O. H. Smith: Viscosity, freezing point, vapor-liquid equilibriums, and other properties of aqueous-tetrahydrofuran solutions, in: J. Chem. Eng. Data 1973 18 (4), 373–376; doi:10.1021/je60059a027.
- ^ أ ب Yoshio Yoshikawa, Akira Takagi, Masahiro Kato: Indirect Determination of Vapor-Liquid Equilibria by a Small Ebulliometer. Tetrahydrofuran-Alcohol Binary Systems, in: J. Chem. Eng. Data 1980, 25 (4), 344–346; doi:10.1021/je60087a017.
- ^ E. Brunner, A. G. R. Scholz: Isobaric vapor-liquid equilibria of the tetrahydrofuran/ethanol system at 25, 50, and 100 kPa, in: J. Chem. Eng. Data 1984, 29 (1), 28-31; doi:10.1021/je00035a011.
- ^ Autorenkollektiv: Organikum, 22. Auflage, Wiley-VCH, 2004, ISBN 978-3-527-31148-4.
- ^ Merck Index of Chemicals and Drugs, 9th ed.
- ^ Morrison, Robert Thornton; Boyd, Robert Neilson: Organic Chemistry, 2nd ed., Allyn and Bacon 1972, p. 569
- ^ قالب:OrgSynth
- ^ Herbert Müller, "Tetrahydrofuran" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a26_221
- ^ "Chemical Reactivity". Cem.msu.edu. Retrieved 2010-02-15.
- ^ Elschenbroich, C.; Salzer, A. ”Organometallics : A Concise Introduction” (2nd Ed) (1992) Wiley-VCH: Weinheim. ISBN 3-527-28165-7
مصادر عامة
- Loudon, G. Mark. Organic Chemistry 4th ed. New York: Oxford University Press. 2002. pg 318