سيليسيد المغنيسيوم
| |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك المفضل
Magnesium silicide | |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.041.125 |
| رقم EC |
|
PubChem CID
|
|
| UNII | |
| UN number | 2624 |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | Mg2Si |
| كتلة مولية | 76.7 g mol-1 |
| المظهر | Gray cubic crystals[1] |
| الكثافة | 1.99 g cm−3[1] |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | reacts[1] |
| البنية | |
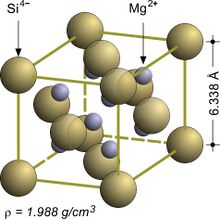
| البنية البلورية | Antifluorite (cubic), cF12 |
| الزمرة الفراغية | Fm3m, #225 |
| ثابت العقد | a = 0.6351 nm |
| المخاطر | |
| خطر رئيسي | reacts with water to produce pyrophoric silane |
| ن.م.ع. مخطط تصويري | 
|
| ن.م.ع. كلمة الاشارة | Warning |
| H261 | |
| P231+P232, P280, P370+P378, P402+P404, P501 | |
| مركبات ذا علاقة | |
كاتيونات أخرى
|
سيليسيد الكالسيوم |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
سيليسيد المغنيسيوم, Mg2Si, is an inorganic compound consisting of magnesium and silicon. As-grown Mg2Si usually forms black crystals; they are semiconductors with n-type conductivity and have potential applications in thermoelectric generators.[2]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
البنية البلورية
Mg2Si crystallizes in the antifluorite structure. In the face-centered cubic lattice Si centers occupy the corners and face-centered positions of the unit cell and Mg centers occupy eight tetrahedral sites in the interior of the unit cell. The coordination numbers of Si and Mg are eight and four, respectively.[3]
التخليق
It can be produced by heating silicon dioxide, SiO2, found in sand, with excess magnesium. The process first forms silicon metal and magnesium oxide, and, if an excess of SiO2 is used, then elemental silicon is formed:
- 2 Mg + SiO2 → 2 MgO + Si
If an excess of Mg is present, Mg2Si is formed from the reaction of the remaining magnesium with the silicon:
- 2 Mg + Si → Mg2Si
These reactions proceed exothermically,[4] even explosively.[5]
التفاعلات
Magnesium silicide can be viewed as consisting of Si4− ions. As such it is reactive toward acids. Thus, when magnesium silicide is treated with hydrochloric acid, silane (SiH4) and magnesium chloride are produced:
- Mg2Si + 4 HCl → SiH4 + 2 MgCl2
Sulfuric acid can be used as well. These protonolysis reactions are typical of a group 2 (alkaline earth metal) and group 1 (alkali metal) silicides. The early development of silicon hydrides relied on this reaction.[5]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الاستخدامات
Magnesium silicide is used to create aluminium alloys of the 6000 series, containing up to approximately 1.5% Mg2Si. An alloy of this group can be age-hardened to form Guinier-Preston zones and a very fine precipitate, both resulting in increased strength of the alloy.[6]
Magnesium silicide is a narrow-gap semiconductor. Its as-grown crystal exhibit n-type conductivity, but it can be changed to p-type by doping with Ag, Ga, Sn and possibly Li (at high doping level). The major potential electronic application of Mg2Si is in thermoelectric generators.[2][7]
المراجع
- ^ أ ب ت Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.74. ISBN 1439855110.
- ^ أ ب Hirayama, Naomi (2019). "Substitutional and interstitial impurity p-type doping of thermoelectric Mg2Si: a theoretical study". Sci. Technol. Adv. Mater. 20 (1): 160–172. Bibcode:2019STAdM..20..160H. doi:10.1080/14686996.2019.1580537. PMC 6419642. PMID 30891103.

- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةstr - ^ Ehrlich, P. (1963). "17". In Brauer, Georg (ed.). Handbook of Preparative Inorganic Chemistry (PDF) (in English). Vol. 1. Translated by Riley; Reed F. (2nd ed.). New York: Academic Press, Inc. p. 921. ISBN 978-0121266011. Retrieved 26 September 2024.
{{cite book}}: CS1 maint: unrecognized language (link) - ^ أ ب Stock, Alfred; Somieski, Carl (1916). "Siliciumwasserstoffe. I. Die aus Magnesiumsilicid und Säuren entstehenden Siliciumwasserstoffe". Berichte der Deutschen Chemischen Gesellschaft. 49: 111–157. doi:10.1002/cber.19160490114.
- ^ "Properties and Selection: Non-ferrous Alloys and Special Purpose Materials" in ASM Handbook, 10th ed., Vol. 1, 1990, ASM International, Materials Park, Ohio. ISBN 0871703785.
- ^ Borisenko, Victor E. (2013). Semiconducting Silicides: Basics, Formation, Properties. Springer Science & Business Media. pp. 187, 287. ISBN 978-3-642-59649-0.