ثنائي سيليسيد الكالسيوم
 hR9 unit cell
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Calcium disilicide
| |
| المُعرِّفات | |
| رقم CAS | |
| ChemSpider | |
PubChem CID
|
|
| الخصائص | |
| الصيغة الجزيئية | CaSi2 |
| كتلة مولية | 96.249 g/mol[1] |
| المظهر | grey solid[1] |
| الكثافة | 2.50 g/cm3[1] |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | insoluble |
| البنية | |
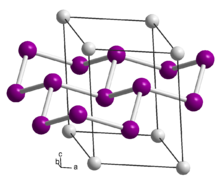
| البنية البلورية | Trigonal, hR9/hR18, |
| الزمرة الفراغية | R3m, No. 166 |
| ثابت العقد | a = 0.38295/0.3855 nm, c = 1.5904/3.06 nm |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
ثنائي سيليسيد الكالسيوم Calcium disilicide مركب كيميائي له الصيغة CaSi2، ويتكون من عنصري الكالسيوم والسيليسيوم (السيليكون). يتدرج أيضاً تحت اسم سيليسيد الكالسيوم المركبات التالية CaSi نقطة انصهاره 1220 °س، Ca2Si نقطة انصهاره 920 °س. وهو غير قابل للذوبان في الماء، ولكن قد يتحلل حين يتعرض للرطوبة التي قد تُطوِّر هيدروجين وينتج هيدروكسيد الكالسيوم. ويتحلل في الماء الساخن، وهو قابل للاشتعال وقد يشتعل تلقائياً في الهواء.
Industrial calcium silicide usually contains iron and aluminium as the primary contaminants، وكميات منخفضة من الكربون والكبريت.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص
- مركب سيليسيد الكالسيوم غير منحل في الماء، لكنه بتعرضه للرطوبة يتفكك ويتشكل هيدروكسيد الكالسيوم وغاز الهيدروجين، لذلك يعد من المواد القابلة للاشتعال.
- يتميز سيليسيد الكالسيوم بخواصه المختزلة القوية عند وجوده بالحالة النقية، كما يتميز بمقدرته على تشكيل خلائط مع عدة فلزات أخرى مثل الألومنيوم والحديد. هذه الخلائط لها قدرة اختزالية كبيرة أيضاً.
- تظهر خليطة سيليسيد الكالسيوم مع الألومنيوم ناقلية كهربائية جيدة، حيث أن لمركب CaAlS موصلية فائقة، في حين أن CaAl2Si2 يمكن أن يكون شبه موصل سالب أو موجب، يكون في الشكل الأخير عند درجات حرارة أخفض من 150 كلفن. [2]
At ambient conditions calcium disilicide exists in two polymorphs, hR9 and hR18; in the hR18 structure the hR9 unit cell is stacked twice along the c axis. Upon heating to 1000 °C at a pressure of ca. 40 kBar, calcium disilicide converts to a (semi-stable) tetragonal phase.[3] The tetragonal phase is a superconductor with a transition temperature of 1.37 K[4] to 1.58 K.[5] Although there is no observable superconducting transition temperature for the trigonal/rhombohedral (i.e. hR9 and hR18 unit cells) at ambient pressure, under high pressure (>12 GPa/120 kbar) this phase has been observed exhibit superconducting transition.[6] When the trigonal phase is placed under pressures exceeding 16 GPa, there is a phase transition to an AlB2-like phase.[7]
التحضير
يحضر سيليسد الكالسيوم من تفاعل عنصري الكالسيوم والسيليكون في فرن كهربائي عند درجات حرارة مرتفعة. كما يمكن أن يحضر من تفاعل كربيد الكالسيوم مع ثنائي أكسيد السيليكون.
أما بالنسية لتحضير خلطة سيليسيد الكالسيوم مع الفلزات الأخرى فيجري ذلك بعملية اختزال لثاني أكسيد السيليكون وأكسيد الكالسيوم و/أو كربيد الكالسيوم في فرن كهربائي.
الاستخدامات
السبائك
Calcium silicide is used for manufacture of special metal alloys, e.g. for removing phosphorus and as a deoxidizer.
- يستخدم سيليسيد الكالسيوم عندما يدخل في تركيب الخلائط مع الألومنيوم مثلاً كمادة نازعة للأكسجين والفوسفور في صناعة الفولاذ.
تقنية الألعاب النارية
في تقنية الألعاب النارية، it is used as fuel to make special mixtures, e.g. for production of smokes, in flash compositions, and in percussion caps. Specification for pyrotechnic calcium silicide is MIL-C-324C. In some mixtures it may be substituted with ferrosilicon. Silicon-based fuels are used in some time delay mixtures, e.g. for controlling of explosive bolts, hand grenades, and infrared decoys.[بحاجة لمصدر] Smoke compositions often contain hexachloroethane; during burning they produce silicon tetrachloride, which, like titanium tetrachloride used in smoke-screens, reacts with air moisture and produces dense white fog. Gum arabic is used in some mixtures to inhibit calcium silicide decomposition.
- يستخدم في مجال تقنية الألعاب النارية في تحضير الدخان من أجل الخدع السينمائية.
تسخين الطعام
Self-heating cans of military food rations developed during WWII used a thermite-like mixture of 1:1 iron(II,III) oxide and calcium silicide. Such mixture, when ignited, generates moderate amount of heat and no gaseous products.[8]
انظر أيضاً
المصادر
- موسوعة رومب الكيميائية Römpp Lexikon Chemie, Georg Thieme Verlag
المراجع
- ^ أ ب ت Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.56. ISBN 1439855110.
- ^ Imai, M.; Abe, H.; Yamada (2004). "Electrical Properties of Single-Crystalline CaAl2Si2". Inorg. Chem. 43: 5186–5188. doi:10.1002/chin.200442010.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Evers, Jürgen (1979). "Transformation of three-connected silicon nets in CaSi2". Journal of Solid State Chemistry. 28 (3): 369–377. Bibcode:1979JSSCh..28..369E. doi:10.1016/0022-4596(79)90087-2.
- ^ Evers, J; Oehlinger, G; Ott, H.R (1980). "Superconductivity of SrSi2 and BaGe2 with the α-ThSi2-type structure". Journal of the Less Common Metals. 69 (2): 389. doi:10.1016/0022-5088(80)90297-0.
- ^ McWhan, D.B.; Compton, V.B.; Silverman, M.S.; Soulen, J.R. (1967). "Crystal structure and superconductivity of a high-pressure phase of CaSi2". Journal of the Less Common Metals. Elsevier BV. 12 (1): 75–76. doi:10.1016/0022-5088(67)90073-2. ISSN 0022-5088.
- ^ Sanfilippo, S.; Elsinger, H.; Nunez-Regueiro, M.; Laborde, O.; LeFloch, S.; Affronte, M.; Olcese, G. L.; Palenzona, A. (2000). "Superconducting high pressure CaSi2 phase with Tc up to 14K". Physical Review B. 61 (6): R3800. Bibcode:2000PhRvB..61.3800S. doi:10.1103/PhysRevB.61.R3800. Retrieved 20 April 2020.
- ^ Bordet, P.; Affronte, M.; Sanfilippo, S.; Nunez-Regueiro, M.; Laborde, O.; Olcese, G. L.; Palenzona, A.; LeFloch, S.; Levy, D.; Hanfland, M. (2000). "Structural phase transitions in CaSi2 under high pressure". Physical Review B. 62 (17): 11392. Bibcode:2000PhRvB..6211392B. doi:10.1103/PhysRevB.62.11392. Retrieved 20 April 2020.
- ^ Calvert, J. B. (2004) Flash! Bang! Whiz! An introduction to propellants, explosives, pyrotechnics and fireworks. University of Denver